脂代謝基因調控癌細胞轉移?CRISPR文庫精準鎖定關鍵靶點_風聞
源井生物-让基因编辑更简单!1小时前

研究背景
癌細胞轉移是導致癌症死亡率高的主要原因。為了轉移並定植到遠端器官,癌細胞可能需要進化出特定的脂質代謝程序,以支持其轉移和增殖能力,但是關於癌細胞脂質代謝的調控機制還不清楚。
今天,小源給大家解讀一篇發表在頂刊Cell上題為“ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization”的研究論文,該研究結合組學分析以及**CRISPR文庫篩選**方法,揭示了癌細胞轉移與多不飽和脂肪酸之間的關聯。
CRISPR文庫篩選
**文庫:**人代謝基因敲除文庫
**篩選方式:**體內篩選
篩選策略:
1. 兩種不同的高轉移潛能癌細胞進行體內篩選。2. 經人代謝基因敲除文庫一輪篩選後,選取潛在靶基因二次深度篩選。3. 收集癌細胞轉移後腫瘤組織,尋找癌細胞轉移相關靶點。實驗結果1. 癌細胞轉移潛能與鐵死亡敏感性聯合分析
使用MetMap(Cancer Metastasis Map)和CTRP(Cancer Therapeutics Response Portal)數據集聯合分析,研究發現具有高轉移潛能的癌症類型(如卵巢癌、肝癌和頭頸癌)對鐵死亡更加敏感。
基於液相色譜-串聯質譜(LC-MS/MS)的脂質組學研究發現,與患者的原發性腫瘤細胞相比,轉移灶腫瘤細胞表現出更高的多不飽和脂肪酸(PUFA)脂質水平。鐵死亡的關鍵特徵之一就是脂質過氧化,而PUFA是脂質過氧化的主要底物。這些結果表明,具有較強轉移潛力的卵巢癌細胞可能是由於具有較高水平的PUFA,從而對鐵死亡敏感。
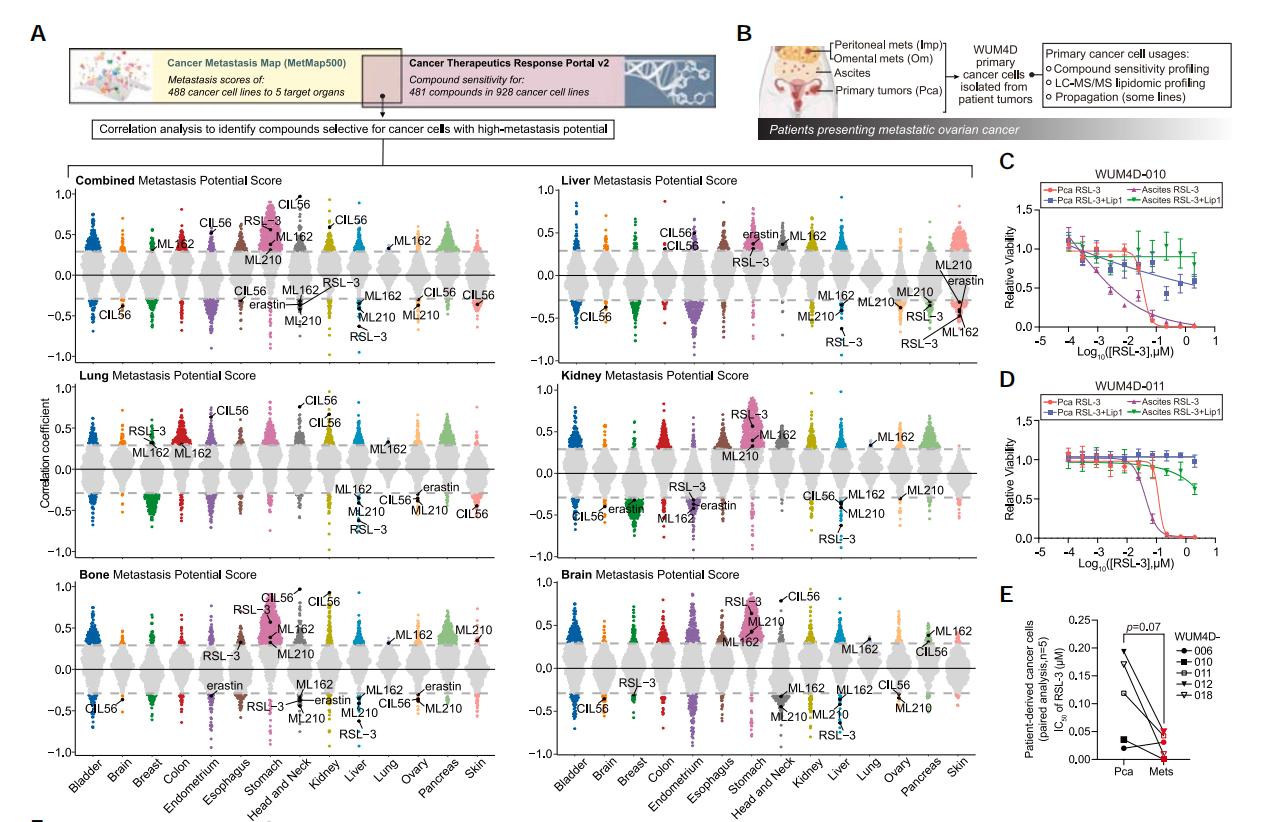
圖1 聯合分析發現鐵死亡與癌細胞轉移潛能相關
2. CRISPR文庫篩選揭示促癌細胞轉移基因
代謝適應對於癌症轉移是非常重要的,為了尋找促癌症轉移相關基因,研究者們使用人代謝基因敲除文庫構建了卵巢癌ES-2文庫細胞,並進行體內篩選。將ES-2文庫細胞皮下注射後,通過對比轉移至肝和肺的腫瘤細胞和原位皮下腫瘤細胞之間的差異,發現在肝轉移腫瘤和肺轉移腫瘤中,一些與膜脂代謝和脂肪酸氧化相關的基因,如TM7SF2、PHYH、PIK3CG和PLA2G4C均被顯著富集。
為了進一步驗證初篩結果,研究者們使用第一次篩選出的前100個被顯著富集或丟失的基因進行了二輪篩選。通過比較分析發現,NMNAT1和HADHB基因在肝和肺轉移腫瘤中均顯著丟失。此外,不飽和脂肪酸代謝相關基因ACSL4在肺轉移腫瘤中也被顯著丟失;通過相關性分析也發現ACSL4基因表達量高的卵巢癌細胞也具有更高的轉移潛能。
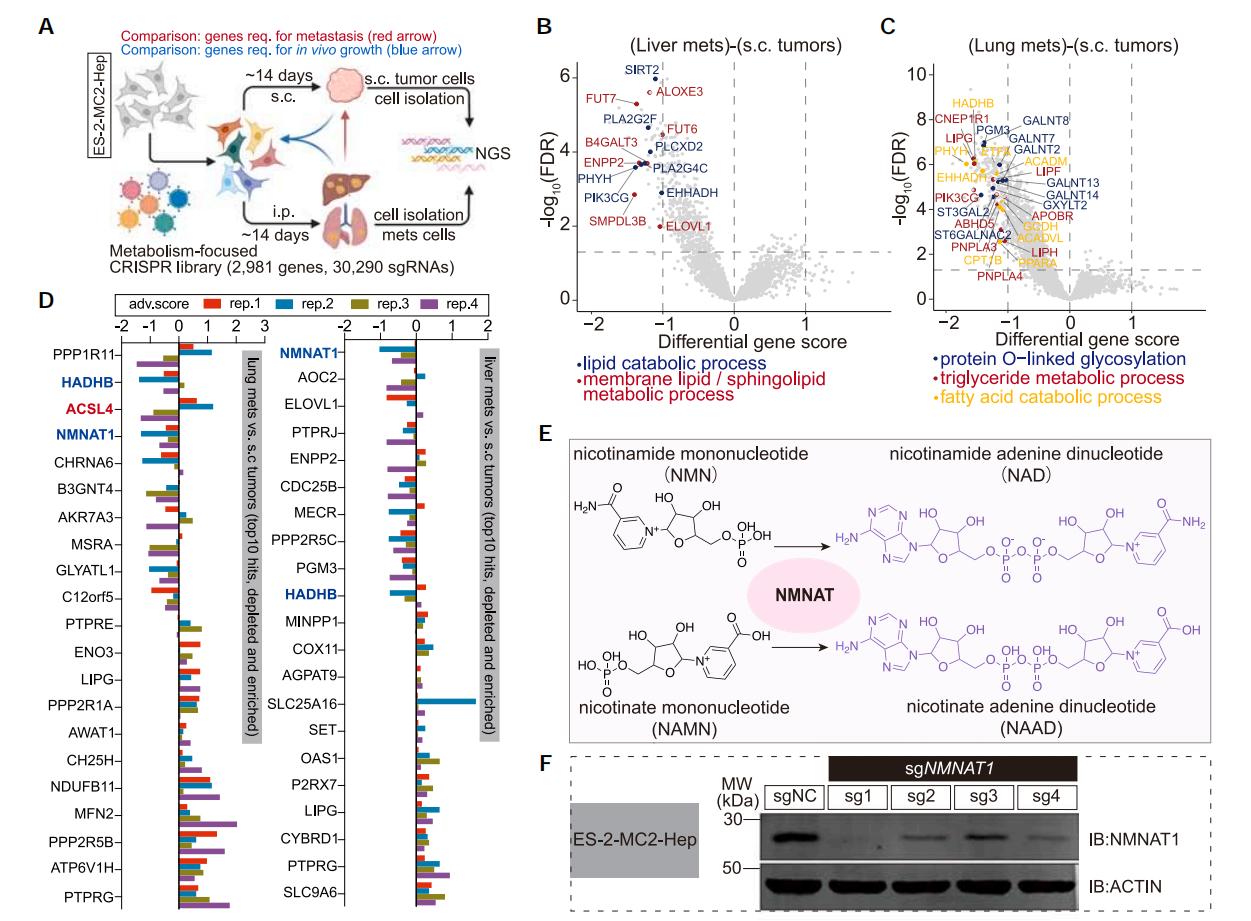
圖2 CRISPR文庫篩選揭示癌細胞轉移調控基因
3. ACSL4促進癌細胞在血液轉移過程中外滲
為了確認ACSL4基因在癌細胞轉移過程中的作用,研究者通過尾靜脈注射ACSL4基因敲除ES-2細胞後,結合免疫熒光,發現靜脈注射的ACSL4基因敲除ES-2細胞形成的轉移病灶更少、更小,而且這些病灶顯示出不尋常的血管內定位,頻率很高,表明外滲功能受損。ACSL4作為不飽和脂肪酸合成過程中的關鍵酶,研究者們推測ACSL4基因敲除後細胞膜流動性可能受損。通過熒光探針以及Transwell檢測,研究發現ACSL4基因敲除會顯著降低細胞膜流動性,並影響細胞侵襲能力,而通過ARA預處理以提高細胞的PUFA含量,可以提高ACSL4基因敲除ES-2細胞尾靜脈注射的腫瘤轉移能力。這些結果表明,ACSL4通過調控細胞膜PUFA含量,增強擴散癌細胞的膜流動性和侵襲性來促進轉移性外滲。
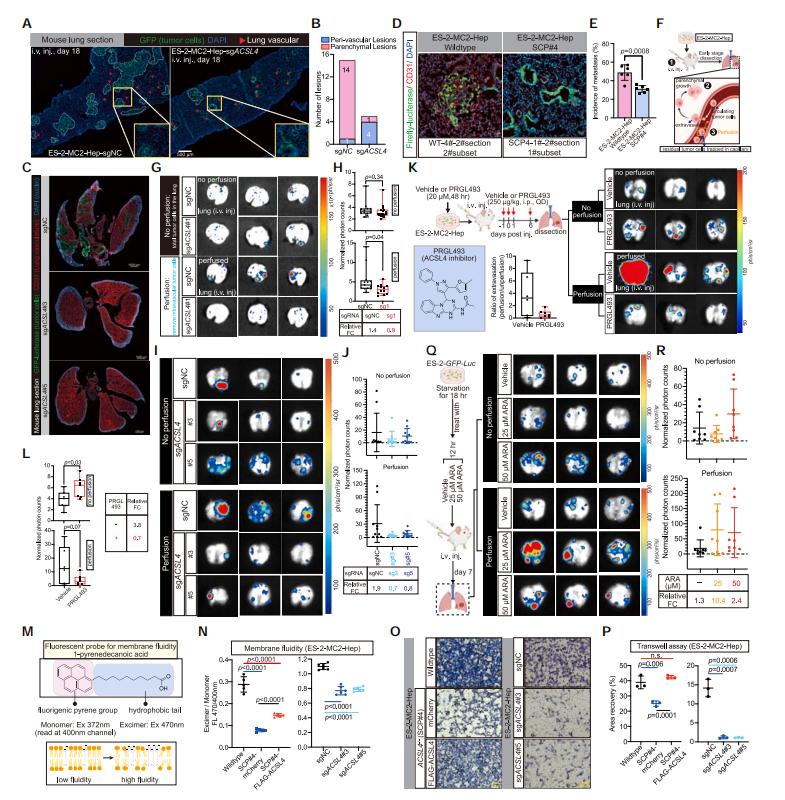
圖3 ACSL4促進癌細胞轉移外滲
4. ACSL4還會促進其他癌症細胞轉移
研究者進一步使用具有高轉移潛能的肝癌細胞SK-HEP-1進行了CRISPR文庫篩選,同樣發現NMNAT1和ACSL4基因被顯著丟失。並且通過ACSL4基因敲除和ARA處理增加細胞PUFA含量,證實了不飽和脂肪酸對癌細胞轉移的促進作用。
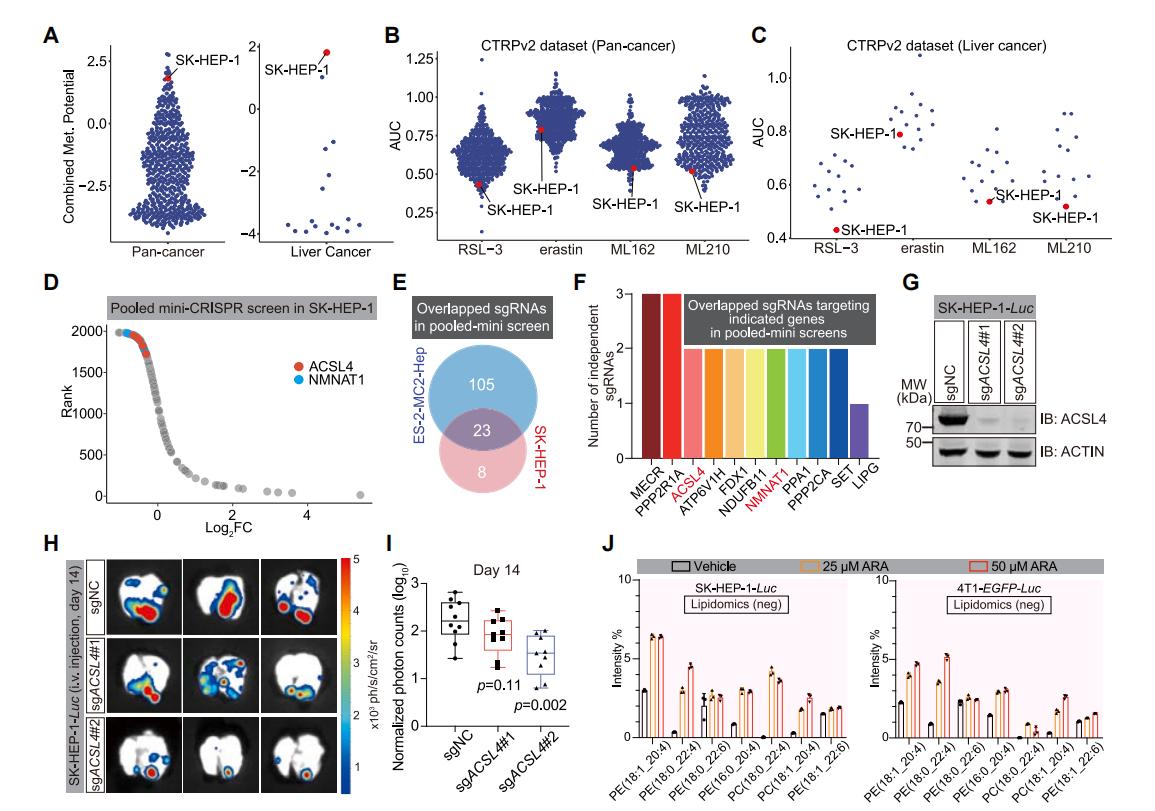
圖4 ACSL4在肝癌細胞CRISPR文庫篩選中被顯著富集
5. ACSL4和ECH1雙重抑制可抑制癌症轉移
儘管ACSL4敲除能抑制癌細胞的轉移,但是由於腫瘤具有高度侵襲性,後期腫瘤轉移負荷仍然難以控制。為了探索抑制腫瘤生長/轉移的方法,研究者們通過比較植入後腫瘤中sgRNA丰度和注射前細胞中sgRNA丰度,發現ECI1、ECH1等基因在各種轉移瘤中均顯著丟失,敲除這些基因也顯著抑制了癌細胞的生長。進一步,通過構建ACSL4和ECH1雙基因敲除細胞系,研究發現與單基因敲除細胞相比,雙基因敲除細胞肺轉移負荷明顯減少。
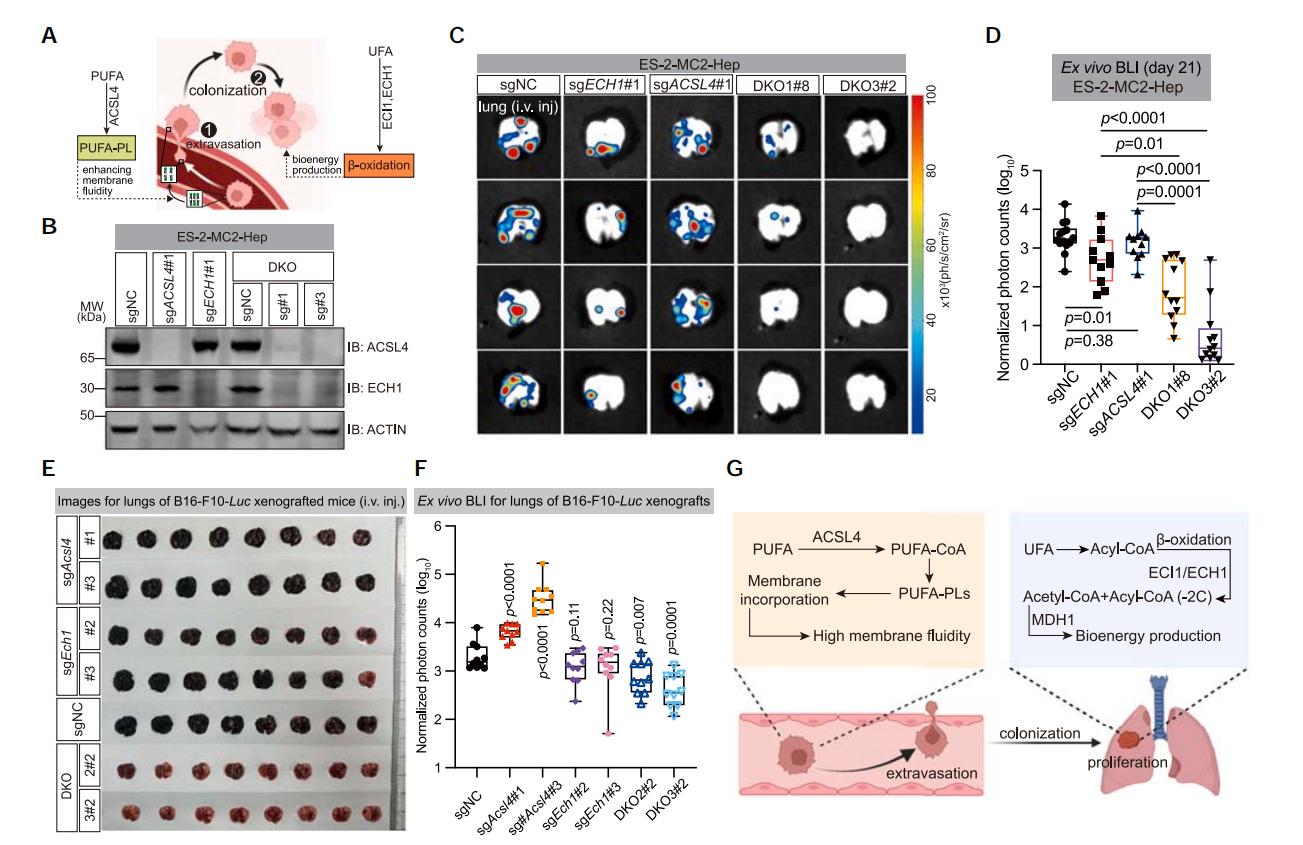
圖5 ACSL4和ECH1雙基因敲除抑制癌細胞轉移
結論
通過**CRISPR篩選,研究者鑑定出ACSL4是促進血行轉移的關鍵因子**,其通過增強細胞膜流動性和侵襲性來促進轉移。此外,高PUFA含量的腫瘤細胞依賴ECI1/ECH1進行β-氧化,聯合抑制ACSL4和ECH1可有效抑制癌症轉移。