李藥師:Nature子刊,只需一針,終生降血脂,低密度脂蛋白降低70%!_風聞
熊猫儿-57分钟前
近年來,心血管疾病(CVD)已成為全球範圍內主要的死亡原因之一,而其中一個重要的危險因素便是血脂升高,尤其是低密度脂蛋白膽固醇(LDL-C),被稱為“壞膽固醇”的升高。
降低血脂的傳統方法包括生活方式干預(如飲食控制和運動)以及藥物治療(如他汀類藥物和PCSK9抑制劑)。然而,這些方法均需要長期使用,患者依從性往往較低,且對某些高風險患者並不足夠有效。

2025年2月,Nature Medicine雜誌發表了一篇革命性研究文章,介紹了一種全新的一次性降血脂策略——通過表觀遺傳編輯(epigenetic editing)靶向PCSK9基因,實現長期甚至終生降低LDL-C水平的效果。該技術有望在高膽固醇血癥的治療上引發新的變革。本文將為大家系統介紹這一創新療法的原理、研究數據以及其潛在的廣泛影響。
從LDL-C和PCSK9的關聯説起
低密度脂蛋白膽固醇(LDL-C)水平升高是動脈粥樣硬化性心血管疾病(ASCVD)的主要驅動因素之一。這些“壞膽固醇”在血管中逐漸積聚,形成動脈斑塊,從而增加心肌梗死、卒中等嚴重疾病的風險。
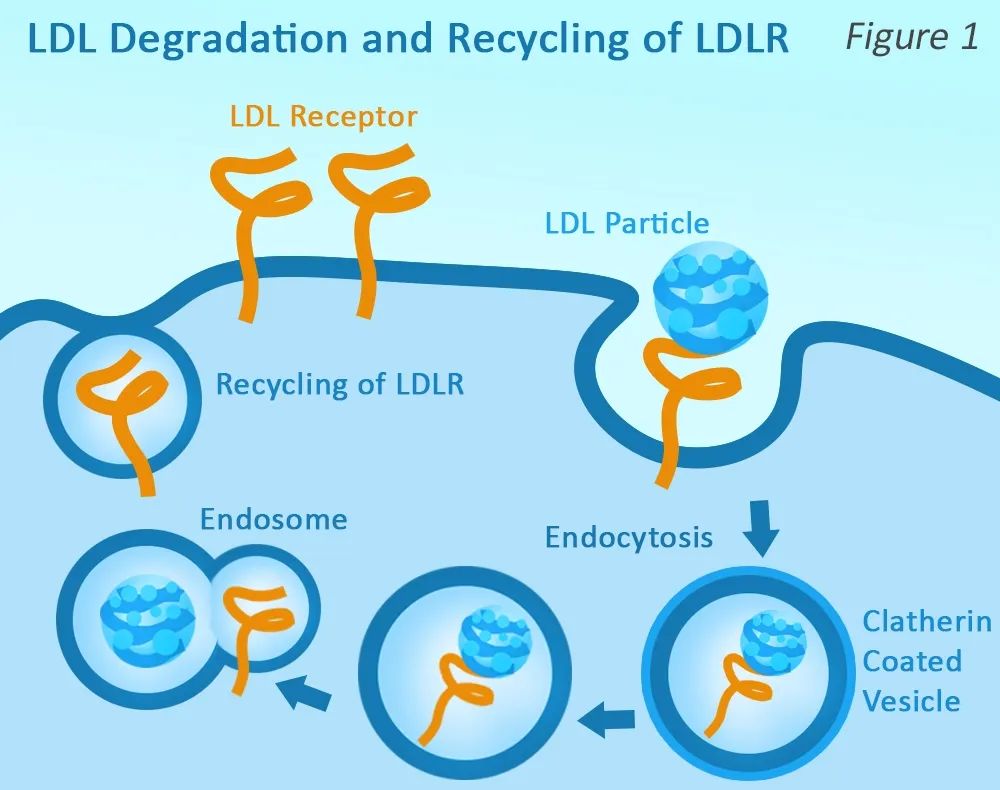
PCSK9(前蛋白轉化酶枯草溶菌素9)基因在膽固醇代謝中起到了重要作用。PCSK9蛋白通過結合肝細胞表面的LDL受體,促使受體被降解,降低了肝細胞清除血液中LDL-C的效率。因此,抑制PCSK9蛋白的生產或功能能夠顯著改善LDL-C的清除效率並降低其水平。
目前臨牀上已經有PCSK9抑制劑產品應用,包括每2到4周注射一次的單抗類藥物(如託萊西單抗,依洛尤單抗等),還有每半年注射一次的siRNA藥物(如英克司蘭),這些藥物都是通過注射方式阻斷PCSK9作用,實現了顯著的降脂效果。
然而,這些藥物需要長期、定期注射,仍然存在依從性不足和治療成本高昂的問題。如何開發一種一次性治療,帶來持久效果的關鍵突破,讓患者免受頻繁用藥的困擾,一直是科學界的研究熱點。
革新:表觀遺傳編輯技術的應用
在本次發表的研究中,科學家基於表觀遺傳學的最新技術,開發了一種獨特的基因編輯方法,直接靶向人類PCSK9基因的啓動子區域,通過精確誘導DNA甲基化永久“關閉”該基因的表達。這種方法被稱為表觀遺傳編輯(epigenetic editing),其核心特點是無需改變DNA序列,通過化學修飾調節特定基因的活性。
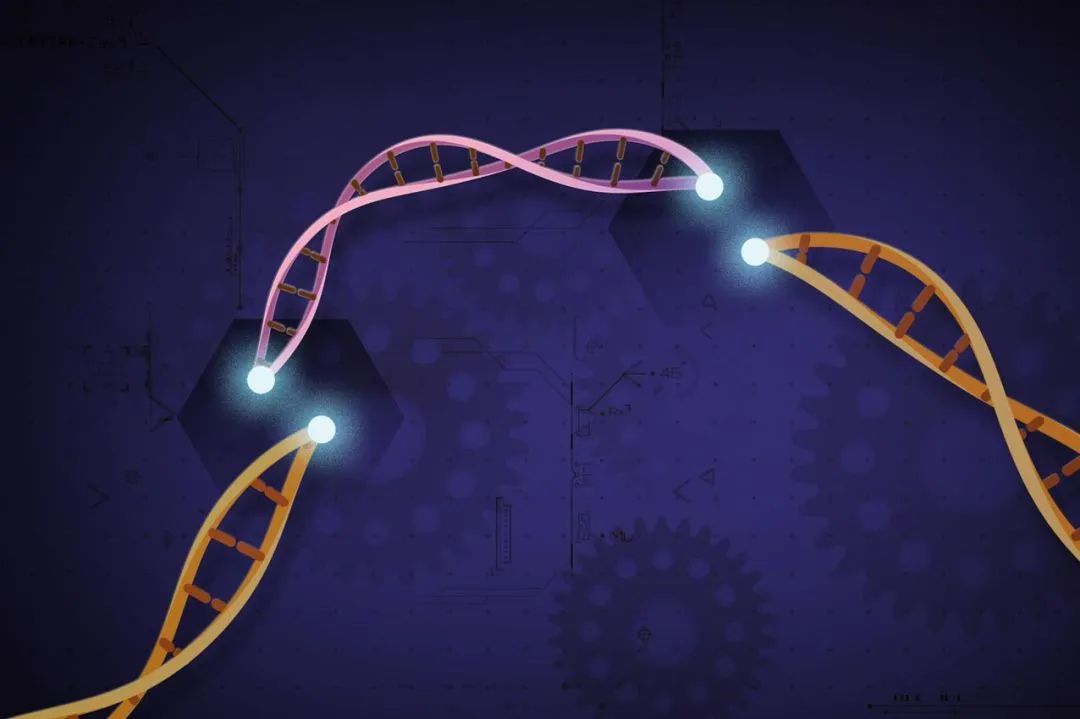
表觀遺傳學研究表明,DNA甲基化是一種重要的基因調控機制。當啓動子區域的CpG位點上被加上甲基時,會阻礙基因轉錄因子結合,導致目標基因沉默或表達下降。
這項研究應用了一種新型的表觀遺傳編輯工具,通過納米顆粒封裝的mRNA遞送至肝細胞,誘導PCSK9啓動子區域的DNA甲基化,達到永久性沉默PCSK9表達的效果。結果表明,單次注射便能實現長期甚至終生的PCSK9蛋白抑制作用。
研究數據:降脂效果顯著
為了驗證這一技術,研究人員在攜帶人類PCSK9基因的轉基因小鼠中進行了實驗。一針注射該表觀遺傳編輯劑後,小鼠展現出以下驚人的結果:
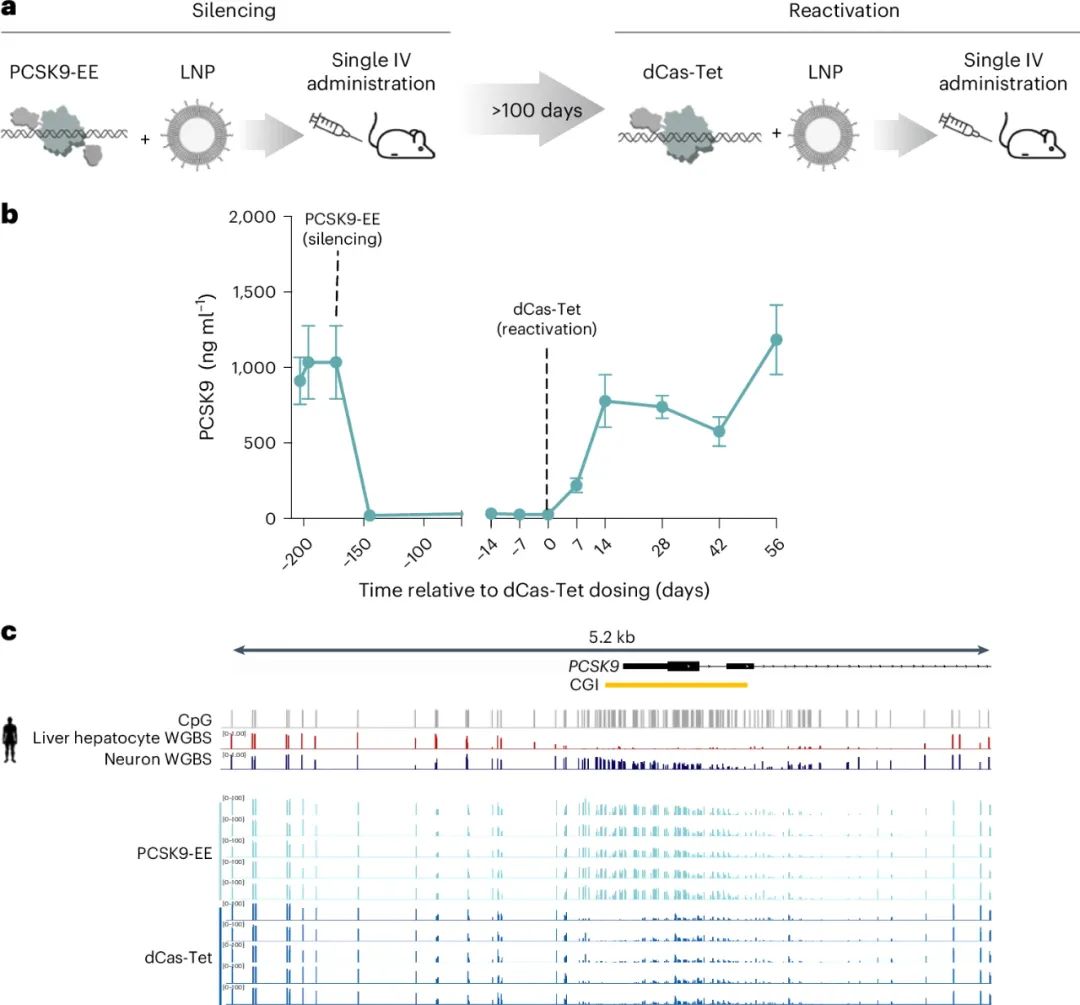
1. PCSK9蛋白減少90%
單次注射後,循環中的PCSK9蛋白水平下降了90%以上,這表明表觀遺傳編輯成功關閉了PCSK9基因表達。
2. LDL-C水平降低70%
與對照組相比,LDL-C水平顯著降低了約70%,這個降脂幅度遠超過傳統PCSK9抑制劑的單次使用效果。
3. 長期維持效果
動物試驗結果顯示,該藥物療效在1年後依然保持穩定,且在部分實驗動物中可持續超過1年。這表明這種表觀遺傳編輯具有高度持久性。
科學家進一步在實驗中探討了這一技術的可逆性。他們利用另一種表觀遺傳激活工具,通過清除PCSK9基因啓動子上的甲基化,重新激活了PCSK9基因的表達。結果發現,基因表達被完全恢復,LDL-C水平也逐步回升至基線。這一發現證明了這種基因編輯技術不僅高效,而且具有可逆性,解決了基因編輯持久性安全性的部分疑慮。
與傳統的降脂藥物或基因編輯工具相比,這種通過DNA甲基化調控PCSK9表達的新方法具有以下獨特優勢。從原理上來説,一次性治療即可實現長期效果,能夠使遠離頻繁注射或口服藥物的煩惱,增強患者的依從性。
DNA甲基化並不改變基因序列,因此避免了CRISPR-Cas9等傳統基因編輯工具可能帶來的DNA斷裂和脱靶效應。研究表明,甲基化狀態能夠隨基因複製保持穩定,但也可以通過酶促反應逆轉,實現可控性。
一次性治療可能顯著減少藥物成本及長期醫療資源的消耗,對於患者和醫保系統都意義重大。對於這種新型的降脂治療方法,其潛在的使用人羣主要包括以下3類——
高心血管事件風險的患者:對於已有心血管事件(如心梗、卒中)病史的患者,或LDL-C水平無法達標的高風險患者,此方案可提供終生降脂保護。
傳統藥物無效或不耐受者:某些患者對他汀類藥物或PCSK9單抗耐受性不佳,該療法可作為替代方案。
有家族性高膽固醇血癥的患者:由於遺傳缺陷導致LDL-C嚴重升高的患者,可高度受益於這一技術。
面臨的挑戰與未來展望
儘管表觀遺傳編輯技術展現了卓越的潛力,但從實驗室研究到臨牀應用仍需解決以下多方面的挑戰。
首先是長期安全性方面。對於表觀遺傳編輯,雖然目前已體現出極高的可控性,但其長期效果和脱靶效應(即編輯未指定靶點基因的風險)仍需大規模臨牀驗證。
其次是藥物遞送系統的問題,一次性注射要求高效穩定的遞送系統,目前仍需要進一步優化納米顆粒的研發和應用。
另外,也可能會面臨倫理問題。基因編輯技術無論對患者還是社會都可能引發倫理爭議,需要制定完善的監管政策。
在Nature Medicine上新近發表的這篇突破性研究論文揭示了表觀遺傳編輯技術在降脂治療中的廣闊前景。通過靶向沉默PCSK9基因,這種新型“一次性”注射方案不僅解決了頻繁用藥的依從性問題,還帶來了顯著和持久的降脂效果。對於心血管疾病高風險人羣和家族性高膽固醇血癥患者,這將是一大福音。
展望未來,這一技術一旦通過臨牀驗證走向市場,或將改寫降脂治療領域的遊戲規則,推動個性化醫療和精準醫學進入新時代。我們期待着更多臨牀試驗數據的公開,為患者和醫生帶來更多選擇的希望。
參考文獻
Tremblay, F., Xiong, Q., Shah, S. S., et al. (2025). A potent epigenetic editor targeting human PCSK9 for durable reduction of low-density lipoprotein cholesterol levels. Nature Medicine.