是時候該重新認識泰它西普了_風聞
氨基观察-生命科技新时代的商业智库和价值灯塔24分钟前
在自身免疫藥物的未來篇章中,註定會有眾多中國藥企的身影。榮昌生物的泰它西普,正在向市場證明這一點。
4月9日,泰它西普治療重症肌無力的Ⅲ期臨牀試驗數據,引起市場廣泛關注。
結果顯示,泰它西普具有“快速起效、緩解深度且持久、安全性優異”的特點,治療第24周時,MG-ADL評分改善≥3分的患者比例高達98.1%,QMG評分改善≥5分的患者比例達87%。在非頭對情況下療效優於其它生物製劑;並且,相比於其它生物製劑安全性更為良好。憑藉綜合優勢,其有望重塑重症肌無力的治療格局。
該Ⅲ期臨牀試驗數據也是被選為“最新突破性研究”,在2025年美國神經病學會年會(AAN)上進行重點口頭報告。AAN是全球最大規模的神經科學會議之一,“最新突破性研究”+“重點口頭報告”的榮譽,顯示了泰它西普在重症肌無力治療領域的強大競爭力。
市場此前可能低估了泰它西普的價值。作為一款自身免疫藥物,泰它西普在紅斑狼瘡等領域的潛力已被充分證明,其未來潛力也絕不止於重症肌無力。隨着重症肌無力治療在國際上獲得認可,泰它西普的價值重估已一觸即發。
/ 01 / 炸裂數據顛覆藍海市場
重症肌無力Ⅲ期臨牀試驗數據引發市場對於泰它西普的追逐,並不讓人感到意外。
作為一種自身免疫疾病,重症肌無力在罕見病羣體中屬於常見病。據開源證券研報,MG全球超過 70 萬人,其中美歐合計約有12萬存量患者,中國約有20萬存量患者。並且,由於全球對於重症肌無力治療的重視程度高,治療需求旺盛。2024年全球5款生物製劑銷售額在百億美金左右。
目前,重症肌無力的藥物研發遠未到終局,泰它西普就是一位有力的角逐者。
從機制來看,泰它西普可同時抑制BLyS和APRIL兩個細胞因子與B細胞表面受體的結合,“雙管齊下”阻止 B 細胞的異常分化和成熟,從而減少致病性抗體的產生。簡而言之,泰它西普從更上游源頭的控制疾病,潛在效果更深入也更持久。
最新公佈的Ⅲ期臨牀結果,則是證實了這一點。
在Ⅲ期研究中,榮昌生物通過主觀指標MG-ADL評分、客觀指標QMG評分結合來觀察病情的改善情況。其中,MG-ADL評分評估MG患者的症狀對日常生活質量的影響,側重患者主觀體驗和日常功能;QMG評估患者全身肌羣肌力和耐力,側重客觀測量。兩者結合的評估,更全面也更客觀。
結果顯示,泰它西普治療重症肌無力,具有起效快的特點:在治療第四周的時候,不管是MG-ADL評分還是QMG評分都是顯著下降。
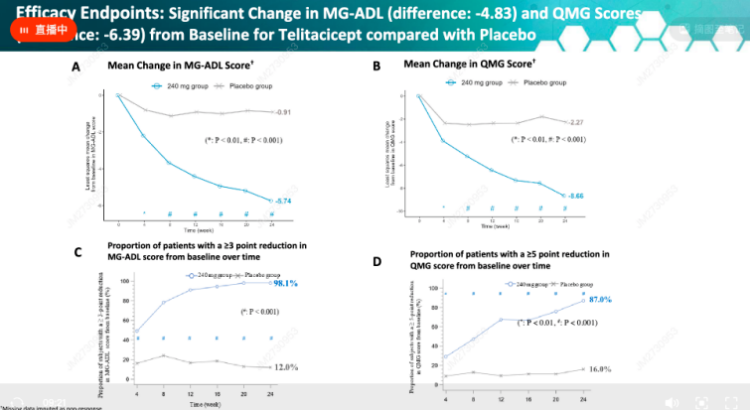
同時,**治療效果具有緩解深入的特點。**泰它西普治療24周時:
MG-ADL評分較基線降低5.74分,安慰劑組降低0.91分;MG-ADL評分改善≥3分的患者比例高達98.1%,遠高於安慰劑組的12%。
QMG評分較基線降低8.66分,安慰劑組降低2.27分;QMG評分改善≥5分的患者比例達87%,遠高於安慰劑組的16%。
**也就是説,幾乎所有患者都能獲得有效的緩解,這並不容易。**在非頭對頭情況下,其它機制的生物製劑,改善≥3分的患者比例最高的也僅在70%左右,QMG評分改善≥5分的患者比例則在最高的不到60%。
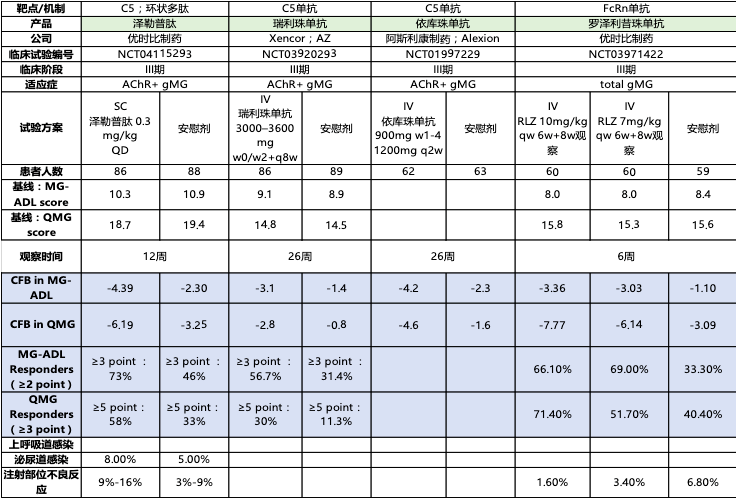
(圖片來源:開源證券研究所)
**而泰它西普不僅有效緩解比例高,且緩解極為“深度”。**如下圖所示,MG-ADL評分改善≥6分的患者比例,仍然超過60%;QMG評分改善≥8分的患者比例,仍然超過50%。
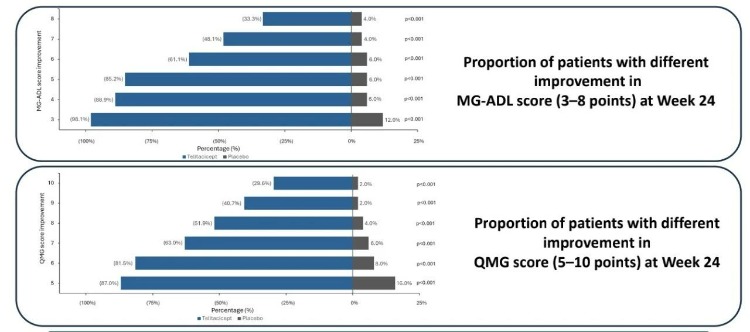
同時,泰它西普還具有持續改善的趨勢。隨時間推移,泰它西普組MG-ADL和QMG評分持續下降,第24周改善幅度達峯值。從當前的曲線來看,斜率似乎還有下降空間。也就是説,泰它西普的治療效果可能更炸裂。
更重要的一點是,泰它西普安全性非常優異。**目前,已經上市的生物製劑,存在因為安全性問題不能長期給藥或者增加高風險副作用的可能。**比如,依庫珠單抗則可能增加腦膜炎奈瑟菌感染風險,因此應在治療開始前接種疫苗。
而泰它西普總體不良事件(AE)發生率與安慰劑組相當,感染類AE發生率低於安慰劑組(45.6% vs 59.6%),且益於臨牀管理,為長期用藥提供了有力支撐。
綜合上述數據來看,泰它西普有極大的可能,重塑重症肌無力治療格局。
在此前,泰它西普該適應症已經接連獲得FDA、CDE突破性療法認定,足以證明監管認可其價值。而此次能夠作為“最新突破性研究”入選2025年美國神經病學會年會重磅口頭報告,也進一步證明了泰它西普在重症肌無力領域實力彪悍。
參考華爾街的定價錨點,僅重症肌無力適應症就足以支撐一家Biotech百億美金的市值。正因如此,市場開始重新審視泰它西普的價值。
/ 02 / 不止於重症肌無力
雖然此次重症肌無力適應症的進展讓市場重新認識到了泰它西普,但泰它西普的價值絕不僅限於重症肌無力。
作為一款靶向B細胞的自身免疫療法,泰它西普憑藉其機制的針對性,有望成為一種“廣譜”藥物,攻克由B細胞異常誘發的多種自身免疫疾病,包括系統性紅斑狼瘡、IgA腎病、乾燥綜合徵、重症肌無力等超級大適應症。
實際上,在重症肌無力之前,泰它西普的表現一直十分出色,已經在系統性紅斑狼瘡(SLE)和類風濕關節炎兩大領域成功突圍,並展現出BIC的實力。
例如,作為全球首個用於SLE治療的雙靶生物製劑,泰它西普開啓了“雙靶時代”。在療效方面,第52周時,SRI-4應答率在泰它西普治療組達到82.6%,而安慰劑組僅為38.1%。所有敏感性分析結果均顯示,泰它西普組的SRI-4應答率顯著高於安慰劑組,且該應答率超過了其他單靶生物製劑(響應率在38%-58%之間)。
隨着在重症肌無力領域的正式突圍,泰它西普解鎖了第三大超級適應症,而未來還將繼續開拓更多“大藍海”。
**在乾燥綜合徵領域,泰它西普極具競爭力。**Ⅱ期臨牀試驗數據顯示,經安慰劑調整的最小二乘法分析,泰它西普160mg組在第24周的ESSDAI評分較基線變化值為-4.3,而VAY736的相應變化值為-1.92。
目前,泰它西普在國內的乾燥綜合徵Ⅲ期臨牀試驗已於2024年5月完成患者入組工作,正在推進給藥隨訪工作;同時,其美國Ⅲ期臨牀試驗也已獲得FDA批准。在研發進度方面,泰它西普處於全球領先地位。
這意味着泰它西普的市場天花板有望進一步打開。據中泰證券研究報告預測,全球乾燥綜合徵患者發病人數在2025年將達到409.28萬人。乾燥綜合徵可能導致多器官系統的嚴重全身性症狀,危害極大,但目前有效療法稀缺。如果泰它西普能夠順利獲批,有望憑藉其療效和先發優勢快速放量。
此外,**泰它西普在IgA腎病市場也備受期待。**憑藉其對因治療的精準性,泰它西普能夠直接針對疾病的致病因素進行干預。此前的Ⅱ期臨牀試驗數據顯示,泰它西普在降低蛋白尿方面具有起效快、緩解程度深的特點。
IgA腎病藥物市場是一個典型的藍海市場。根據弗若斯特沙利文的測算,2025年全球IgA腎病患者總數將達到近980萬,其中包括230萬中國患者。在疾病過程中,多達50%的患者可能需要進行透析或腎臟移植,疾病負擔極大,但目前有效療法稀缺。如果泰它西普研發順利,不僅能滿足患者的迫切需求,還將進一步提升其自身價值。
除上述適應症外,榮昌生物還在積極探索和評估泰它西普用於治療其他自身免疫性疾病。例如,膜性腎炎的Ⅲ期研究已經與CDE進行了溝通,結締組織病相關間質性肺疾病研究的IND申請也已完成提交。
此外,鑑於泰它西普突出的治療潛力,其還得到了研究者的廣泛關注與興趣。目前,已開展包括抗磷脂綜合徵、原發性免疫性血小板減少症、免疫介導壞死性肌炎等上百項研究者發起的研究。
不難預見,**泰它西普的未來可能是一種治療範圍極其廣泛的藥物,其價值也將由多個適應症的“合力”決定。**僅僅重症肌無力就引發了市場對泰它西普的重估,而更多適應症的進展無疑留下了極為豐富的想象空間。
/ 03 / 重估泰它西普
不過,從此次重症肌無力適應症的進展與市場反饋來看,泰它西普的價值在過去一直處於未被充分認知的狀態。
正如上文所説,僅在重症肌無力適應症領域,泰它西普的潛在銷售額上限就非常高,華爾街也充分認可這類藥物的價值,能夠給出百億美金的估值。
泰它西普更多適應症的協同效應,只會讓其市場潛力更加充滿想象空間,甚至可能複製修美樂那樣持久放量的軌跡:從2002年在美國首次上市並開始快速放量,到2012年以92.65億美元成為全球藥物銷售額第一名,再到2023年創下超過200億美元的自身免疫藥物銷售記錄,修美樂展現了其市場表現的持久性和高度。
但目前榮昌生物在手握多款潛力管線的情況下,市值卻僅有100多億人民幣。雖然泰它西普未來能取得多高的成就還需要驗證,但至少結合其目前已經取得的成就來看,其市值似乎並不完全匹配。
當然,這種狀況也情有可原。過去,市場對泰它西普潛力的忽視,主要由兩大因素主導:一是對國內自免市場的擔憂;二是對泰它西普能否在海外複製臨牀數據的顧慮。
但目前來看,這些疑惑正在逐步消散。
首先,國內自免藥物市場其實並不小,從諾華的可善挺到賽諾菲的度普利尤單抗的持續放量,均證明了這一點。榮昌生物的泰它西普也用持續的放量證明了國內市場的空間:2024年,泰它西普銷量已經達到152.44萬支,同比增長94.87%。
其次,泰它西普也有能力在海外複製國內的成功。此次重症肌無力臨牀數據獲得AAN的高度認可,就充分反映了這一點。事實上,泰它西普一直是國際化程度較高的創新藥之一,其用於重症肌無力的Ⅲ期國際多中心臨牀研究正在順利推進,治療系統性紅斑狼瘡、原發性乾燥綜合徵的Ⅲ期國際多中心臨牀研究也在持續開展中。
顯而易見,隨着泰它西普更多適應症全球臨牀數據的讀出,其價值將進一步得到證明。從現在開始,我們需要重新評估泰它西普的價值。