如何高效應用熒光素酶報告?從設計到檢測的全流程解析_風聞
源井生物-让基因编辑更简单!17分钟前
熒光素酶報告(Luciferase reporter)是一種廣泛應用於生物學研究的工具,其通過催化底物(如熒光素)產生生物發光信號,從而實現對基因表達、信號通路活性或分子相互作用的即時監測。
生物發光的機制:熒光素酶以熒光素作為底物,發生氧化還原反應,將部分化學能轉換成光能的過程(不同的熒光素酶所需底物不一樣,有些熒光素酶需依賴ATP如來源於螢火蟲的Fluc,無需ATP的Rluc)
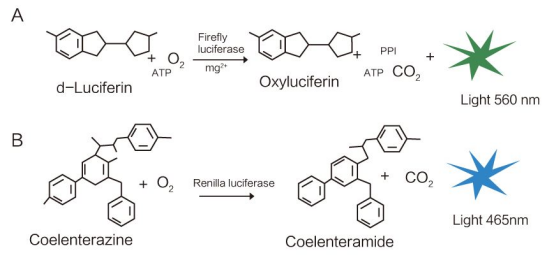 既然熒光素酶報告這麼厲害,那要怎麼應用?不管你是在基礎生物學方面的研究,還是藥物開發篩選,或者是疾病機制與治療研究,甚至是環境污染物檢測,都可以按照這“三板斧”去進行:
既然熒光素酶報告這麼厲害,那要怎麼應用?不管你是在基礎生物學方面的研究,還是藥物開發篩選,或者是疾病機制與治療研究,甚至是環境污染物檢測,都可以按照這“三板斧”去進行:
1.設計報告載體及構建報告系統
由於應用場景較多,以下列舉幾個不同方面研究的設計思路:
①啓動子/增強子活性分析:將熒光素酶基因與目標啓動子或增強子序列連接(若研究microRNA,可將目的基因的3’UTR與熒光素酶基因連接);
②信號通路研究:將熒光素酶基因置於特定信號通路響應元件下游;
③高通量藥物篩選:將目標基因的啓動子、調控元件(如NF-κB、STAT3等)或響應元件(如抗氧化反應元件ARE)與熒光素酶基因連接;
④環境污染物檢測:根據目標污染物選擇對應元件(重金屬污染可選擇ARE(抗氧化響應元件),二噁英類污染物可選擇AhR響應元件),與熒光素酶基因連接;
本步驟核心是通過基因工程手段,將響應元件與熒光素酶基因偶聯,通過檢測熒光信號變化,來進行判斷。
2.構建穩定細胞系
①根據研究目的選擇細胞系,並通過預實驗測試細胞對篩選抗生素的敏感性;(一般無特殊要求的情況下,選擇易轉染細胞如HEK293T、HepG2、HeLa等);
②根據使用的載體類型,選擇的轉染方式會存在不同:
像PiggyBac載體可使用脂質體轉染或電穿孔;若使用病毒載體需先進行病毒包裝後,再使用病毒對細胞進行感染;
③抗生素篩選穩定株
轉染後24-48小時,加入篩選抗生素進行起始篩選;後續進行持續篩選,每2-3天更換含抗生素的培養基,持續1-2周,直至未轉染細胞全部死亡;
④單克隆篩選,可使用流式細胞篩選或極限稀釋法獲得單克隆。
上述步驟關鍵在於轉染方式的選擇與抗生素藥物篩選濃度,均可通過預實驗去確認最優的轉染方式以及最低的藥物有效濃度。
3.熒光信號檢測
①裂解細胞,加入裂解緩衝液對細胞進行處理,釋放熒光素酶;②添加底物,根據相應的熒光素酶加入熒光素,並進行孵育反應;③讀取光信號,使用酶標儀等,檢測發光強度;
常見問題分析與解決
1.信號弱或無信號
可能原因:
①質粒轉染效率低
保證質粒濃度和純度(OD260/280比值1.8-2.0),同時優化轉染條件(更換轉染試劑、調整DNA與試劑比例,或改用更易轉染的細胞系(如HEK293T));
②熒光素酶啓動子活性過低
可使用陽性對照質粒(如含強啓動子CMV的熒光素酶載體)確認檢測系統是否正常;同時可擴大啓動子克隆區域,確保包含關鍵調控元件(如轉錄因子結合位點)。
③細胞狀態不佳
建議使用低傳代次數(<30代)、高活力(>90%)的細胞,避免污染或過度匯合(推薦轉染時密度為70-80%);
④檢測時間點不當
縮短或延長檢測時間,多數啓動子活性在轉染後24-48小時達峯,需通過預實驗確定最佳時間窗口。
2.背景信號過高
可能原因:
①裂解不充分:可適當延長細胞的裂解時間(15-30分鐘),操作過程中使用渦旋震盪;
②細胞沉澱雜質干擾:可對裂解產物進行離心操作(12,000 rpm,5分鐘),離心後取上清檢測;
③底物自發氧化:嚴格執行避光操作,快速檢測儘可能15分鐘內完成操作。
④本底對照異常:建議使用無啓動子的空載體(如pGL3-Basic)作為陰性對照,確保其信號顯著低於實驗組。3.數據重複性差
優化策略:
①從轉染均一性着手,採用穩定轉染細胞系,或使用96孔板轉染以減少孔間差異;
②細胞鋪板標準化,建議使用細胞計數儀確保每孔細胞數儘量相近;
③操作流程統一,制定詳細的實驗計劃,固定加樣順序和檢測時間,避免底物孵育時間波動。