AD新藥之爭,提前分出勝負!_風聞
城市观察-9分钟前
歐洲時間4月15日,侖卡奈單抗正式獲得歐盟批准上市,用於治療經臨牀診斷為輕度認知障礙及輕度痴呆的早期阿爾茨海默病(AD)成人患者,且為載脂蛋白E ε4(ApoE ε4)非攜帶者或雜合子,並經確認存在β-澱粉樣蛋白病理。
此次獲批,使侖卡奈單抗成為首款在歐盟獲批用於治療符合條件的早期阿爾茨海默病(early AD)患者的、針對該疾病潛在病因的藥物。
而20天前,歐洲藥品管理局(EMA)人用藥品委員會(CHMP)卻以 “療效不足以抵消安全風險” 為由,拒絕批准多奈單抗在歐盟上市。
在很多人眼裏,侖卡奈單抗和多奈單抗大同小異,都是針對Aβ的藥物,這讓EMA的拒批看起來非常無理,但實際上二者在證據的充分性和獲益程度上,表現大相徑庭。
漫漫審批路
EMA向來是全球最為保守的藥物審批部門,侖卡奈單抗在歐盟的批准也是一波三折。EMA是先拒絕了侖卡奈單抗的上市申請,後經補充遞交數據再次申請後,才由拒絕轉為建議批准。
期間多奈單抗吸取了侖卡奈單抗第一次闖關失敗被拒的經驗,直接放棄挑戰ARIA發生率較高的ApoE ε4攜帶人羣。但EMA依然認為,即便對於非ApoE4攜帶者這一小規模人羣,多奈單抗的有限療效收益仍不足以抵消其引發致命性ARIA的風險。

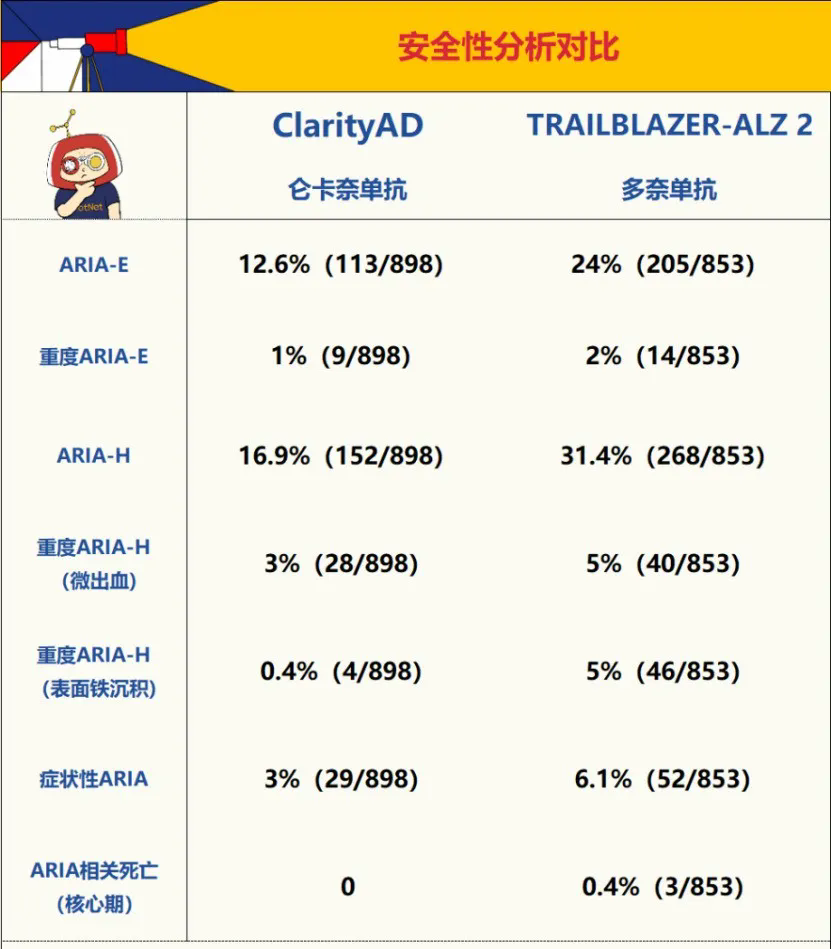
EMA在對TRAILBLAZER – ALZ 2研究的數據進行進一步分析後,發現其對於ApoE ε4非攜帶者的安全性表現依然不盡如人意**,ARIA事件總體發生率達到了24%,比安慰劑組的12%高出一倍**,與Clarity AD研究中崙卡奈單抗在總人羣中的ARIA發生率相當。
那既然侖卡奈單抗沒有獲批全人羣適應症,多奈單抗自然無法獲批ApoE ε4非攜帶者的適應症。
更為致命的是,禮來方面雖然提出了重新審查的要求,但他們似乎很難提供更多過硬的證據了。
多奈單抗的治療目標為清除大腦中的澱粉樣蛋白斑塊,當斑塊水平評估達標後即可停藥。但這個特點導致其患者的平均暴露時間差別很大,有一些患者可能在12個月內實現停藥,有一些患者則可能治療時長大大超過18個月,療程並不明確。
這導致其在長期療效數據上的披露進度遠落後於侖卡奈單抗。
在EMA的意見中也指出,對於多奈單抗治療ApoE ε4非攜帶早期AD患者,目前尚無長期有效性數據支持。
而且,即便是現有的療效數據,多奈單抗的獲益也很並不明顯。
從整體數據來看,接受多奈單抗治療的患者 iADRs 評分惡化了 10 分,而接受安慰劑治療的患者惡化了 13 分。這表明多奈單抗雖然在一定程度上使患者的評分惡化程度稍低,但改善幅度並不顯著,僅僅只有 3 分的差異。
而在ApoE ε4非攜帶者中,接受多奈單抗治療的患者 iADRs 評分惡化14分,接受安慰劑治療的患者惡化 16分 。也就是説,在這一特定人羣中,多奈單抗與安慰劑的差值僅有2 分。
這樣的療效收益絕對無法抵消安全性上的風險。
靶點帶來安全性差異
澱粉樣蛋白相關性影像異常(ARIA)是所有抗Aβ藥物治療都可能產生的副作用,因為Aβ不僅可沉積於腦實質,也可沉積於腦血管壁,導致血管壁的結構和功能異常,增加了血管的脆性和易損性。
但腦實質與血管壁上的Aβ並不是同樣的Aβ,血管壁上沉積的主要是Aβ40,而Aβ42才是主要參與Aβ級聯反應的聚合體。所以理想的阿爾茨海默病抗體藥物應該儘可能減少與Aβ40的結合度,增加與Aβ42的結合度。
而多奈單抗與Aβ40的結合力度比侖卡奈單抗高,這導致理論上多奈單抗的安全性比侖卡奈單抗更差。
臨牀研究結果表明,多奈單抗的ARIA-E和ARIA-H發生率都比侖卡奈單抗高出一倍左右, 而且多奈單抗的臨牀試驗中還出現了3例導致受試者死亡的嚴重ARIA事件。
歐盟對抗Aβ藥物態度的“冰火兩重天”,遠不是安全性問題可以概括,需要綜合評價藥物的風險與治療獲益。
由於AD 治療需要“早期干預、長期管理” ,所以藥物既要有長期療效證據,也要能保證長期用藥的安全,二者缺一不可,不能做一錘子買賣。
作者 | 辰公子
來源 | 醫界望遠鏡