天塌了!!!鹽水竟然不是上下一般鹹?!_風聞
中科院物理所-中科院物理所官方账号-54分钟前
溶液在我們的生活中隨處可見,與我們息息相關。當溶液被放置在容器中,液體和器具表面就會存在固液界面,放在空氣中存在氣液界面。那麼此時大家一定會好奇,這個界面是否存在物理規律,它又能對我們的科學技術有哪些幫助呢?本期我們就來探討一下,溶液與其他物質的界面。
何為界面?它是物體和物體之間的接觸面,在物理化學中,它是物質相與相之間的分界面。在各相之間存在氣-液、氣-固、液-液、固-固和氣-固五種不同的界面。當組成界面的兩相中有一相為氣相時,常被稱為表面。
PART 1
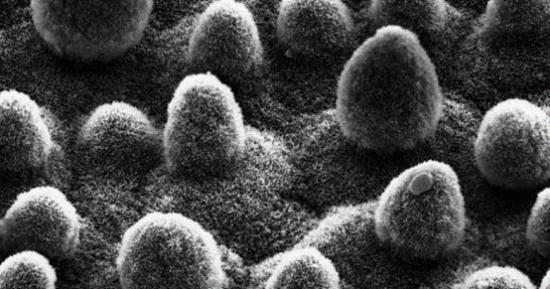
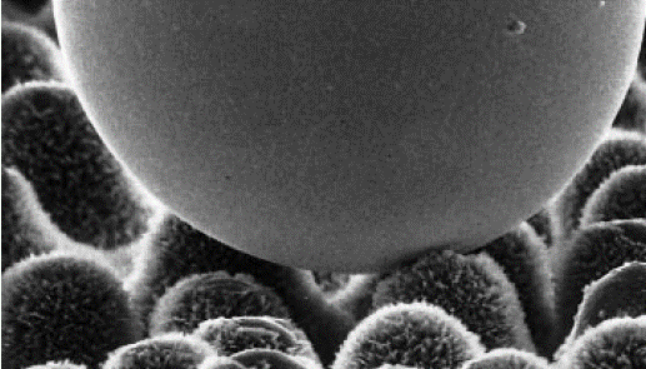
最典型的關於表面的例子就是荷葉。在盛夏的荷花池中,總可以看到荷葉上承載着晶瑩的露珠,只要稍微施加力度,露珠就可以順着荷葉滑落,那為什麼荷葉不會被水沾濕?其實就是“荷葉效應”在起作用。1997年W.Barthlott和C.Neinhuis發表了“荷葉效應”的原始文章,通過研究荷葉表面的微觀結構,發現荷葉表面並不光滑,而是由一個個小乳突的粗糙表面。這種表面使得水珠在荷葉表面上自由滾動而不沾濕荷葉。
表面物理化學中的楊式方程告訴我們:
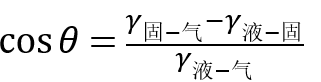
其中θ為接觸角,γ為表面能,將其變形之後得到如下公式:

這個方程指出,是否潤濕取決於液滴擴大表面所需要的能量與由於覆蓋基底材料而獲得的能量之間的大小,後者能補償前者時可以浸潤,最終使得系統的能量最小;反之,當基底材料的表面能低於液滴的表面能時一定不會使液滴鋪展。因此想得到一個疏水的表面,其表面一定是低能表面。同時粗糙的表面導致液滴與表面間接觸面積減少,使得液滴只能停留在乳突尖端上,空氣被密封在乳突中間,使得液滴被支撐起來。
PART 2
水和荷葉的固液界面使得水珠不會沾濕荷葉表面,那又是什麼使得水凝聚成水珠的呢?
答案是表面張力。液體具有內聚性和吸附性,這兩種都是分子引力的表現形式。內聚性使液體能抵抗拉伸引力,吸附性則可以使液體黏附在其他物體上面。在液體和氣體的分界處,由於分子之間的吸引力,產生了微小的拉力,因為荷葉表面不吸附水,所以水在拉力的作用下凝聚成水珠。

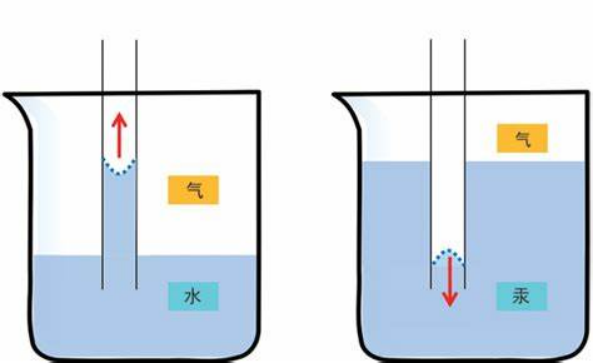
既然水與空氣的界面存在表面張力的作用,那水和杯壁之間呢?在我們倒水的時候,滿杯的水面高出杯口而不外溢這是表面張力的作用,而水沿着杯壁有向上爬上的跡象也是表面張力的作用。這是因為杯壁上的水分子之間的張力比中間的水分子更強一些,不過杯壁側的水比液麪高還是低卻決於液體與容器材料的“浸潤性”。也就是接觸層固液之間的作用力與液體之間作用力的大小關係。附着層中的液體分子受容器分子的吸引比液體內部強,則附着層中的液體分子更大面積的貼近容器,此時會出現“凹液麪”。如水在玻璃容器中。反之,固液接觸層,固液之間的引力弱於液體內部的引力,則液體不易與容器貼近。而是更“緊密團結”在液體內,如水銀在玻璃容器中。
但我們常見的溶液並不只有水,裏面還有溶質,比如糖水和鹽水。這裏筆者問各位讀者一個小問題,在你們面前有一杯鹽水和一杯糖水,對於鹽水是表面鹹還是裏面鹹?糖水是表面甜還是裏面甜呢?
其實在初高中時我們就經常被告知,溶液具有均一性,溶液的濃度上下一致,但隨着我們對於物理化學知識的愈加深入,事實告訴我們,溶液表面的溶質濃度常常與體相不同。學名為“溶液的表面吸附”,其成因是表面分子受到的分子間作用力與體相分子不同,從而產生了表面張力。溶質分子的濃度可以改變表面分子所處的分子間作用力場,從而影響表面張力的大小。當溶質分子的濃度升高有助於降低表面張力、從而降低表面能時,溶質分子就會傾向於在溶液表面層聚集,稱為正吸附,反之則稱為負吸附。
J W Gibbs最早定義了單位面積的表面溶質相比於體相的物質的量增量為表面超量:
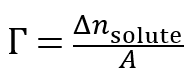
進而根據表面熱力學關係推導出了又名的Gibbs吸附方程:
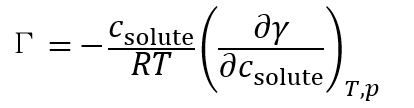
一般而言,大部分極性有機化合物的水溶液的表面張力都隨濃度升高而減小,因此表面超量為正,發生正吸附。而無機鹽或若干與水形成多重氫鍵的分子會增大溶液的表面張力,發生負吸附。對於蔗糖和鹽水溶液它的表面張力隨濃度上升而增大,因此發生負吸附。對於葡萄糖則是發生正吸附,所以表面比較甜。
PART 3
總結來看,如果能夠調控界面的物相組成就可以改變表面張力的大小。對於液體而言,一種溶質溶於其中,可能增大表面張力,例如可溶性無機鹽,稱為表面惰性物質;也可能降低表面張力,比如眾多的可溶性大分子有機物。界面科學中把能降低液體表面張力的物質稱為表面活性劑。表面活性劑又稱為工業味精,具有潤濕、起泡、增溶、乳化、洗滌等作用,被廣泛地應用於石油、紡織、農藥、醫藥、採礦食品、民用洗滌等各個領域。
表面活性劑溶於水中時隨着濃度的不同會有不同的分佈排列情況。濃度極小時,表面活性劑分子在溶液中隨機分佈;隨着濃度上升,分子自發的向溶液表面聚集,並出現極性基團朝向溶液內部、非極性基團朝外的豎直排列方式。

自發條件下,熱力學體系都是由不穩定朝向穩定的平衡態變化,因此,能夠降低表面張力的因素可以使得體系變得更穩定。對於表面活性劑分子而言,極性基團的親水性使其儘可能進入溶液本體,非極性基團的疏水性則使其儘可能逸出液麪, 從而使得液麪的表面活性劑分子呈現出豎直排列的趨勢。
由於非極性基團之間的作用力小於極性基團之間的作用力,非極性基團在液麪的分佈降低了氣液兩相間分子間吸引力之差。因此,表面活性劑分子在液麪的豎直排列和聚集可以降低溶液表面張力,使得相界面體系變得更穩定;表面活性劑分子自發朝液麪移動和聚集,出現表面活性劑在液麪的濃度大於溶液本體濃度的現象,界面科學中稱為表面吸附。
講到這裏是不是覺得知識又串回來?其實無論是物理學知識還是其他學科,知識都是共通的。也許在課本上講的是不同的公式,但是其中總是有共同的物理量。所以不要覺得講專業術語聽不懂啦,其實你們很棒的噠好不啦~跟隨物理所一起進入知識的殿堂吧!
[1] 成娟,李玲,劉科.液體表面張力系數與濃度的關係實驗研究[J].中國測試,2014,40(03):32-34.
[2] Barthlott, W., Neinhuis, C. Purity of the sacred lotus, or escape from contamination in biological surfaces. Planta 202, 1–8 (1997).