THP-1基因敲除細胞:開啓免疫與炎症研究新紀元_風聞
源井生物-让基因编辑更简单!1小时前
一、THP-1細胞:免疫機制探索的理想模型
THP-1細胞系源自一位急性單核細胞白血病兒童的外周血,自1980年建立以來,因其與人體單核細胞高度相似的功能表現,在免疫和炎症研究領域得到了廣泛應用。相比於其他常見的白血病細胞系(如U937、HL-60),THP-1細胞展現出以下顯著優勢:
快速增殖能力:平均倍增時間約為35至50小時,大幅提升實驗效率;
遺傳穩定性強:基因背景均一,降低實驗干擾,提高結果的可重複性;
可控分化能力:可通過佛波酯(PMA)誘導分化為巨噬細胞,再經LPS/IFN-γ或IL-4/M-CSF誘導進一步分化為M1或M2亞型,精準模擬免疫應答及炎症修復過程;
安全可控性好:目前尚無THP-1細胞攜帶致病病毒或產生毒性產物的報道;
適應多種疾病模型:如動脈粥樣硬化、免疫失調、慢性炎症等疾病研究均有成熟應用。
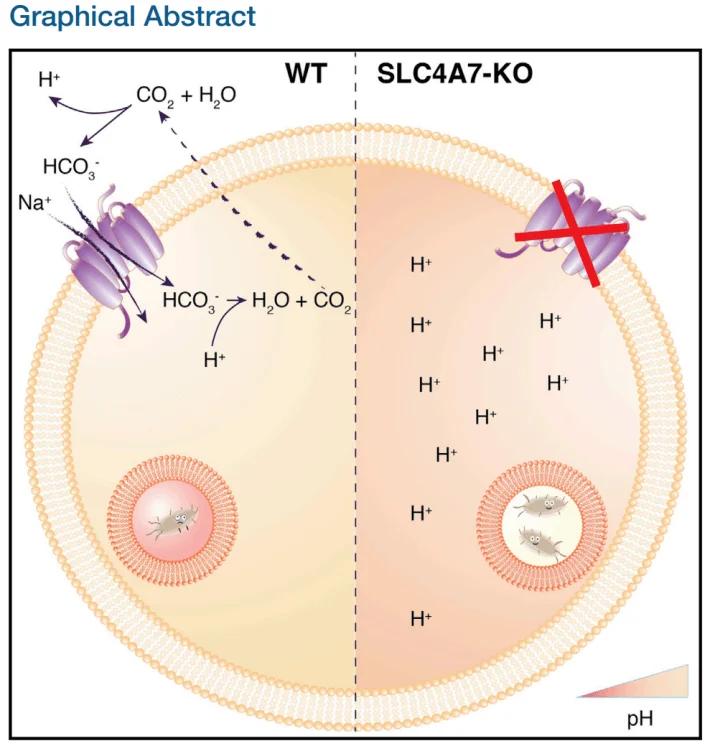 圖1
圖1
二、CRISPR/Cas9在THP-1中的基因敲除應用實例
案例一:SLC4A7敲除揭示吞噬體酸化調控路徑
研究人員利用CRISPR/Cas9系統敲除THP-1中的SLC4A7基因(負責碳酸氫鹽轉運),結果顯示該基因缺失使得吞噬體pH升高,從而顯著降低其殺菌效率。補償實驗進一步確認SLC4A7是維持吞噬體酸性環境的關鍵分子。
案例二:CYBB基因敲除模擬慢性肉芽腫病(CGD)
通過敲除CYBB(NADPH氧化酶亞基編碼基因),研究人員構建了一個新的CGD免疫缺陷模型。該模型在PMA/LPS刺激下表現出H₂O₂生成減少和炎性因子如IL-1β與TNF-α的顯著升高,精準再現了CGD患者的免疫功能障礙。
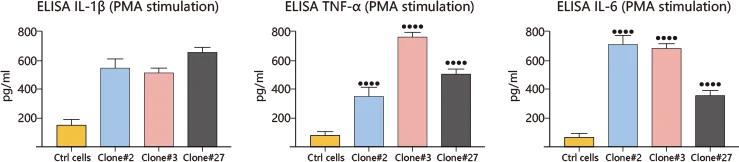 圖2
圖2
案例三:cGAS/STING/MAVS通路研究助力病毒免疫研究
為研究RNA-DNA複合物誘導的免疫激活機制,Arun K Mankan等學者分別構建了cGAS、STING與MAVS缺失的THP-1細胞系,並導入雙鏈DNA、pppRNA和RNA-DNA複合物,結果顯示RNA-DNA複合物可能通過cGAS-cGAMP-STING路徑引發免疫反應,為抗病毒機制的深入解析提供了有力證據。
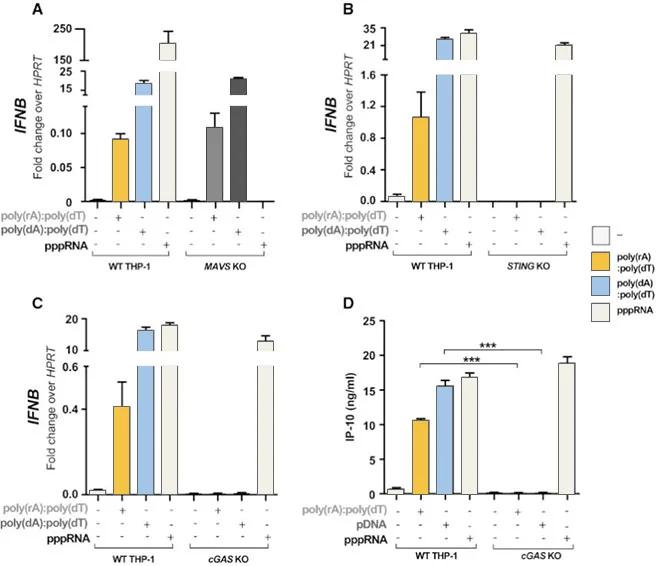 圖3
圖3
三、THP-1細胞基因敲除的標準流程(基於慢病毒技術)
在THP-1細胞中實現高效基因敲除,需經過以下幾個核心步驟:
1.靶向設計與載體構建:依據目標基因的關鍵外顯子區域設計sgRNA,並構建至慢病毒載體系統中;
2.慢病毒製備與細胞感染:使用HEK293T細胞進行病毒包裝,優化感染MOI並藉助Polybrene提高感染效率;
3.篩選與單克隆擴增:利用抗生素篩選獲得Cas9穩定表達株及sgRNA陽性克隆,並進行單細胞克隆擴增;
4.基因敲除驗證:通過測序、酶切分析及Western blot驗證目標基因的敲除效率,確保純合克隆的獲得。
四、專業細胞基因編輯一站式服務商
依託CRISPR-U™與EZ-HRex™等創新專利平台,在THP-1細胞系的基因編輯服務中樹立了行業標杆:
高效率編輯:基因敲除效率高達80%,遠超市場平均水平(常規方法效率10%-30%);
全面服務體系:涵蓋從sgRNA設計到敲除驗證的全流程,支持敲除、點突變、敲入等多種定製化需求;
海量成功案例:已建立超過5000種基因編輯細胞株,廣泛應用於炎症、腫瘤、代謝等多個研究方向;
快速響應交付:常規項目6周內交付,緊急項目可加急處理,助力科研加速。
總結
THP-1細胞因其出色的可塑性與免疫功能模擬能力,成為構建疾病模型和研究炎症機制的優選平台。藉助CRISPR/Cas9技術及源井生物的高效編輯服務,科研人員可更精準地進行基因功能研究和藥物靶點篩選,為免疫疾病與感染治療開闢新思路。