下一款長壽藥?集體漲停的麥角硫因背後,代謝堆積、臨牀不足,這些“副作用”要注意_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

今天,投資圈裏可能都在問同一件事:麥角硫因怎麼突然火了?
近些年來,各種抗衰老“黑科技”、新成分層出不窮,讓人眼花繚亂。這不,繼NMN大火後,新的“不老神藥”可能又出現了!而這次的主角是——「麥角硫因」。
而將這把火燒得更旺的,正是科倫藥業——就在上週,75歲的科倫董事長劉革新親自下場,發“半身裸照”大秀肌肉為自家麥角硫因站台(據説服用了整整3年)!
這波總裁“帶貨”,一舉讓麥角硫因概念在A股市場原地起飛——5月15日,儘管大盤縮量調整,但拓新藥業、川寧生物等相關概念股紛紛強勢漲停,作為事件核心的科倫藥業,在當天也獲得了高達1.29億元的主力資金淨流入,追捧熱度可見一斑。
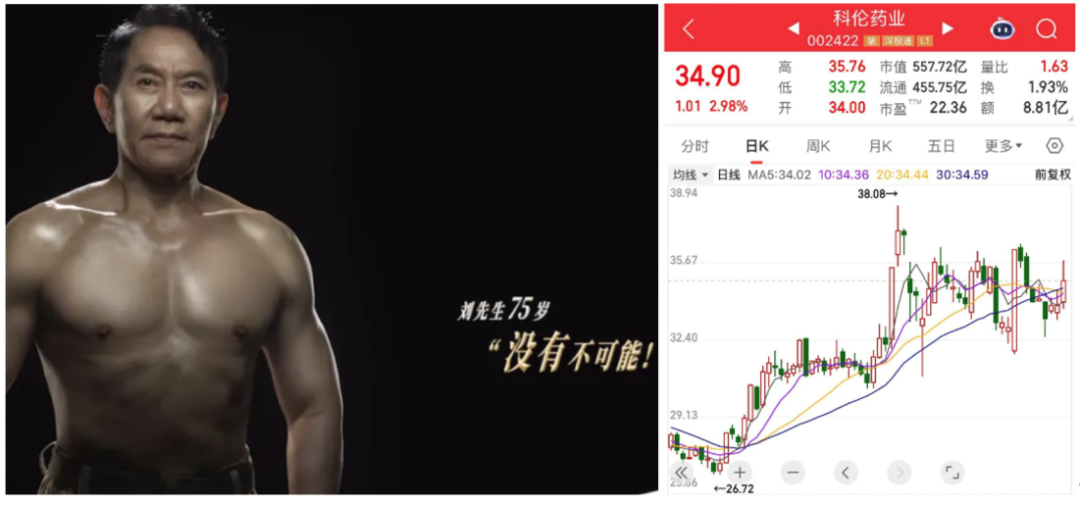
圖注:麥角硫因概念股應聲大漲
但是,麥角硫因此番“爆紅”,也帶來了重重擔憂:25年的麥角硫因,會不會再次像20年NMN一般,因缺乏足夠的監管/安全性而銷聲匿跡?
推薦閲讀:“長生不老藥”概念爆發,NMN版塊集體漲停,是不是智商税?一文讀懂
那麼這次,面對麥角硫因,我們也應該多一份冷靜與審視,深入瞭解、理性看待麥角硫因自帶的光環與可能的“瑕疵”,例如:代謝週期長、臨牀證據不足、特定人羣服用有風險等。
所以今天,關於麥角硫因,好的壞的我們統統幫你搞明白!

麥角硫因:會是細胞專屬的“長壽維生素”嗎?
説到麥角硫因,經常看時光派的朋友們可能已經有些印象了。早在1909年,它就被一位法國藥劑師從麥角菌中發現,因而得名[1]。簡單來説,麥角硫因是一種天然存在的含硫氨基酸衍生物,常見於鮮香美味的蘑菇等食物中,是一種強大的抗氧化劑。
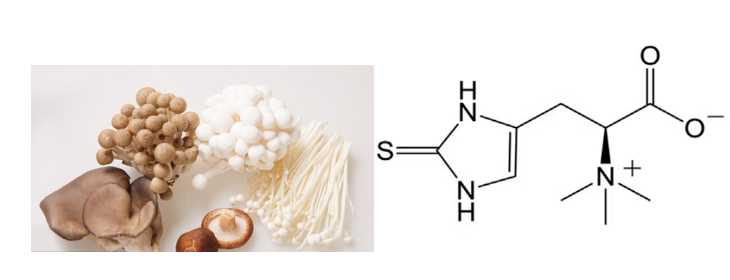
圖注:麥角硫因的結構式
但是,在目前科學家已經發掘的五花八門的抗氧化劑之中,它之所以能夠脱穎而出,重點是它足夠「特別」——
例如,曾受邀參加時光派衰老幹預論壇的Barry Halliwell教授,是自由基理論的“奠基人”,而他在抗氧化領域深耕數十年,近年也將大量研究精力聚焦到了麥角硫因身上。他指出:許多傳統的抗氧化劑(比如維生素E)在一些關鍵的臨牀試驗中效果並不理想。
而其中一個原因,就是它們很難去到真正需要的細胞或組織中發揮作用。而麥角硫因,是目前已知的唯一具有專屬轉運蛋白的抗氧化劑:
麥角硫因能憑藉細胞膜上的“專屬”特異性OCTN1轉運蛋白(Ergothioneine Transporter),被細胞高效、主動吸收,精準運送到最需要它的地方,比如細胞中的線粒體、細胞核,或眼、腦、肝臟甚至精液中[2]。
此外,麥角硫因還能有效清除中和多種類型的自由基(如羥自由基、次氯酸等),保護細胞[1; 3],還可調節氧化相關酶的表達,如谷胱甘肽過氧化物酶、超氧化物歧化酶和過氧化氫酶等來發揮抗氧化作用[1]。
所以説,精準“投送”,再加上直接的抗氧效果,使其在抗衰老的理論研究中顯示出獨特的潛力!那麼問題來了,麥角硫因具體能給我們帶來哪些抗衰好處呢?
抗衰延壽
人體內的麥角硫因會隨着年齡的增長、衰老相關疾病的出現而逐漸流失[4; 5],而目前的研究發現,補充麥角硫因可能能幫助延長壽命、對抗衰老:
例如,一項2022年的研究發現,給果蠅餵食含有適量麥角硫因的食物後,它們的壽命一定程度上被延長了[6]。而在細胞層面,研究發現,經過麥角硫因處理的細胞,其染色體末端的“保護帽”端粒長度普遍有所延長,短端粒細胞的比例則顯著降低[7]。
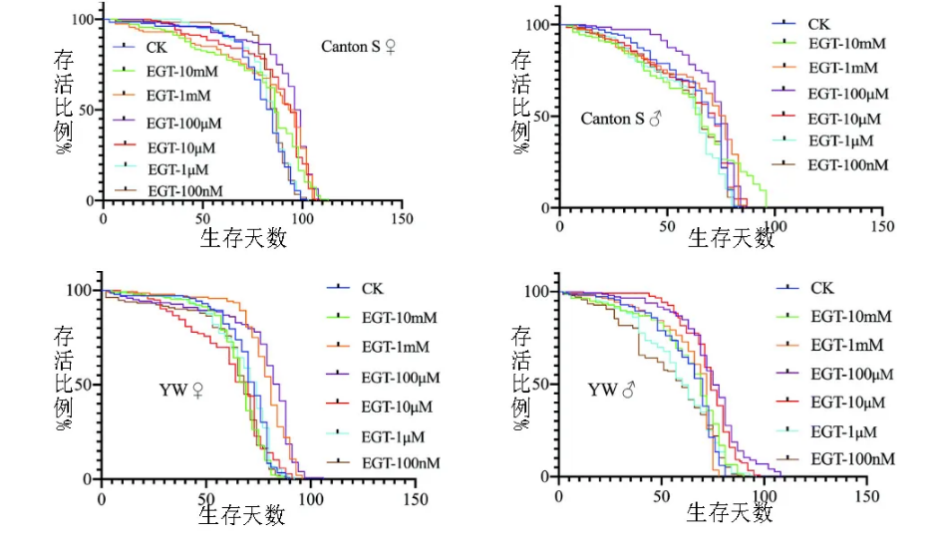
圖注:兩個不同品系的果蠅在麥角硫因的干預下壽命延長
預防神經退化
此外,一些研究還表明,麥角硫因可能有助於預防阿爾茨海默病、帕金森病等神經退行性疾病。
Halliwell教授團隊就發現,認知功能正常的老年人血漿中的麥角硫因濃度,顯著高於有認知障礙和痴呆的患者[8]。而補充麥角硫因被證明能顯著改善小鼠的認知障礙,改善學習和記憶能力和運動能力[9]。
抵抗光老化,提升膚質
麥角硫因還是護膚品裏的明星成分。它能幫助皮膚抵抗紫外線的傷害,減少日曬導致的DNA損傷和炎症反應[10],還能提升皮膚自身的抗氧化能力[11],有助於維持皮膚的彈性和光澤。

圖注:以麥角硫因為主打成分的護膚品
保護生殖健康
有研究發現,動物的精漿中富集了大量的麥角硫因[12]。因此科學家們猜測,麥角硫因可能會對睾丸和精囊中的精子功能等產生影響。而事實的確如此,在一項研究中,科學家們發現,補充麥角硫因能夠增加大鼠的精子數量和活力,並減少了精子異常的狀況[13]。
除了以上功效之外,麥角硫因這位“多面手”還被發現有保護心血管、降低心臟代謝疾病的風險[14]、提高腫瘤免疫治療療效[15]以及對抗某些病毒感染[16]的潛力。
甚至,最近的研究還發現,麥****角硫因還能夠提升2倍的NAD+水平,激活線粒體,效果媲美NMN[17]!這不禁讓派派震驚:也許,新一屆的“抗衰神藥”,就要誕生了呢?

光環之下:麥角硫因與我們的身體及藥物存在哪些潛在的“衝突”?
誠然,麥角硫因展現了誘人的前景,但正如時光派一貫的審慎態度,越是火熱的明星成分,我們越需要冷靜地審視其光環之下的另一面。
畢竟當下,麥角硫因已經成為不計其數的羣眾都可能聽聞、接觸、甚至消費的存在,那麼我們時光派也必然要以最嚴苛和挑剔的態度,去審視麥角硫因的安全性、可靠性,力求讓讀者對其持有最客觀的認識。
絕大多數時候,我們攝入的麥角硫因都要先與我們的菌羣照面,而人體內的幽門螺桿菌(世界上超過50%人口的消化系統均有攜帶,70%的胃癌與其相關[18])會從胃黏膜中搶奪麥角硫因,為其自身提供保護(抵抗活性氧)[19]。
因此,當我們服用補劑來提高我們腸腔內的麥角硫因濃度時,理論上會放寬這類病原體的存活窗口期。
此外,包括大腸桿菌在內的部分厭氧菌身上存在麥角硫蛋白酶,這種酶會從麥角硫因“身上”切割出三甲胺(TMA),而TMA 經肝臟 FMO3 酶氧化後會生成 TMAO——這是一個與動脈粥樣硬化、心衰和卒中風險成正相關的代謝標誌物[20]。
當然,多數腸道細菌並不具備把麥角硫因切割成TMA的能力,而且有不同菌羣背景的人在補充麥角硫因後體內的TMAO峯值可能會相差數倍,因此,服用麥角硫因對於TMAO這一風險標誌物的貢獻度,目前尚未明確,或者説難以量化。
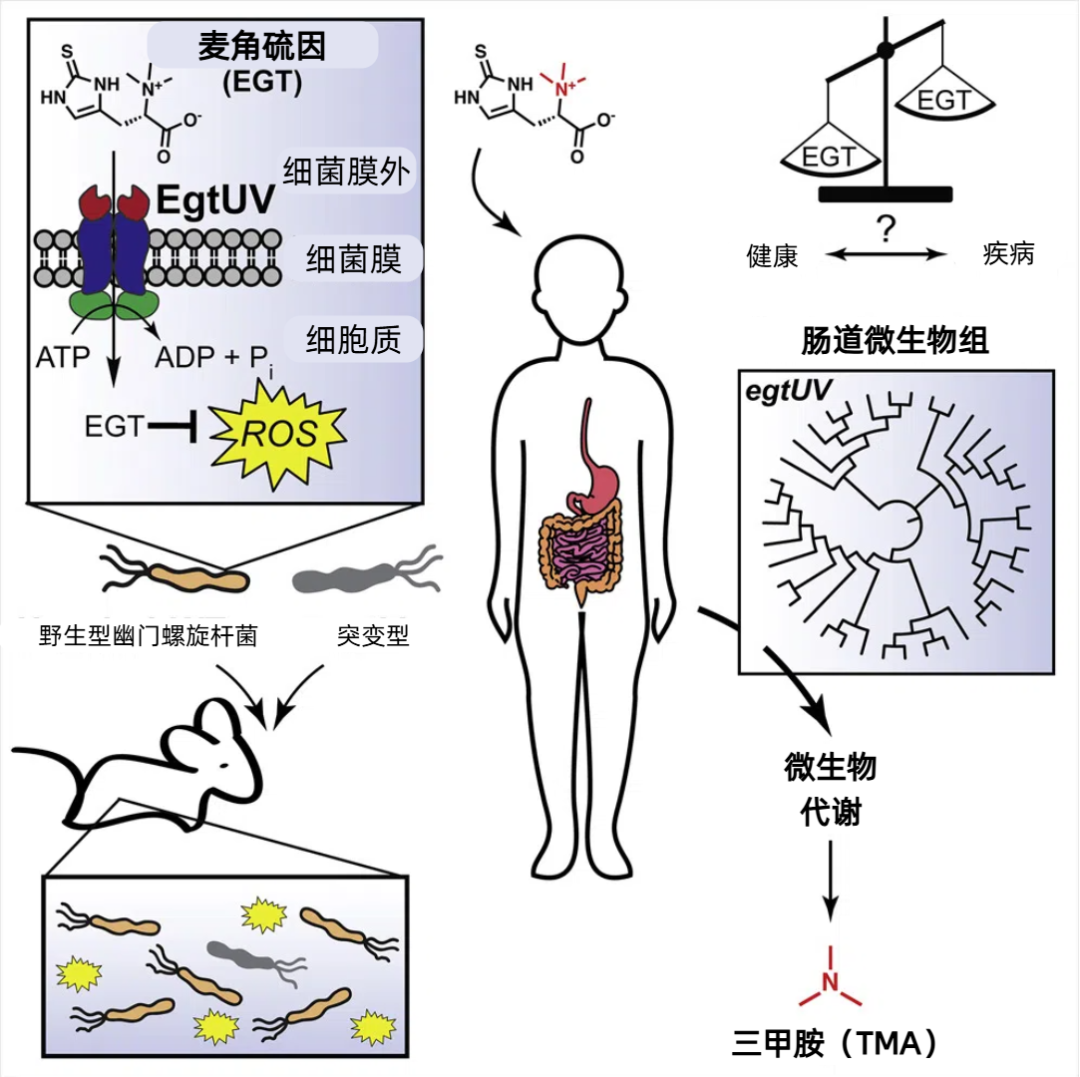
圖注:EgtUV是幽門螺旋桿菌細胞膜上的,“捕捉”麥角硫因的轉運蛋白
另外,麥角硫因與多種帶正電荷的小分子藥物(例如二甲雙胍)都依賴(或者部分依賴)OCTN1 轉運體吸收進組織,而OCTN1 轉運體的數量以及通過能力是有限的,這就意味着,理論上在高劑量補充麥角硫因時,這些通道會被佔用,進而可能導致其他藥物的吸收受阻[21]。
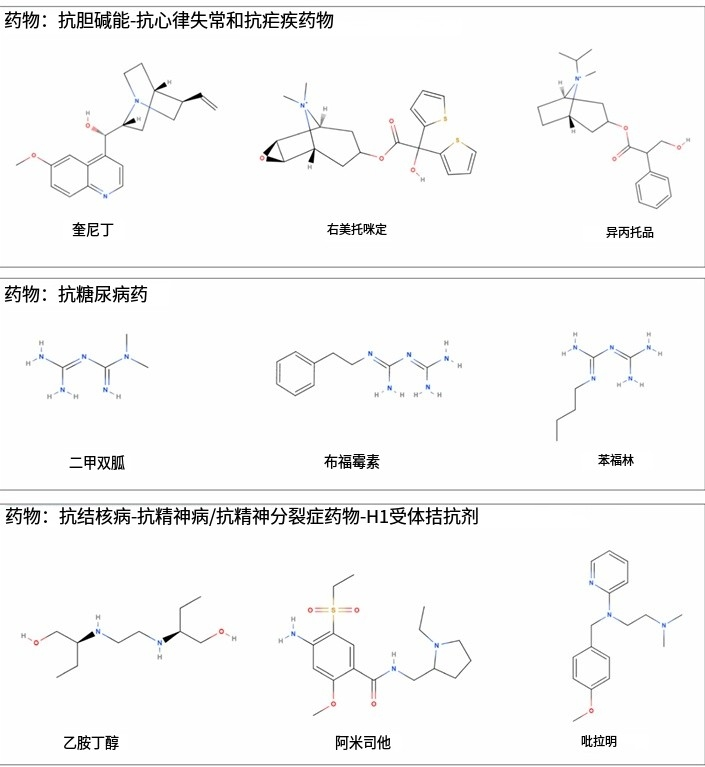
圖注:會被麥角硫因爭搶通道的藥物
儘管目前仍未有真實數據顯示補充麥角硫因會顯著改變二甲雙胍等藥物的療效,但對於那些需要日常服用多種藥物的老年人而言,我們仍舊需要持續關注高劑量麥角硫因的安全服用閾值。

“抗衰老”之名:麥角硫因的人體臨牀證據足夠“硬”嗎?
首先,截止到2025年5月為止,麥角硫因依舊沒有任何已發表或完成註冊的、稱得上大規模(上千例受試者、多個實驗中心、隨訪>1年)且具有重要意義的干預隨機對照實驗(RCT)。
現有的研究大都屬於探索性/先導性實驗,樣本量通常在20-80人之間,觀察的指標也以藥代動力學(即研究藥物在我們體內如何被吸收、分佈、代謝和排泄的過程)、認知量表、皮膚水分或者炎症/代謝生物標誌物為主。
當然,這是一種極為嚴苛的審視臨牀證據強度的標準,以同樣的標準去審視其他抗衰物質,目前能説真正擁有“規模化”RCT的“抗衰物質”,或許只有一些經典臨牀藥物以及常規營養補充劑了,比如:
二甲雙胍:3243例,27箇中心,隨訪2.8年,主要結論:Ⅱ型糖尿病發病風險降低31%[22]。
阿司匹林:19114例,隨訪4.7年,主要結論:未顯著延長健康壽命,出血率提高[23]。
維D + Ω-3:25871例,隨訪5.3年,主要結論:未顯著降低總癌症/心血管疾病發生率,但降低了癌症死亡率[24]。
其次,目前關於麥角硫因的最有力證據,來自一項2024年發表的研究,雄性 C57BL/6J 小鼠自斷奶開始,其飲用水被添加了4-5mg/kg/天的麥角硫因,結果中位壽命延長了16%[25]。
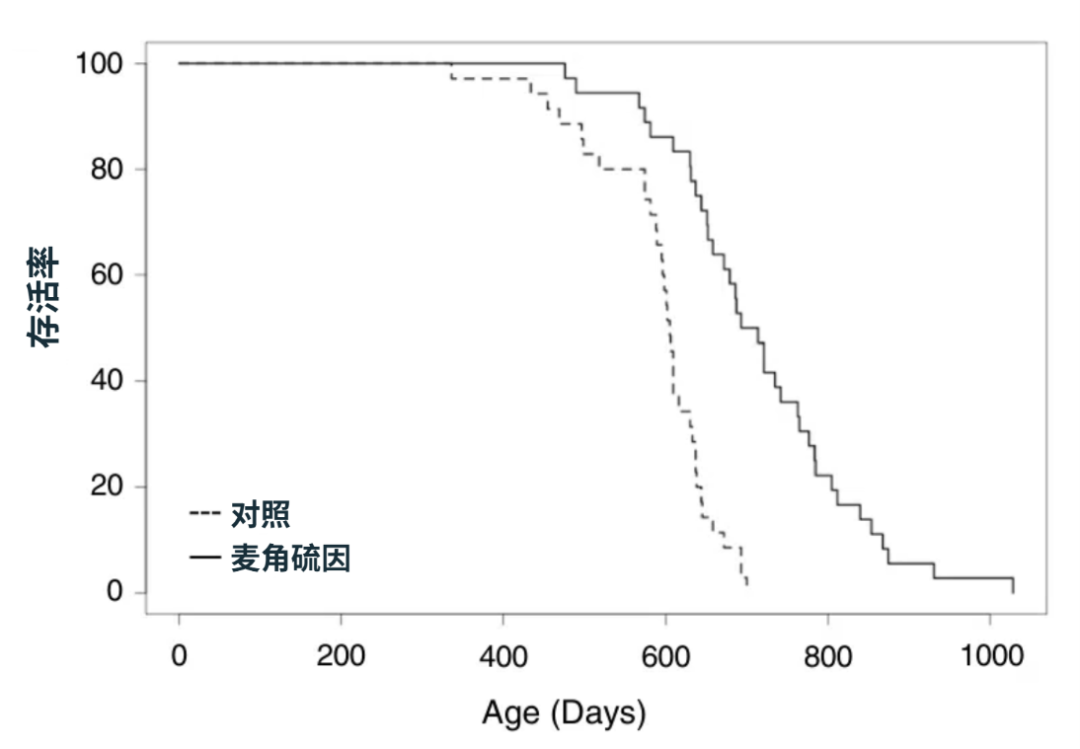
然而,這一研究仍舊存在“僅雄鼠、單一品系、單一劑量”的限制,目前也還沒有其他獨立實驗室給出同等級的證據。
從延壽幅度的角度來説,中位壽命+16%放在常見藥物干預裏屬於“中等偏上”的水平,與阿卡波糖(雄性延壽22%,雌性延壽5%)[26]、17-α-雌二醇(雌性延壽19%)[27]處於同一量級,但低於熱量限制(鼠/猴/犬的中位壽命延長10-40%)。
從證據的穩健性來説,由於尚沒有ITP這類獨立平台復現,麥角硫因延壽效果的可信度目前落後於熱量限制、雷帕黴素和阿卡波糖這些已經被多次復現結果的干預手段。
再次,麥角硫因對於部分人羣可能毫無效果。如前文所述,麥角硫因的吸收幾乎完全依託於轉運蛋白OCTN1,然而,該基因存在一種非同義突變——L503F,攜帶這種突變的人,即便大劑量補充麥角硫因,也難以提升其在組織中的水平。
而在東亞人羣中,攜帶該突變的人羣比例約為0.106%,也就是説,仍有千分之一的東亞人羣無法從麥角硫因中獲利。
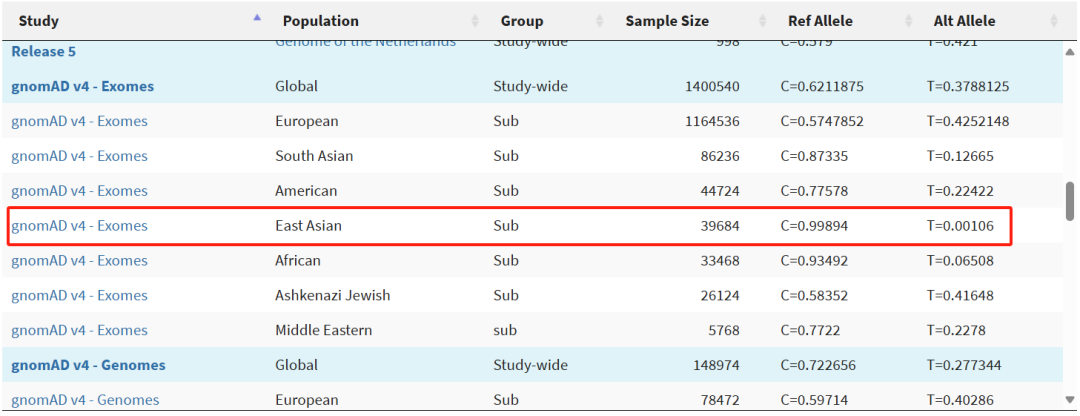
圖注:當然,相比於歐美人羣,東亞人羣已經是相對很契合麥角硫因了

“只進難出”?麥角硫因獨特的體內積累特性,我們該如何看待?
如果説,前面提到的種種“問題”,在其他抗衰物質身上或多或少都存在,那麼最後這一個問題,可能就是麥角硫因獨有的了:
動物和人體實驗表明,口服攝入的麥角硫因幾乎不會被代謝,我們單次攝入的麥角硫因,24小時內僅有4%能通過尿液排出體外,導致麥角硫因在血液中的半衰期可能有30天[28]。
作為對比,CoQ10的半衰期約為33h[29],雷帕黴素約為62h[30],二甲雙胍約為6h[31],白藜蘆醇約為9.2h[32],而麥角硫因則長達一個月,可謂是遙遙領先。
這種在體內“只進難出”的特性,其實與我們時光派兩年前的判斷不謀而合。彼時在探討“脈衝給藥”這一前沿理念時,我們便特意以麥角硫因為例,指出其因代謝週期極為漫長、易在組織中積累的特點,或許更適合間歇性的脈衝服用方式,而非每日補充。
推薦閲讀:補劑吃一陣停一陣,可能更有效?淺析各抗衰藥的另類服用方式
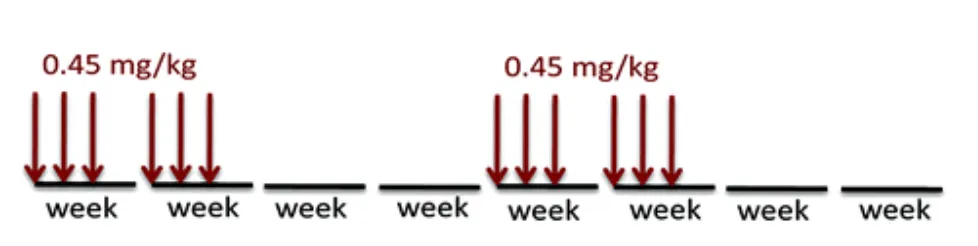
圖注:以雷帕黴素為例的脈衝給藥示意圖
理論上説,若每天持續服用一種藥物,通常需要4-5個半衰期,藥物的體內濃度才會進入穩態(攝入與排出達成平衡),對於麥角硫因而言,也就是理論上連續服用4-5個月,它在我們血漿內的濃度才會抵達峯值——接近20 µM 左右(根據重複給藥累積指數公式估算得出)。
而如我們之前所説,目前針對麥角硫因的臨牀研究仍存在小範圍、短週期的限制,儘管目前沒有任何人體或者動物數據顯示20 µM左右的血漿麥角硫因濃度會產生毒性或者其他不良反應,但也的確缺乏6個月以上高濃度暴露的長期安全性證據。
綜上,儘管我們以最為苛刻的眼光去審視麥角硫因的安全性,我們的質疑目前也只能止步於理論和推測。如果把“安全”定義為在基本性質、動物實驗毒性表現到初步的人體觀察三個維度都幾乎未曾留下“污點”,那麼麥角硫因直到目前為止,大體上確實是一個“乖小孩”。
僅僅由於它極為特殊的超長半衰期,導致目前對大多數抗衰分子適用的安全性驗證週期,當放在麥角硫因身上時,我們仍舊不得不留下一個小小的警惕——基於理論層面的考量,對於腎功能不夠健全的人羣來説,補充麥角硫因或許要更加謹慎,建議補充前向醫生諮詢。
以上就是時光派能提供的,關於麥角硫因的作用原理、功能、安全性和有效性的所有關鍵信息了,相信看完這些,大家能對麥角硫因建立起足夠客觀、全面的認識。
然而,這也僅是時光派的一家之言。前沿抗衰原料一直是時光派衰老幹預論壇關注的重點(參展公司包括僅三生物、麥角硫因集團、湖南德諾邦尚等),今年我們也計劃在論壇中探討更多抗衰物質的潛力與前景。也歡迎各位讀者同時光派一起,繼續關注麥角硫因的更多信息吧~
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Cheah, I. K., & Halliwell, B. (2012). Ergothioneine; antioxidant potential, physiological function and role in disease. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease, 1822(5), 784-793. doi:https://doi.org/10.1016/j.bbadis.2011.09.017
[2] Gründemann, D., Harlfinger, S., Golz, S., Geerts, A., Lazar, A., Berkels, R., . . . Schömig, E. (2005). Discovery of the ergothioneine transporter. Proceedings of the National Academy of Sciences, 102(14), 5256-5261. doi:10.1073/pnas.0408624102
[3] Akanmu, D., Cecchini, R., Aruoma, O. I., & Halliwell, B. (1991). The antioxidant action of ergothioneine. Archives of Biochemistry and Biophysics, 288(1), 10-16. doi:https://doi.org/10.1016/0003-9861(91)90158-F
[4] Cheah, I. K., Feng, L., Tang, R. M. Y., Lim, K. H. C., & Halliwell, B. (2016). Ergothioneine levels in an elderly population decrease with age and incidence of cognitive decline; a risk factor for neurodegeneration? Biochemical and Biophysical Research Communications, 478(1), 162-167. doi:https://doi.org/10.1016/j.bbrc.2016.07.074
[5] Kameda, M., Teruya, T., Yanagida, M., & Kondoh, H. (2020). Frailty markers comprise blood metabolites involved in antioxidation, cognition, and mobility. Proceedings of the National Academy of Sciences, 117(17), 9483-9489. doi:10.1073/pnas.1920795117
[6] Pan, H.-Y., Ye, Z.-W., Zheng, Q.-W., Yun, F., Tu, M.-Z., Hong, W.-G., . . . Lin, J.-F. (2022). Ergothioneine exhibits longevity-extension effect in Drosophila melanogaster via regulation of cholinergic neurotransmission, tyrosine metabolism, and fatty acid oxidation. Food & Function, 13(1), 227-241. doi:10.1039/D1FO02758A
[7] Samuel, P., Menelaos, T., Nuria, d. P., G., L. A., J., C. L., & and Chen, S. (2022). Ergothioneine Mitigates Telomere Shortening under Oxidative Stress Conditions. Journal of Dietary Supplements, 19(2), 212-225. doi:10.1080/19390211.2020.1854919
[8] Wu, L.-Y., Cheah, I. K., Chong, J. R., Chai, Y. L., Tan, J. Y., Hilal, S., . . . Lai, M. K. P. (2021). Low plasma ergothioneine levels are associated with neurodegeneration and cerebrovascular disease in dementia. Free Radical Biology and Medicine, 177, 201-211. doi:https://doi.org/10.1016/j.freeradbiomed.2021.10.019
[9] Chen, F., Wang, B., Sun, X., Wang, Y., Wang, R., & Li, K. (2024). Ergothioneine improves cognitive function by ameliorating mitochondrial damage and decreasing neuroinflammation in a d-galactose-induced aging model. Food & Function, 15(23), 11686-11696. doi:10.1039/D4FO02321H
[10] Bazela, K., Solyga-Zurek, A., Debowska, R., Rogiewicz, K., Bartnik, E., & Eris, I. (2014). l-Ergothioneine Protects Skin Cells against UV-Induced Damage—A Preliminary Study. Cosmetics, 1(1), 51-60. doi:10.3390/cosmetics1010051
[11] Hseu, Y.-C., Lo, H.-W., Korivi, M., Tsai, Y.-C., Tang, M.-J., & Yang, H.-L. (2015). Dermato-protective properties of ergothioneine through induction of Nrf2/ARE-mediated antioxidant genes in UVA-irradiated Human keratinocytes. Free Radical Biology and Medicine, 86, 102-117. doi:https://doi.org/10.1016/j.freeradbiomed.2015.05.026
[12] Sotgia, S., Taras, A., Zinellu, A., Cherchi, R., Mangoni, A. A., Carru, C., & Bogliolo, L. (2020). Hercynine, Ergothioneine and Redox State in Stallion’s Seminal Plasma. Antioxidants, 9(9). doi:10.3390/antiox9090855
[13] Ayobami, D. A. R. E., Olaniyan, O., Salihu, M., & Illesanmi, K. (2019). L-ergothioneine supplement protect testicular functions in cisplatin-treated Wistar rats. J. Pharm. Biol. Sci, 14, 6-13. doi:10.9790/3008-1401010613
[14] Smith, E., Ottosson, F., Hellstrand, S., Ericson, U., Orho-Melander, M., Fernandez, C., & Melander, O. (2020). Ergothioneine is associated with reduced mortality and decreased risk of cardiovascular disease. Heart, 106(9), 691. doi:10.1136/heartjnl-2019-315485
[15] Yoshida, S., Shime, H., Matsumoto, M., Kasahara, M., & Seya, T. (2019). Anti-oxidative Amino Acid L-ergothioneine Modulates the Tumor Microenvironment to Facilitate Adjuvant Vaccine Immunotherapy. Frontiers in Immunology, Volume 10 - 2019.
[16] Cheah, I. K., & Halliwell, B. (2020). Could Ergothioneine Aid in the Treatment of Coronavirus Patients? Antioxidants, 9(7). doi:10.3390/antiox9070595
[17] Petrovic, D., Slade, L., Paikopoulos, Y., D’Andrea, D., Savic, N., Stancic, A., . . . Filipovic, M. R. (2025). Ergothioneine improves healthspan of aged animals by enhancing cGPDH activity through CSE-dependent persulfidation. Cell Metabolism, 37(2), 542-556.e514. doi:10.1016/j.cmet.2024.12.008
[18] 幽門螺桿菌. https://zh.wikipedia.org/wiki/幽門螺桿菌.
[19] Dumitrescu DG, Gordon EM, Kovalyova Y, Seminara AB, Duncan-Lowey B, Forster ER, Zhou W, Booth CJ, Shen A, Kranzusch PJ, Hatzios SK. A microbial transporter of the dietary antioxidant ergothioneine. Cell 2022; 185:4526-4540.e18.
[20] Latif F, Mubbashir A, Khan MS, Shaikh Z, Memon A, Alvares J, Azhar A, Jain H, Ahmed R, Kanagala SG. Trimethylamine N-oxide in cardiovascular disease: Pathophysiology and the potential role of statins. Life Sci 2025; 361:123304.
[21] Pochini L, Galluccio M, Scalise M, Console L, Pappacoda G, Indiveri C. OCTN1: A Widely Studied but Still Enigmatic Organic Cation Transporter Linked to Human Pathology and Drug Interactions. Int J Mol Sci 2022; 23.
[22] Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA, Nathan DM. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346:393–403.
[23] Smith CL, Kasza J, Woods RL, Lockery JE, Kirpach B, Reid CM, Storey E, Nelson MR, Shah RC, Orchard SG, Ernst ME, Tonkin AM, et al. Compliance-Adjusted Estimates of Aspirin Effects Among Older Persons in the ASPREE Randomized Trial. Am J Epidemiol 2023; 192:2063–2074.
[24] Manson JE, Bassuk SS, Buring JE. Principal results of the VITamin D and OmegA-3 TriaL (VITAL) and updated meta-analyses of relevant vitamin D trials. J Steroid Biochem Mol Biol 2020; 198:105522.
[25] Katsube M, Ishimoto T, Fukushima Y, Kagami A, Shuto T, Kato Y. Ergothioneine promotes longevity and healthy aging in male mice. GeroScience 2024; 46:3889–3909.
[26] Harrison DE, Strong R, Allison DB, Ames BN, Astle CM, Atamna H, Fernandez E, Flurkey K, Javors MA, Nadon NL, Nelson JF, Pletcher S, et al. Acarbose, 17-α-estradiol, and nordihydroguaiaretic acid extend mouse lifespan preferentially in males. Aging Cell 2014; 13:273–282.
[27] Garratt M, Lagerborg KA, Tsai Y-M, Galecki A, Jain M, Miller RA. Male lifespan extension with 17-α estradiol is linked to a sex-specific metabolomic response modulated by gonadal hormones in mice. Aging Cell 2018; 17:e12786.
[28] Summary E. Ergothioneine 2022:1–23.
[29] Bhagavan HN, Chopra RK. Coenzyme Q10: absorption, tissue uptake, metabolism and pharmacokinetics. Free Radic Res 2006; 40:445–453.
[30] Zimmerman JJ, Kahan BD. Pharmacokinetics of sirolimus in stable renal transplant patients after multiple oral dose administration. J Clin Pharmacol 1997; 37:405–415.
[31] Xie F, Ke AB, Bowers GD, Zamek-Gliszczynski MJ. Metformin’s Intrinsic Blood-to-Plasma Partition Ratio (B/P): Reconciling the Perceived High In Vivo B/P > 10 with the In Vitro Equilibrium Value of Unity. J Pharmacol Exp Ther 2015; 354:225–229.
[32] Timmers S, Auwerx J, Schrauwen P. The journey of resveratrol from yeast to human. Aging (Albany NY) 2012; 4:146–158.