吃花生補充 NAD+?服用2周增強肝腎NAD+代謝,護腎抗衰一把抓!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯40分钟前

平時聊到肝和腎,大家的第一反應是不是:肝解毒,腎排尿?然而,在如何科學續命這個熱門的話題下,它們往往被認為是隨着衰老衰退的典型代表。似乎,我們更習慣於討論如何去保護它們免受衰老引起的損傷,而非期待它們在抗衰老中扮演更主動的角色。
但近期,來自《Cell Metabolism》上的一項重磅研究發現[1]:我們體內的肝腎不僅不是衰老的“拖油瓶”,反而能攜手通過一種叫煙酸核苷(NaR)的分子,來幫我們更好地維持體內NAD+平衡,保護全身器官、抗擊衰老!


來自肝與腎的NAD+接力賽
NAD+的重要性相信大家早已耳熟能詳,簡單來説,它是細胞內幾乎半數的基礎生化反應的參與者;它是ATP生成時的遞電子體;它是細胞DNA修復的原料。所以説,如果身體中有充足的NAD+,我們的衰老進程也會放緩。
而聊到NAD+代謝,就不得不提到全身NAD+代謝的中樞器官——肝臟,它可以分解NAD+,產生煙酰胺(Nicotinamide, NAM),後者再通過血液循環被其他器官攝取並用於合成自身NAD+,形成一個“回收再利用”的NAD+循環。
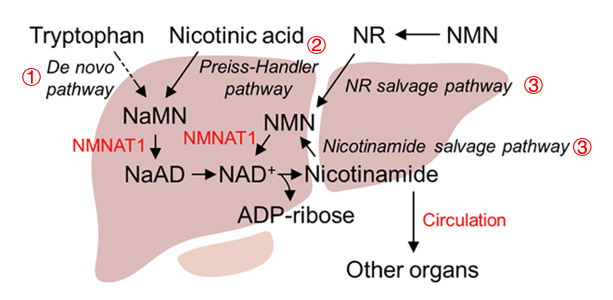
圖注:肝臟中NAD+和Nicotinamide(煙酰胺)生成途徑的示意圖(①色氨酸從頭合成途徑;②利用煙酸的 Preiss-Handler途徑;③利用煙酰胺或是NR的補救途徑)
盤點了上述的NAD+合成途徑,細心的你一定會發現一個“命門”:無論從哪兒開始,最終都得經由 NMNAT1 (NMN腺苷酸轉移酶)來生成 NAD+。所以……要是NMNAT1出了問題,身體不可避免就會出現NAD+降低,以及底物(NaMN 和 NMN)大量累積的局面。
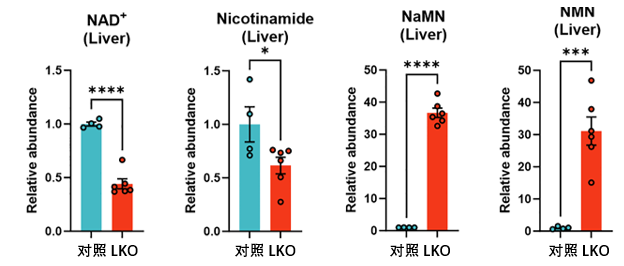
圖注:LKO為肝臟NMNAT1基因敲除鼠,表明該基因異常
雖然實錘NMNAT1缺失會破壞肝臟自身的NAD +合成,但隨後的實驗,卻讓整個代謝途徑疑雲重重:
LKO小鼠在口服經過標記的色氨酸(NAD+從頭合成途徑的起始原料,當身體利用這些色氨酸進行代謝時,所有由它轉化而來的下游產物均會帶上標記)後,小鼠全身的NAD+穩態和循環煙酰胺(Nicotinamide)水平卻未發生明顯變化(變化的只有肝臟)……
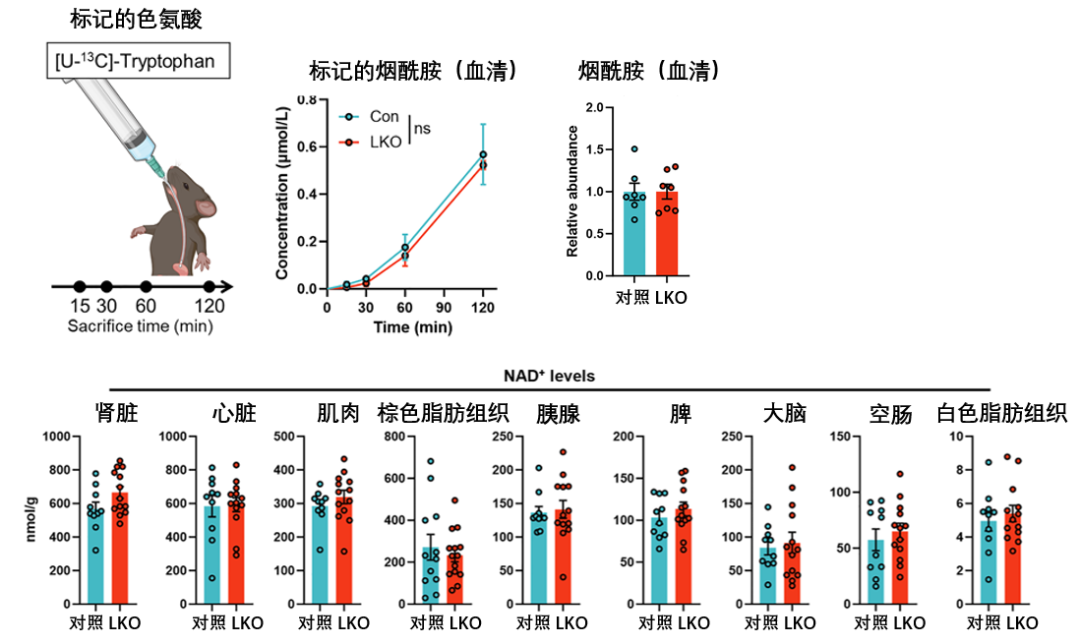
圖注:各組織NAD+與下游煙酰胺水平未有明顯變化
有點蹊蹺,因為敲除後肝臟基本也已“熄火”,但全身NAD+卻依然穩健……這是怎麼回事?通過代謝組學以及質譜分析,科學家們發現:在LKO小鼠的肝臟與血清中,有一個含量急劇升高(約30倍)的分子——煙酸核苷 (Nicotinic acid Riboside, NaR)。
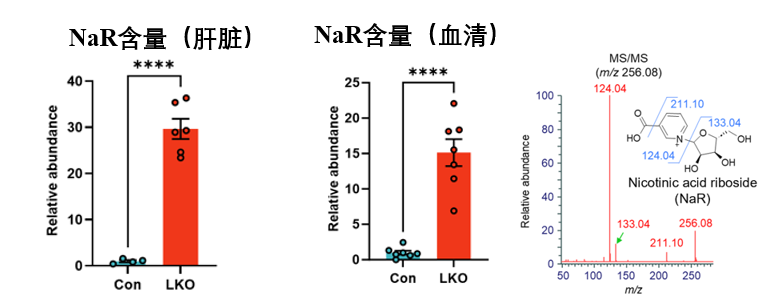
NaMN一多,NaR也跟着同步上漲,怎麼回事?觀察兩者的化學式,我們也很清晰的發現,NaMN到NaR,不就是脱掉一個磷酸基團的事?而這類反應通常由NT5C家族的成員催化。來個合理推測:NaMN是不是有很大可能通過脱去磷酸基團,變成了NaR。
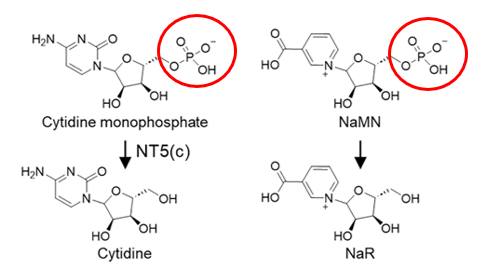
圖注:與如胞苷一磷酸到胞苷的脱磷酸化過程類似(圖左),推測NaMN可能通過脱磷酸化轉化為 NaR
儘管只是基於類似過程的推斷,但到了這個節骨眼……不驗證一下簡直對不起觀眾!干擾NT5C2表達,然後追蹤 NaR 的生成,結果發現,無論是敲除NT5C2還是抑制劑處理,均有效抑制肝細胞內NaR的產生以及向外的釋放。
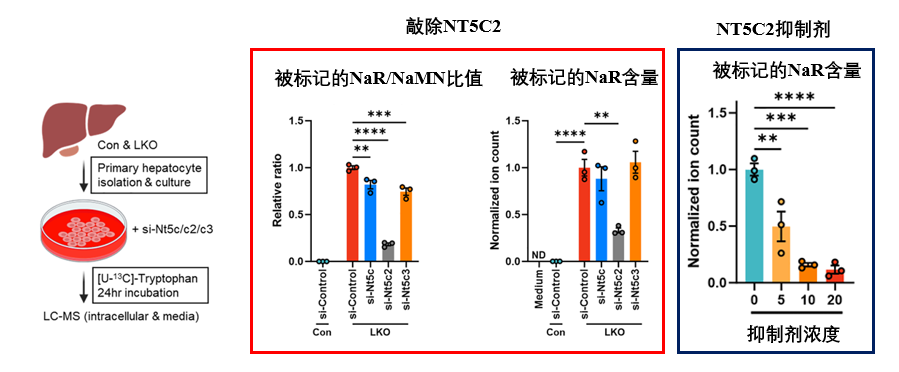
圖注:紅框中Con、LKO代表對照鼠與NMNAT1基因敲除鼠(NaMN降低)
所以,當肝臟NMNAT1功能受損導致NaMN大量累積時,肝臟就會啓動應急方案:利用NT5C2酶,將NaMN脱去磷酸基團,生成NaR,並將其釋放到血液循環中。但還沒完,血液循環中的NaR,會在哪裏派上用場,形成NAD+或是煙酰胺?
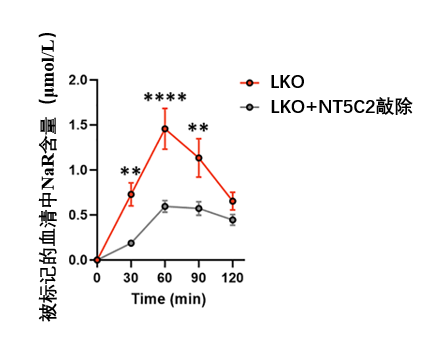
答案是:腎臟。結果表明,腎臟是唯一一個能夠快速且大量地將標記的NaR轉化為標記 NaAD(NAD+ 合成的直接前體)的器官(並且腎臟中還檢測到了高水平的標記 NAD+)。
再看看LKO小鼠的情況:循環中的NaR幾乎貢獻了腎臟中全部的NaAD (約100%) 和絕大部分的NAD+ (約75%) 。
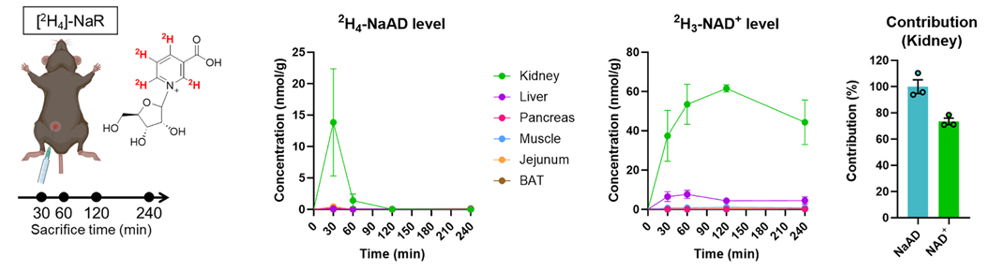
圖注:雖然肝臟功能受影響,腎臟依然能有效地利用循環中的NaR(左圖表明NaR已被標記)來合成NAD+
要想把 NaR 成功轉化為 NAD+,自然也少不了酶的幫忙。整個過程需要 NRK1、NMNAT1、NADSYN 這三個酶的協同。其中最關鍵的酶,就是將NaR磷酸化為NaMN的——NRK1。
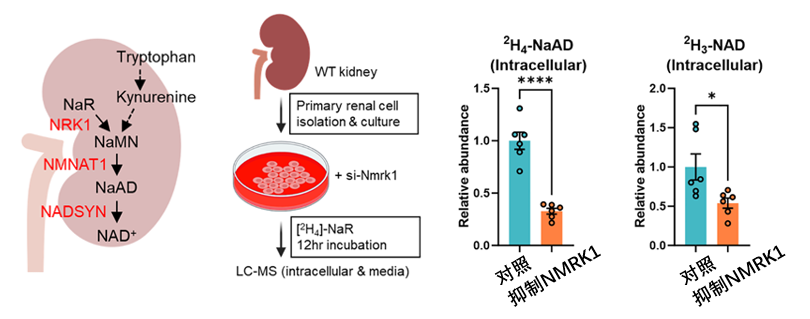
圖注:NMRK1基因(編碼NRK1酶)表達的降低抑制了腎細胞將NaR轉化為標記的NaAD與NAD+的能力
在利用NaR製造出NAD+後,腎臟的使命並未結束,它還會進一步將這些 NAD+分解代謝,轉化為煙酰胺(NAM)。緊接着把這些 NAM 重新釋放到血液循環中,供身體其他組織按需取用,合成它們各自所需的 NAD+,從而實現循環利用!
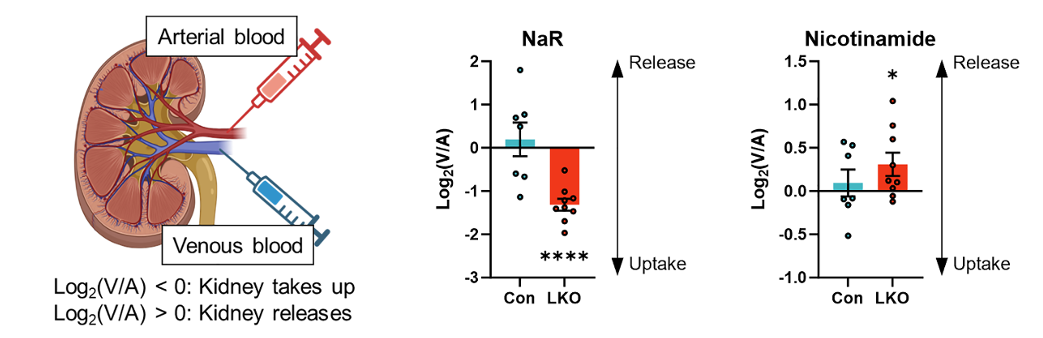
圖注:腎靜脈血中的NaR濃度低於動脈血 (Log₂(V/A) < 0),表明腎臟從血液中淨攝取了NaR ;腎靜脈血中的煙酰胺濃度高於動脈血 (Log₂(V/A) > 0),表明腎臟向血液中淨釋放了煙酰胺
看了這麼多,派派來個小總結:腎臟能高效捕獲肝臟產生的 NaR,並通過 NRK1 酶磷酸化 NaR,再沿着經典 Preiss-Handler 途徑(NaR → NaMN → NaAD → NAD+)轉化為 NAD+。這樣一來,就算肝臟NAD+合成出現bug,腎臟也能盡力維持整個身體的NAD+穩態。
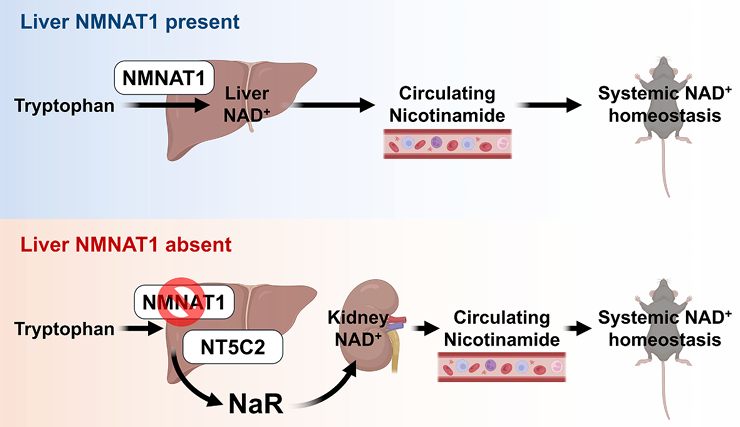
圖注:上圖為肝功能正常,下圖為肝功能異常時,腎維持全身NAD+穩態的方法

NaR與衰老
科普完肝—腎軸和NaR的前世今生,各位是不是也嗅到了一絲不尋常的氣息?我們都知道NAD+ 水平會隨着衰老降低,那這條新發現的NaR補給線,跟衰老之間是不是也有關係?不賣關子了,直接告訴你:有!而且隨着衰老,這個系統似乎也受到了影響。

No.1
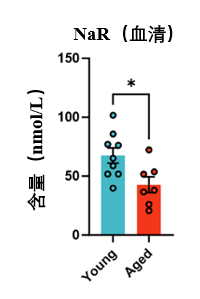
NaR水平降低
第一個因衰老出現問題的是血液循環裏 NaR 的水平,檢測了不同年齡段小鼠的血清樣本後,科學家們發現與年輕小鼠(3個月齡)相比,衰老的小鼠(25個月齡)血清中的 NaR 濃度明顯出現降低。
No.2
肝臟產能不足
血液中NaR減少……聰明的你很快就能想到!大概率是肝臟產能不行,確實如此,科學家們追蹤了標記色氨酸在肝臟中的代謝路徑後發現:衰老小鼠將標記色氨酸轉化為標記NaR的效率遠低於年輕小鼠。
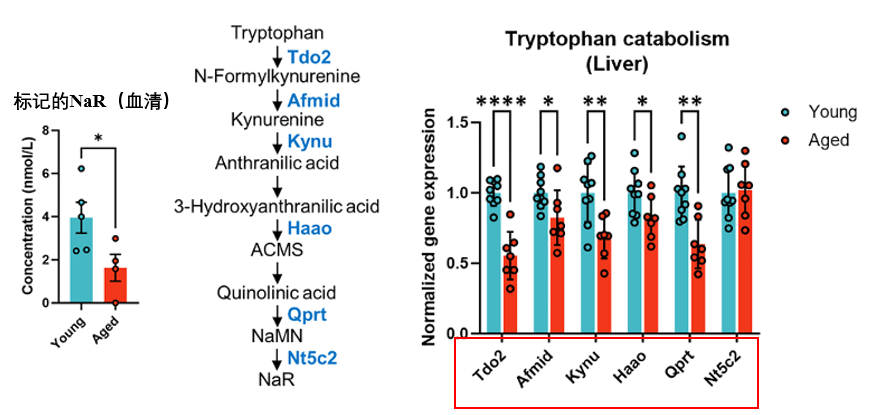
圖注:隨着衰老,合成NaR的多種酶表達降低
No.3
NaR通路下游的連鎖反應
腎臟這邊情況也不容樂觀……衰老小鼠的腎臟裏,除了總的NAD+與煙酰胺水平都低於年輕小鼠以外,新生成的標記NaMN、標記NaAD、標記NAD+的水平也同樣降低。説明即使起始原料(色氨酸)充足,衰老的腎臟也難以高效地將其轉化為最終的NAD+。
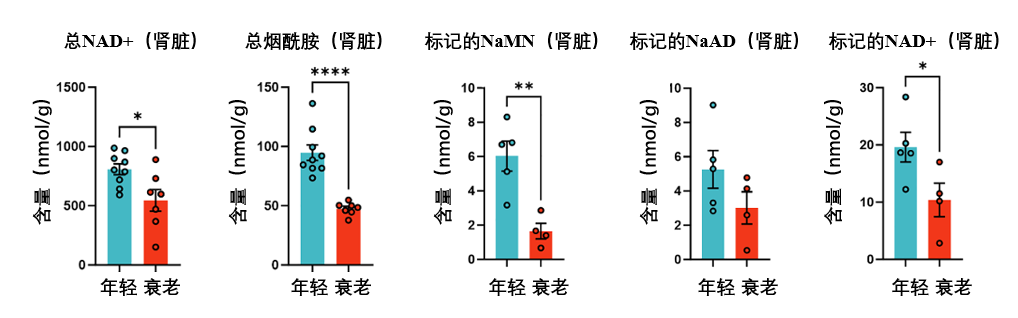
看到這裏,是不是也為這條隨衰老而失靈的新NAD+補充通路感到一絲擔憂?也不用太慌,既然已經找到問題根源——NaR減少,那通過外部補充NaR,能否逆轉或改善這些與衰老相關的負面變化?


除了 NaR,還有B計劃?
將煙酸核苷(NaR)直接添加到年老小鼠的飲用水中,讓小鼠開懷暢飲兩週後,科學家們發現,外源NaR補充不僅有效提升體內循環NaR與下游代謝物(NaAD、煙酰胺)水平,還能維持全身多組織的NAD+穩態(特別是腎臟)。
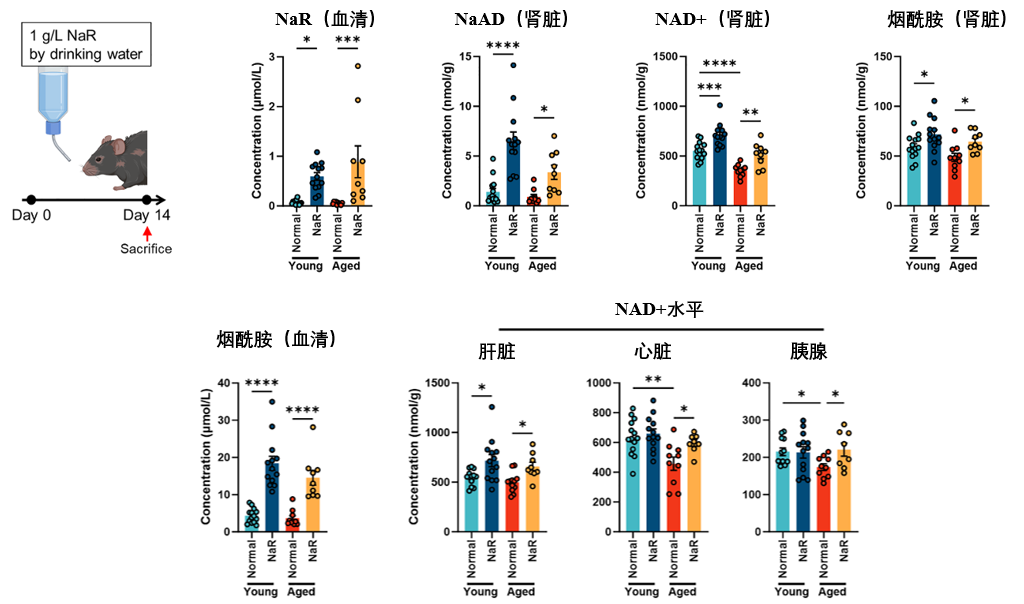
NAD+水平的提升,最終就體現在器官功能的改善上。研究發現,補充NaR能降低老年鼠鼠腎臟中與損傷、炎症相關的標誌物基因(如Kim1、Fgl2)的表達水平。同時,腎臟中F4/80陽性巨噬細胞(一種炎症細胞)的浸潤也明顯減少,表明小鼠腎臟功能好轉。
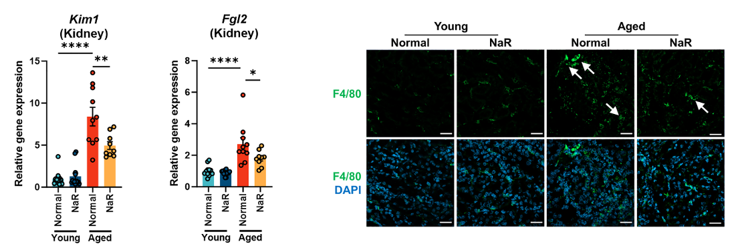
圖注:補充NaR恢復衰老小鼠腎臟功能
更重要的是,補充 NaR 展現了顯著的臨牀意義!老年小鼠的尿白蛋白/肌酐比值(ACR,衡量腎臟濾過功能損傷和蛋白尿的重要指標)在補充 NaR 後出現降低。腎臟功能得到了實質性的改善。
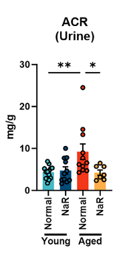
圖注:注意紅黃柱子的對比
以上,直接補充NaR確實有着非常巨大的應用前景,但坦白來説,目前市場上可能還沒有像其他NAD+前體那樣成熟和廣泛可得的膳食補充劑。
那麼,有沒有其他方法也能激活這條“肝-腎NaR軸”? 當然,而且接下來登場的這位,大家絕對熟悉!就是我們聽過無數遍的NAD+ 前體——煙酸(Niacin,也稱維生素B3,Preiss-Handler途徑的起始物)。
給野生型小鼠口服煙酸後,科****學家們發現其肝臟中NaMN(NaR的前體)、NaR的水平都有所增加。並且因為煙酸的補充,腎臟中的NaMN、NaAD和NAD+水平均出現升高。表明煙酸對肝-腎NaR軸的積極效果。
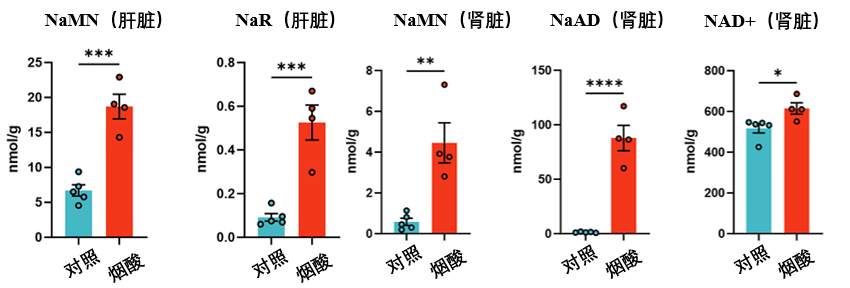
而且,煙酸還廣泛存在於多種我們日常接觸的食物中(比如花生、金槍魚以及動物內臟等)[2]:
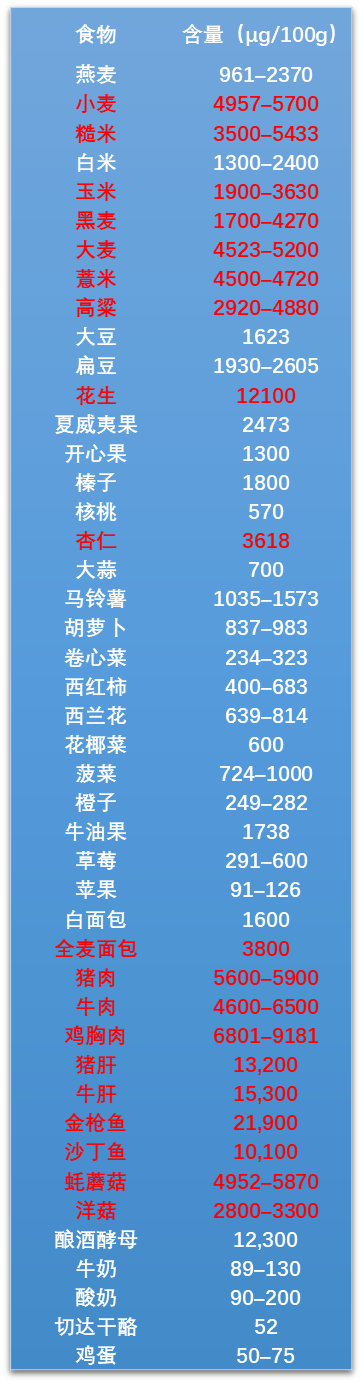
圖注:上下滑動查看,標紅的為煙酸含量較高的食物
所以通過均衡飲食,多攝入這些富含煙酸的食物,不僅能滿足我們身體對維生素 B3 的基本需求,或許還能在一定程度上支持“肝-腎NaR軸”,維持體內的NAD+水平,延緩腎衰,為我們的抗衰大業添磚加瓦!
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Song, W. S., Shen, X., Du, K., Ramirez, C. B., Park, S. H., Cao, Y., Le, J., Bae, H., Kim, J., Chun, Y., Khong, N. J., Kim, M., Jung, S., Choi, W., Lopez, M. L., Said, Z., Song, Z., Lee, S. G., Nicholas, D., Sasaki, Y., … Yang, Q. (2025). Nicotinic acid riboside maintains NAD+ homeostasis and ameliorates aging-associated NAD+ decline. Cell metabolism, S1550-4131(25)00217-7. Advance online publication. https://doi.org/10.1016/j.cmet.2025.04.007
[2] Hrubša, M., Siatka, T., Nejmanová, I., Vopršalová, M., Kujovská Krčmová, L., Matoušová, K., Javorská, L., Macáková, K., Mercolini, L., Remião, F., Máťuš, M., Mladěnka, P., & On Behalf Of The Oemonom (2022). Biological Properties of Vitamins of the B-Complex, Part 1: Vitamins B1, B2, B3, and B5. Nutrients, 14(3), 484. https://doi.org/10.3390/nu14030484