熱量限制翻車?臨牀6個月少吃30%未激活自噬,間歇性限時禁食效果更佳_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

熱量限制能夠激活自噬,改善健康,減緩衰老,這幾乎已經是長壽領域公認的“真理”。
然而,近日哈佛教授大衞·辛克萊(David Sinclair)在推特上分享了一項澳大利亞的新研究,研究結果對該理論提出了質疑:
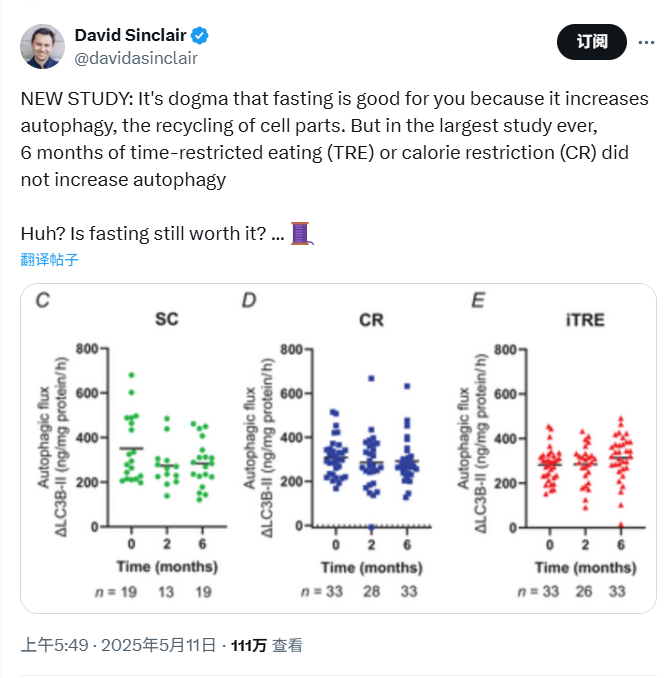
在一項為期6個月、共121名受試者參與的飲食干預試驗中,間歇性限時禁食成功提升了自噬通量,熱量限制卻未見顯著效果[1]。
看到這個消息後,時光派會員羣裏有人問熱量限制是不是塌房了?!
要知道,這可是最經典的抗衰方法之一,為健康立過功,為長壽出過力,抗衰圈不能失去熱量限制,就如同西方不能失去耶路撒冷。
最重要的是,如果它真的塌了,這麼多年我們餓過的肚子算什麼?

熱量限制無效,間歇性限時禁食更優?
大量動物實驗表明,熱量限制等營養限制方法可激活自噬,但在人體臨牀中的效果還未有定論。
於是,來自澳大利亞的Timothy Sargeant團隊基於121名肥胖者的臨牀試驗數據,分析了不同營養限制方法對自噬的影響,這也是迄今規模最大的人類自噬研究。

圖注:該研究論文發表在學術期刊《The Journal of Physiology》上
受試人員被分為三組:
間歇性限時禁食組(iTRE):每週3天(不連續)在8:00-12:00之間只攝入30%的熱量,其餘時間禁食;非禁食日正常飲食。
熱量限制組(CR):每日熱量攝入減少30%。
標準護理組/對照組(SC):無飲食干預。
試驗第2個月時,三組人員的外周血單個核細胞(PBMC)自噬通量沒有觀察到明顯差異,説明短期營養限制還不足以顯著影響自噬功能。
干預持續6個月時,不同飲食方案的差異便顯現出來:
圖注:試驗中各組自噬通量的變化
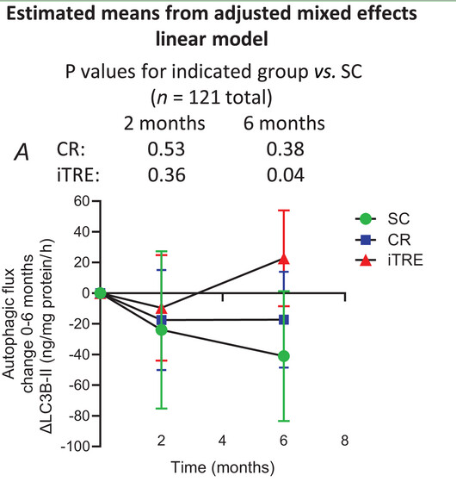
其中,對照組自噬通量與基線相比平均下降41.06單位,雖然沒有達到統計學顯著水平,但體現出自噬水平隨時間降低的趨勢。
試驗組中,熱量限制未能顯著提升受試者的自噬水平,而間歇性限時禁食組的自噬通量卻顯著高於對照組(P = 0.04)。這表明在相同干預週期內,間歇性限時禁食在改善自噬方面要優於熱量限制。
值得注意的是,間歇性限時禁食組的自噬通量與基線水平相比並未顯著增加,與對照組的差異主要源於對照組自噬功能自然下降。這説明該飲食方案的效果可能是延緩自噬功能衰退,而非直接增強自噬水平**。**
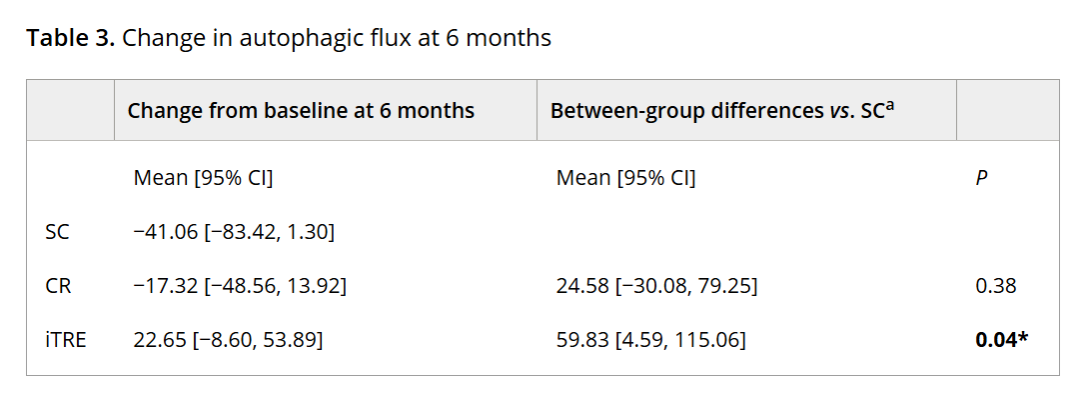
圖注:第6個月各組自噬通量的變化
此外,儘管三組人員的體重均顯著下降(對照組2.1 kg,熱量限制組6.7 kg,間歇性限時禁食組7.1 kg),但分析顯示自噬通量變化與體重減輕沒有顯著關聯。
綜上,我們可以得出結論:間歇性限時禁食能增加自噬通量,熱量限制無效——才怪!

熱量限制不行?別急着下結論
人心中的成見是一座大山,一見熱量限制在某研究中沒能顯著提升自噬通量,立刻想到熱量限制無法激活自噬,立刻想到熱量限制毫無效果,立刻想到長壽研究全無意義……

其實,論文標題已然説明一切:《間歇性限時飲食可能會增加人類的自噬通量:一項探索性分析》。
所謂探索性分析,就是要探索數據中可能存在的模式、趨勢或假設,結論是否靠譜還得看後續一系列研究驗證。
因此論文用詞也很謹慎,只説了熱量限制沒能顯著增加自噬通量的結果,但沒急着下結論説熱量限制不能激活自噬。
因為可能原因實在太多了,比如熱量限制真的不行,或者是干預時間和強度不夠,甚至乾脆研究本身就存在一些問題。
研究團隊也非常坦誠,在文中列出了研究的一系列侷限之處,包括但不限於:
No.1
受試者代表性不足
本研究其實是根據一項臨牀試驗數據誕生的“衍生品”,原試驗是想比較間歇性限時禁食和熱量限制對肥胖人羣代謝指標的影響,所以招募的受試者都是糖尿病風險較高的肥胖或超重者,結果不一定適用於健康人羣。
No.2
檢測方法存在誤差
試驗中使用溶酶體抑制劑氯喹來阻斷自噬體降解,通過對比自噬體膜標誌蛋白LC3B-II含量評估自噬通量。然而,氯喹可能通過非經典自噬途徑誘導LC3B-II合成,導致測量值偏高。
No.3
檢測不全面
研究只檢測了外周血單個核細胞的自噬通量,無法準確反映代謝活躍組織(如肝臟、肌肉)的自噬變化,而這些組織往往對飲食干預更敏感。

熱量限制如何,CALERIE説了算
雖然本研究是迄今規模最大的人類自噬研究,但既然涉及到熱量限制,為什麼不問問CALERIE呢?
CALERIE(Comprehensive Assessment of Long-term Effects of Reducing Intake of Energy,減少熱量攝入的長期影響綜合評估),由美國官方機構NIA與NIH贊助,在華盛頓大學醫學院、彭寧頓生物醫學研究中心、塔夫茨大學三個機構同時進行,是規模最大、持續時間最長、結果最為可信的熱量限制人體臨牀研究。
在前期的I期研究中,48名受試者參與了試驗,結果顯示6個月熱量限制25%,可以顯著降低胰島素抵抗、低密度脂蛋白膽固醇、DNA氧化損傷和核心體温,説明代謝功能得到了顯著改善[2]。
隨後的II期研究中,220名受試者熱量限制25%,堅持24個月。結果顯示,他們炎症水平降低了,氧化應激減少了,心血管疾病風險變小了,免疫變好起來了,就連衰老速度都減緩了[3,4]。
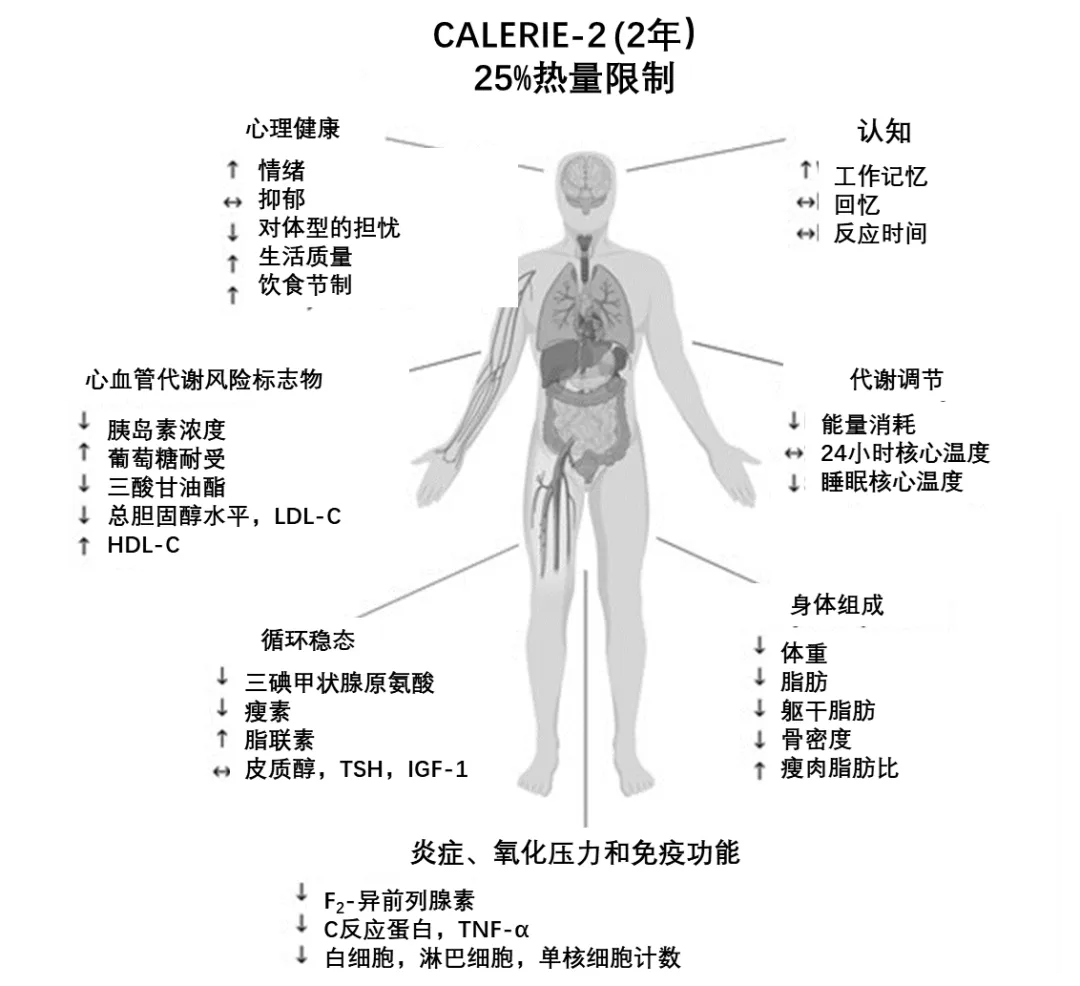
圖注:24個月熱量限制25%的影響
遺憾的是,研究因倫理考量未直接檢測自噬指標,但鑑於代謝、炎症、氧化應激等方面都有改善,而人體系統往往是牽一髮而動全身,自噬水平也極有可能發生了積極變化。即使沒有,面對這麼多顯著益處,還要什麼自行車。
時光派小結
綜上,熱量限制沒有塌房,大家可以放心大膽地繼續減少卡路里攝入,少吃的每一口都算數。
當然本研究也再次提醒我們,不同飲食方案、進食時間的確會對干預效果產生明顯差異。但也不必苛求,之所以會有各式各樣的健康飲食方案,本就是長時間禁食、熱量限制難以堅持下來,才誕生了適合不同生活方式的“平替”版。
最有效的飲食方案,不是最流行的,也不是最有效的,而是那個與忙碌的生活節奏最契合、能陪你走得最遠的。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Julien Bensalem, Teong, X. T., Hattersley, K. J., Hein, L. K., Célia Fourrier, Linh, Singh, S., Liu, K., Wittert, G. A., Hutchison, A. T., Heilbronn, L. K., & Sargeant, T. J. (2025). Intermittent time‐restricted eating may increase autophagic flux in humans: an exploratory analysis. The Journal of Physiology. https://doi.org/10.1113/jp287938
[2] Heilbronn, L. K., Jonge, L. de, Frisard, M. I., DeLany, J. P., D. Enette Larson-Meyer, Rood, J., Nguyen, T., Martin, C. K., Volaufova, J., Most, M. M., Greenway, F. L., Smith, S. R., Deutsch, W. A., Williamson, D. A., Ravussin, E., & for. (2006). Effect of 6-Month Calorie Restriction on Biomarkers of Longevity, Metabolic Adaptation, and Oxidative Stress in Overweight Individuals. JAMA, 295(13), 1539–1539. https://doi.org/10.1001/jama.295.13.1539
[3] Dorling, J. L., Vliet, van, Huffman, K. M., Kraus, W. E., Bhapkar, M., Pieper, C. F., Stewart, T., Das, S. K., Racette, S. B., Roberts, S. B., Ravussin, E., Redman, L. M., & Martin, C. K. (2020). Effects of caloric restriction on human physiological, psychological, and behavioral outcomes: highlights from CALERIE phase 2. Nutrition Reviews, 79(1), 98–113. https://doi.org/10.1093/nutrit/nuaa085
[4] Waziry, R., Ryan, C., Corcoran, D., Huffman, K., Kobor, M., & Kothari, M. et al. (2023). Effect of long-term caloric restriction on DNA methylation measures of biological aging in healthy adults from the CALERIE trial. Nature Aging. doi: 10.1038/s43587-022-00357-yIF: 17.0 Q1