報告基因敲入(KI)細胞系的構建原理與前沿應用_風聞
源井生物-让基因编辑更简单!1小时前
作為第三代基因組編輯工具,CRISPR-Cas9系統因其精準性強、操作簡便和高度可編程的特性,在生命科學基礎研究及臨牀應用中得到了廣泛認可。該系統源自原核生物的獲得性免疫機制,核心成分包括Cas9蛋白和引導RNA(gRNA)。Cas9在gRNA的引導下識別並切割靶DNA序列,誘導DNA雙鏈斷裂(DSB),細胞隨後通過以下兩種方式進行修復:
1.非同源末端連接(NHEJ):修復速度快但準確性較低,常產生小片段的插入或缺失,適用於基因敲除(Knockout)實驗。
2.同源重組修復(HDR):在提供具有同源臂的供體模板時,可實現目標序列的精準插入,構建基因敲入(Knock-in, KI)模型的關鍵機制。
藉助CRISPR技術,研究人員可以高效構建表達報告**基因(KI)敲入細胞**系。這類模型具備內源調控、動態可視追蹤以及高通量篩選等優勢,是分子機制研究、靶向藥物開發和基因功能篩查的重要工具。本文將深入探討報告基因敲入細胞系的技術路徑、構建方法及未來應用趨勢。
什麼是基因敲入技術?
基因敲入(Knock-in)技術通過將外源功能序列(如報告基因)定點整合至基因組特定位置,實現了對基因表達的精準調控。相比傳統過表達系統,基因敲入技術具有三大核心優勢:
生理相關性表達:受內源啓動子調控,保持天然表達水平
時空動態追蹤:支持即時監測基因表達變化
定位精準性:避免隨機整合導致的表達異常
結合CRISPR技術後,基因敲入的效率與穩定性得到了極大提升,為細胞功能的精確研究提供了有力工具。
報告細胞系構建的四大技術策略
根據研究需求,構建報告基因敲入(KI)細胞系可採用多種策略:
1.啓動子近端插入報告基因插入於目標基因起始密碼子之前或首個內含子中,可保留內源調控機制,適用於轉錄活性研究。
2.編碼區融合表達將報告基因與目標蛋白的5’或3’端融合,形成功能性融合蛋白,常用於亞細胞定位或動態追蹤。
3.RES/2A共表達系統利用IRES或2A肽連接報告基因與目標蛋白,實現共轉錄但獨立翻譯,適用於保持蛋白功能完整的場景。
4.表達替換策略用報告基因完全替代原有編碼區,在保留原始啓動子的前提下研究基因失功能狀態。
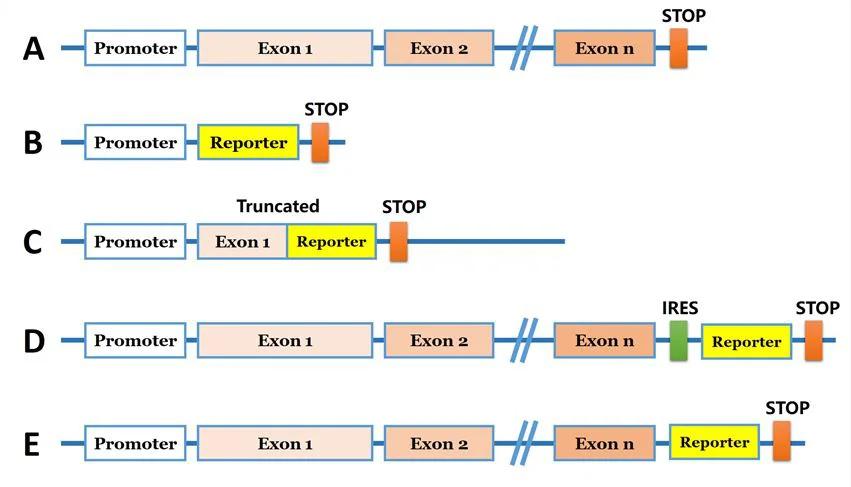
圖1: 報告基因敲入的常見策略
源井生物開發的CRISPR-U™系統通過優化gRNA篩選算法及供體構建策略,顯著提高敲入效率,覆蓋300餘種常用哺乳動物細胞系,敲入效率較傳統系統提升5至10倍。
應用場景全解析
1. 監測內源啓動子活性與基因調控網絡
利用CRISPR將報告基因精準嵌入啓動子下游,可在不干擾染色質背景的條件下監測啓動子活性。該策略適用於研究轉錄因子調控、表觀修飾及非編碼序列對基因表達的影響。
案例:通過在HEK293細胞中將熒光素酶敲入SREBP1啓動子區域,研究人員建立了用於監控啓動子活性的雙等位基因模型,成為研究脂代謝相關基因調控的重要工具。
2. 動態追蹤蛋白表達與亞細胞轉運
通過將熒光標籤基因敲入目標蛋白位點,可在活細胞中實現蛋白即時成像和空間定位。
案例:GFP敲入MAP1LC3B基因N端構建的GFP-LC3融合蛋白模型被廣泛用於細胞自噬研究,支持自噬狀態的動態評估和藥物響應分析。
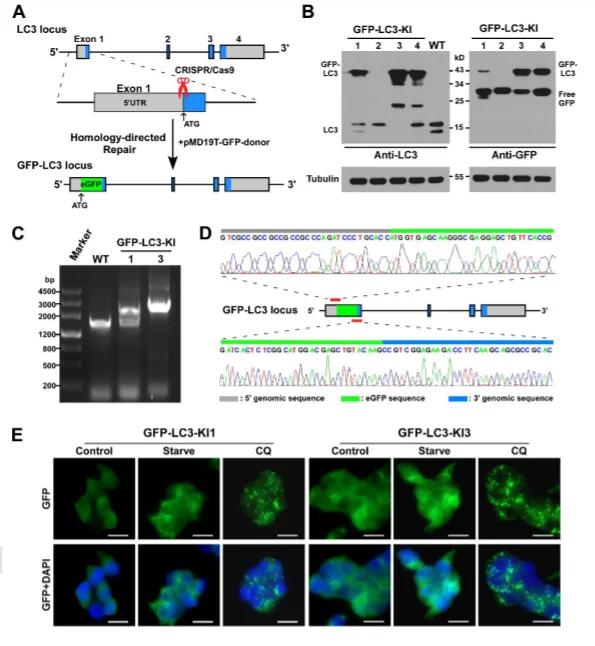
圖2: 293FT細胞中MAP1LC3B基因座處敲入GFP-LC3
3. 藥物作用靶點驗證與篩選平台建設
利用報告細胞系建立低背景、高信噪比的篩選系統,可在藥物開發初期快速驗證作用機制及靶點有效性。
案例:構建三標記HeLa細胞系用於自噬路徑篩選,發現PLK1抑制劑與PIM抑制劑可模擬羥氯喹的自噬阻斷效應,驗證了該體系在靶點識別中的應用潛力。
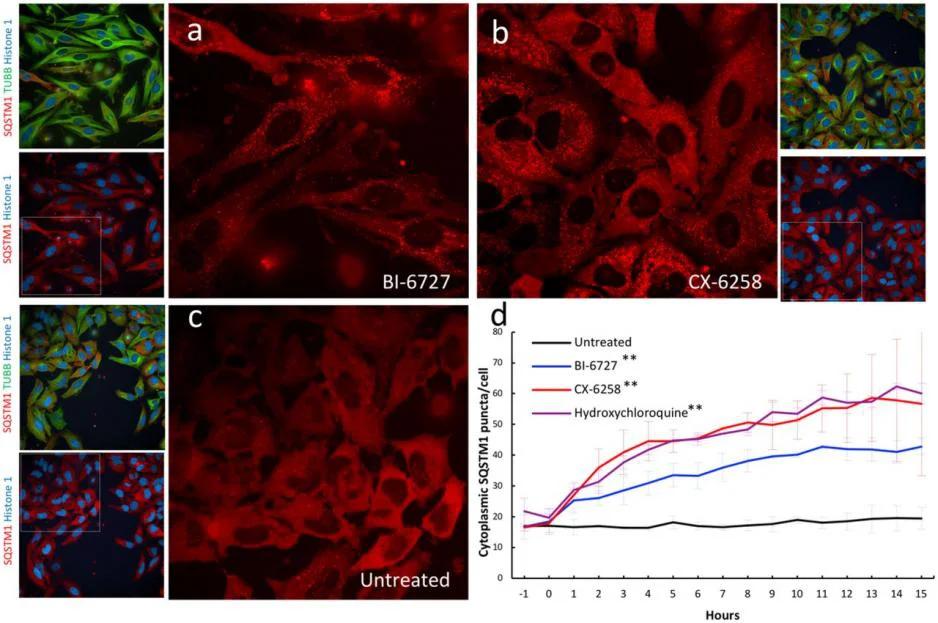
圖3: 三重標記的HELA細胞系中誘導自噬囊泡積累的激酶抑制劑的驗證
報告基因敲入細胞系的廣泛應用,不僅推動了基因功能研究向更高分辨率和更大規模的發展,也在精準醫學和新藥研發中發揮着日益重要的作用。隨着CRISPR工具、單細胞分析、人工智能輔助篩選與三維類器官等技術的融合,報告細胞模型將持續向更復雜、更精準的方向進化,成為基礎研究走向臨牀轉化的重要橋樑。