一文掌握|OVCAR-3細胞培養&基因編輯全攻略_風聞
源井生物-让基因编辑更简单!42分钟前
在卵巢癌相關研究領域,**OVCAR-3細胞**堪稱“王牌模型”。它因出色模擬臨牀化療耐藥特性,被廣泛應用於腫瘤耐藥機制解析、靶向治療策略開發、免疫逃逸現象研究及多種基因功能探索中。從藥物篩選、基因敲除,到信號通路分析與細胞命運追蹤,它幾乎覆蓋了腫瘤科研的全流程,是科研工作者常備的實驗“利器”。如果你還沒有開始使用OVCAR-3細胞,可能已經與一條通向研究前沿的捷徑擦肩而過!今天,小源將帶你全面“解鎖” OVCAR-3的使用指南:分享實用的培養心得與高效的基因編輯技巧,助你在科研道路上效率倍增,輕鬆應對各類核心實驗!
細胞信息
**細胞名稱:**OVCAR-3(人卵巢癌細胞)
**細胞形態:**上皮樣,貼壁細胞
**細胞培養條件:**80%RPMI-1640+20%FBS+0.01mg/mL胰島素
**氣相:**空氣,95%;二氧化碳,5%
**温度:**37℃
**換液頻次:**2-3天/次
**傳代比例:**1:2-1:3
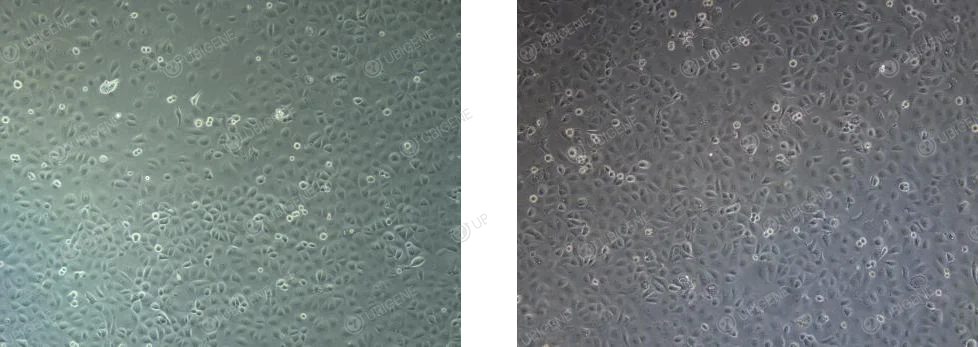
細胞生長正常圖片:細胞呈不規則上皮樣,多為多邊形或梭形,會呈現"鋪路石樣"排列
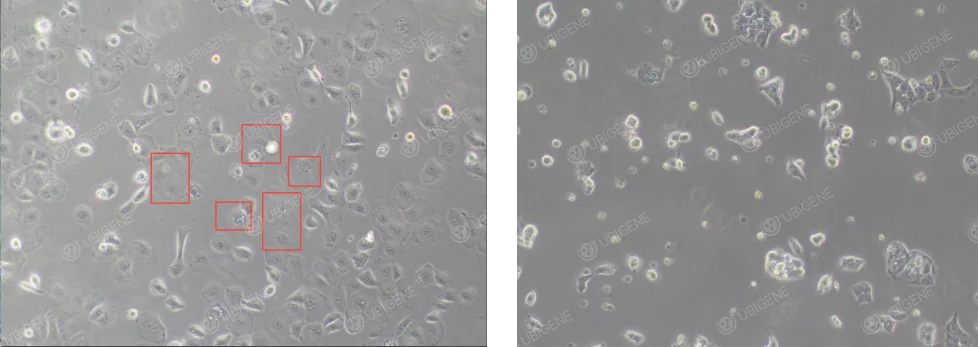
 細胞生長狀態差圖片:細胞形態異常,如細胞體積變大,扁平化(如下圖紅框框起來處),細胞可能變得不規則,失去典型的鋪路石樣外觀,出現空泡化等。
細胞生長狀態差圖片:細胞形態異常,如細胞體積變大,扁平化(如下圖紅框框起來處),細胞可能變得不規則,失去典型的鋪路石樣外觀,出現空泡化等。
 細胞復甦
細胞復甦
1) 準備:取7mL完全培養基於離心管中備用
2) 解凍:將細胞從乾冰裏取出,用鑷子夾住蓋子放入 37℃水浴中快速晃動(注意:水不能沒過蓋子),使其在1分鐘左右完全融化,直至冰塊融化至綠豆大小,停止水浴
3) 離心:將解凍後的細胞懸液轉移至離心管中,1100rpm條件下離心4分鐘,棄去上清液
4) 重懸與接種:用完全培養基重懸細胞,接種於合適大小的培養皿/瓶中
5) 培養:將培養皿/瓶置於37℃培養箱中培養,24小時後觀察細胞狀態及貼壁情況
細胞傳代(以T25瓶為例)
1) 當細胞匯合度達到80%時可進行傳代,傳代時在超淨台內棄去培養瓶裏的培養液,加入5mLPBS洗滌細胞1-2次。
2) 加入1mL胰酶,輕輕晃動瓶子並使胰酶完全浸過細胞,將培養瓶放入培養箱孵育 3-4分鐘,待在顯微鏡下觀察到大部分細胞變圓變亮,輕輕晃動培養瓶兩側有大部分細胞脱落時,立即終止消化。
3) 加入2倍胰酶體積即2mL完全培養基終止消化,然後轉移至15mL離心管中。
4) 1100 rpm 室温離心 4 分鐘,離心結束,棄去上清,加入完全培養基重懸細胞。
5) 細胞按照1:2-1:4比例傳代,傳代第二天觀察細胞狀態。
細胞凍存
1) 收集細胞:按照細胞傳代的過程收集消化好的細胞到離心管中。
2) 離心:1100rpm條件下離心4分鐘,去掉上清。
3) 重懸與凍存:用細胞凍存液重懸細胞,按每1mL凍存液含1×10^6個細胞/mL分配到凍存管中,標註好名稱、代數、日期等信息。
4) 降温與儲存:將凍存管置於程序降温盒中,-80℃冰箱中過夜後轉入液氮罐內保存。
OVCAR-3細胞培養****注意事項
1.在培養OVCAR-3細胞時,血清的濃度需精確控制在20%,並需額外補充胰島素至終濃度0.01 mg/mL,以滿足細胞生長需求。
2.胰酶消化過程中需密切關注時間,儘量使細胞解離為單個狀態。操作時應避免劇烈吹打,採用輕柔方式處理,以減少機械損傷。
3.建議傳代時維持適當的接種密度,每次分瓶比例控制在1:2至1:3之間。待細胞匯合度達到80%至90%時進行傳代,有助於維持其良好的生長狀態。
4.培養過程中推薦使用品質優良的胎牛血清,以提升細胞活性和實驗穩定性。
OVCAR-3細胞轉染時注意事項
1.轉染前應確保細胞狀態良好,並處於對數生長期,此階段細胞活躍、分裂迅速,能顯著提升轉染效率。建議細胞密度控制在70%~80%之間。
2.消化細胞時需掌握好酶消化時長,避免因處理過度造成細胞損傷。
3.操作過程中應將細胞充分打散為單細胞懸液,儘量避免出現細胞聚團現象。
4.實驗用細胞的存活率應達到80%以上,以保證實驗可靠性。
5.若採用電轉法進行轉染,需嚴格控制所用細胞數量,並於電轉結束後及時將細胞接種於合適類型的培養板中。
6.電轉後細胞應具備良好的貼壁能力,貼壁率不低於70%,以確保後續實驗順利進行。
7.使用電轉技術時,實驗總時長需嚴格控制,避免電轉過程時間過長導致細胞活力下降。
8.電轉完成24小時內應及時更換為含高品質胎牛血清的完整培養基,以促進細胞恢復和生長。
9.使用慢病毒載體轉染時,應將感染前的細胞密度控制在30%~40%之間,避免過度融合影響感染效率。
10.病毒法正式實驗前建議開展預實驗,以確定最合適的MOI,同時在感染階段加入Polybrene助染劑以提高轉染效率。
11.對於各類轉染試劑,在使用前務必徹底混勻,確保成分分佈均勻,以保證實驗的一致性和重複性。
OVCAR-3鋪單克隆實驗注意事項
1. 確保鋪克隆實驗前細胞狀態正常,老化細胞少,建議控制細胞匯合度在70%左右
2. 鋪克隆時細胞活率≥80%
3. 可先進行預實驗找到合適的鋪克隆梯度,避免單克隆佔比太低
4. 細胞接種96孔板時需確保細胞分佈均勻
5. 稀釋細胞計數後結果最好落在1*10^6-2*10^6之間
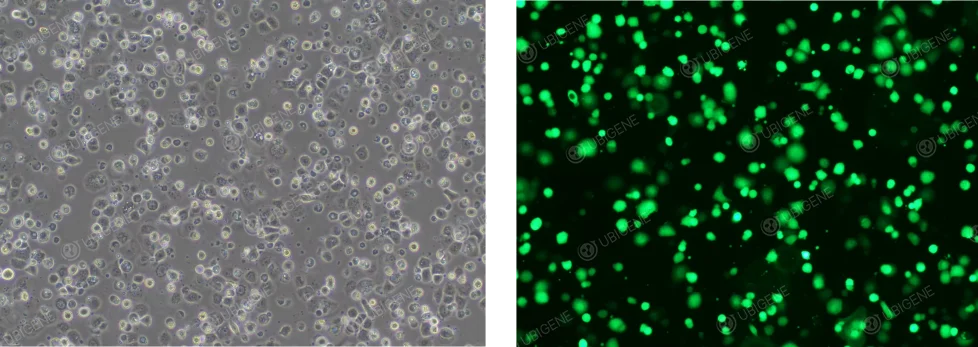
電轉圖: