用CRISPR技術研究點突變:構建遺傳病模型的新策略_風聞
源井生物-让基因编辑更简单!1小时前
隨着精準醫學的發展,點突變已成為揭示遺傳疾病機制和開發個性化療法的關鍵靶點。通過如CRISPR/Cas9這類先進的基因編輯工具,科學家得以在細胞與動物模型中準確引入單個鹼基的改變,從而深入解析疾病的分子基礎,並推動精準治療策略的研發。
什麼是點突變?
點突變指DNA序列中單個鹼基的改變(包括替換、插入或缺失一個鹼基)。這類突變可能發生在蛋白編碼區(外顯子)或非編碼區(如啓動子、增強子、內含子等調控區域),並按功能影響可分為功能喪失型與功能獲得型。
1. 編碼區點突變:位於基因外顯子,分為同義突變(蛋白質序列不變)和非同義突變(改變氨基酸,引發結構或功能變化)。
2. 非編碼區點突變:位於啓動子、增強子、剪接位點或UTR等區域,不改變蛋白序列,但可能影響基因表達水平、RNA剪接或調控元件功能。
3. 功能喪失突變:基因產物失活或截短,如產生無義密碼子導致蛋白功能喪失。此類突變多為隱性遺傳(需雙等位基因突變才能致病)。
4. 功能獲得突變:突變使基因獲得新功能或過度活化,常見於顯性疾病或癌症基因,如原癌基因突變讓細胞持續增殖。
 圖1. 點突變對蛋白質影響的分類示意圖。左側同義突變不改變氨基酸(Lys→Lys),右側包括無義突變(產生終止密碼子Tag,截短蛋白)和錯義突變(AA→Arg/Thr,改變氨基酸)。紅字為突變鹼基,藍色和綠色框為氨基酸結構示意。
圖1. 點突變對蛋白質影響的分類示意圖。左側同義突變不改變氨基酸(Lys→Lys),右側包括無義突變(產生終止密碼子Tag,截短蛋白)和錯義突變(AA→Arg/Thr,改變氨基酸)。紅字為突變鹼基,藍色和綠色框為氨基酸結構示意。
二、利用CRISPR/Cas9技術實現精準點突變
CRISPR/Cas9系統利用導向RNA(sgRNA)精確識別靶DNA序列,並由Cas9核酸酶引發雙鏈斷裂(DSB)。細胞隨後通過內源性修復機制修復斷裂,有兩種主要途徑:
非同源末端連接(NHEJ):修復過程中易引入隨機插入或缺失(indel),可導致基因失活。
同源重組修復(HDR):在提供含特定位點突變的供體DNA模板時,細胞可將目標突變精確整合進基因組中。
通過這種方式,可構建特定**點突變細胞(株**)系或動物模型,為模擬人類疾病提供理想平台。
三、點突變模型構建流程
典型的構建流程包括:
1.設計靶向突變位點的sgRNA與Cas9系統;
2.合成含目標突變的供體DNA(如單鏈寡核苷酸);
3.通過電轉或病毒載體導入細胞;
4.採用單細胞克隆技術篩選出含突變的細胞株;
5.對雜合或純合突變型進行功能驗證。
針對顯性疾病,僅需要單等位基因突變即可模擬表型;而隱性疾病則需篩選出雙等位基因突變型。
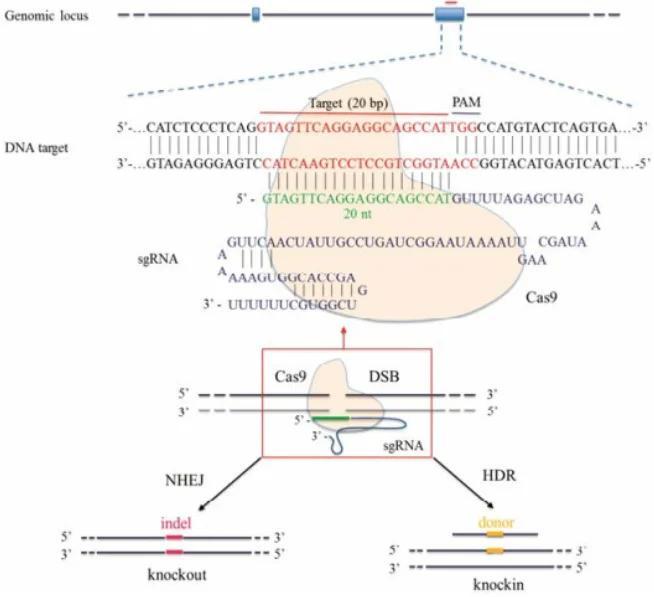 圖2:CRISPR/Cas9介導的基因編輯示意圖。Cas9蛋白(黃色)在sgRNA引導下識別藍色的靶序列並切割DNA造成雙鏈斷裂(DSB)。細胞啓動修復機制,非同源末端連接(NHEJ)常引入小插入/缺失(indel)導致基因敲除(左),而同源重組(HDR)則利用提供的供體DNA(黃色片段)精確修復並插入特定突變(右)
圖2:CRISPR/Cas9介導的基因編輯示意圖。Cas9蛋白(黃色)在sgRNA引導下識別藍色的靶序列並切割DNA造成雙鏈斷裂(DSB)。細胞啓動修復機制,非同源末端連接(NHEJ)常引入小插入/缺失(indel)導致基因敲除(左),而同源重組(HDR)則利用提供的供體DNA(黃色片段)精確修復並插入特定突變(右)
四、疾病模型案例分析
1. 中心核肌病(CNM)——雜合突變
常染色體顯性CNM常由DNM2基因的單點突變(如R465W)引起。Rabbi等人在患者來源的成肌母細胞和小鼠模型中設計了只識別突變等位基因的sgRNA/Cas9體系,成功靶向並敲除了突變的DNM2等位基因。編輯後,原本異常的細胞膜轉運和自噬等功能恢復正常。這説明CRISPR/Cas9可以對顯性突變等位基因進行等位特異性編輯,從而逆轉疾病細胞的表型,為顯性點突變疾病的治療和研究提供了可能。
2. 阿爾茨海默病(AD,雜合突變):
家族性早發AD常由APP或PSEN基因的點突變引發,如瑞典突變(APP KM670/671NL)或PSEN1
M146L突變。研究人員利用CRISPR/Cas9設計了特異性gRNA,只破壞突變等位基因。在攜帶瑞典突變的患者成纖維細胞中,敲除突變的APP等位基因使培養上清中Aβ肽的水平降低約。類似地,在攜帶PSEN1
M146L異源突變的細胞中進行基因編輯後,原本升高的Aβ42/40比例顯著下降並部分恢復正常。這些結果表明,針對AD相關點突變的CRISPR編輯可減輕致病性表型,為阿爾茨海默病機制研究和治療探索提供新思路。
3. Tay-Sachs病(TSD,純合突變):
TSD是一種常染色體隱性遺傳的神經變性病,80%的患者攜帶HEXA基因第11外顯子四鹼基(TATC)插入突變nature.com。在小鼠中敲除HEXA基因並未能重現典型病理,為此Qian等人嘗試使用基因編輯技術構建TSD模型。他們最終採用了新一代引物編輯技術在兔子HEXA基因中插入TATC突變,成功獲得了攜帶該插入突變的兔模型,並觀察到了肌無力、共濟失調等與人類TSD相似的表型。這一實例説明,通過精準編輯將人類致病點突變導入動物模型中,可在體內重現相應遺傳病表型,為深入研究疾病機制提供了工具。
4. 囊性纖維化(CF,純合突變):
CF是因CFTR基因隱性突變導致的致死性遺傳病,ΔF508等點突變會使CFTR蛋白功能喪失。Fan等人在綿羊中應用CRISPR/Cas9和體細胞核移植技術,敲除了綿羊CFTR基因。他們成功獲得了CFTR^–/–和CFTR^+/–的綿羊,出生後CFTR^–/–綿羊出現胰腺纖維化、腸梗阻、輸精管缺失等與人類CF高度一致的病理表現。這一大型動物模型展示了CFTR基因缺失足以誘發典型CF表型,驗證了該模型用於測試新藥和基因療法的潛力。
五、點突變模型的研究與臨牀意義
構建攜帶點突變的疾病模型,不僅有助於深入解析致病突變對基因功能的具體影響,還可用於篩選潛在的基因修復策略或藥物干預方式。例如,CF綿羊和TSD兔模型已在多項研究中用於評估針對特定突變的治療反應,展現了這類模型在推動基礎研究和藥物篩選中的關鍵作用。
 隨着CRISPR等技術工具的不斷完善,科學家能以更高精度模擬特定基因型,推動從機制研究到個性化治療的飛躍。點突變模型,正在成為精準醫學的重要驅動力。
隨着CRISPR等技術工具的不斷完善,科學家能以更高精度模擬特定基因型,推動從機制研究到個性化治療的飛躍。點突變模型,正在成為精準醫學的重要驅動力。