這種好細胞在體內堆積,反成促炎、促衰不定時炸彈!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯58分钟前

為什麼有的人明明作息規律,飲食也算健康,還是感覺哪哪不舒服,但是就是找不到根兒在哪裏?精力差、皮膚不好,時不時這裏酸那裏痛,甚至還出現了一些慢性的小毛病,好像身體裏總有一團散不去的“火”?
也許,有種衰老叫做“炎症衰老”,它不像感冒發燒那樣來勢洶洶,而是用持久的、日積月累的損傷,悄悄消耗着我們的健康儲備,悄悄使我們衰老。那麼,在這場炎症與身體的持久戰中,到底是誰在不斷添柴、加火?
最近,發表在《Nature Aging》上的一篇研究[1],就為我們揪出了一個慢性炎症衰老的重要幕後黑手——免疫系統中“黑化”的特殊T細胞!它們本來是幫助對抗炎症的“好好細胞”,但在衰老的催化下,它們也可能會變成慢性炎症的“不定時炸彈”,在體內累積!


免疫“好好細胞”也難逃衰老
我們的身體有千千萬萬個細胞組成,而每一個細胞都有潛在的“不穩定性”,例如偏離正常的“軌道”,走向衰老、病變甚至癌變的道路。
在年輕時,那些“誤入歧途”的體細胞的衰變尚能被我們強大的免疫細胞及時發現並清理門户。但隨着年齡增加,就連守護我們健康的免疫細胞,也難逃衰老的魔爪,成為了慢性炎症的重要“幫兇”!
比如,在我們的免疫細胞大軍中,有一類特殊的T細胞,叫做調節性T細胞(Regulatory T cells),簡稱Treg細胞。顧名思義,它們的主要職責就是“調節”和“抑制”過度的免疫反應,防止免疫系統反應過度而傷及自身,時刻維持着體內的免疫平衡。

圖注:在動漫《工作細胞》中,Treg細胞的形象為輔助性T細胞的“秘書”,幫助抑制失控的T細胞
一般,它們會通過分泌抑制性細胞因子、直接接觸抑制其他免疫細胞等多種方式減輕不必要的免疫反應和炎症。然而,再精密的系統也難逃衰老摧殘,這些本應“抗炎”的Treg細胞,在衰老的影響下,會不會也悄悄改變,甚至反過來推動了炎症衰老呢?
首先,研究者用了單細胞RNA測序技術,“讀取”了細胞內部的RNA信息,從而瞭解細胞的“工作狀態”,例如正在生產什麼蛋白,或是否在對抗病菌等等。
通過對比年輕小鼠和年老小鼠脾臟中的CD4+ T細胞,他們發現,在年老小鼠體內,有幾種T細胞正在隨着年齡增長而慢慢積累。果然,其中就有一些特殊Treg細胞表現出了活化異常!
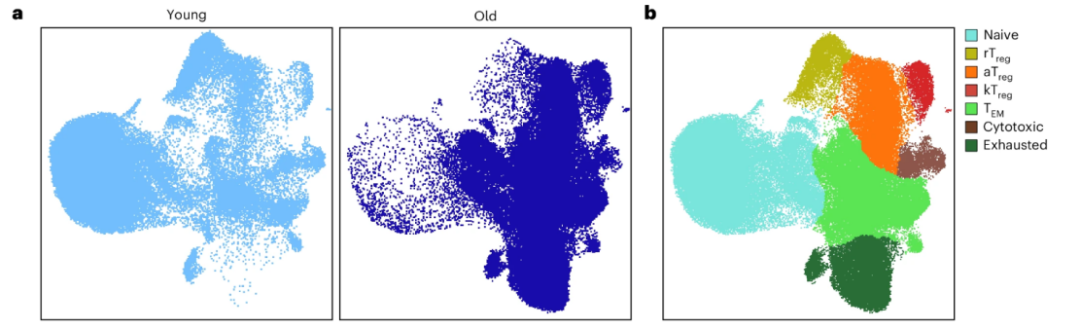
圖注:年輕小鼠(左)和老年小鼠(右)的脾CD4 T細胞和不同簇的分佈
那麼,這撮異常的Treg細胞究竟是什麼?又有什麼特徵呢?基於上面的“線索”,為了更直觀、更深入地瞭解這些細胞的變化,研究者使用了一套能夠識別細胞表面特徵的檢測方法——流式細胞術進一步觀察。
簡單來講,這項技術能給細胞的不同特徵貼上各種不同的“標籤”,通過識別這些標籤的組合,就能準確地將不同類型的細胞羣體區分開來。
在眾多標籤之中,研究者注意到了KLRG1,它是T細胞表面的受體之一,也是細胞分化成熟和免疫衰老的標誌物。研究者發現,一些表面帶有KLRG1的Treg細胞在體內隨着衰老而發生了累積:
首先,不論是老年小鼠還是人,外周血中表達KLRG1的Treg細胞(簡稱為kTreg細胞)比例明顯比年輕時更多。此外,這些kTreg細胞在年老小鼠的脾臟、骨髓、肝臟、腸道的免疫組織等多組織中均有積累,尤其是在腸道黏膜的關鍵部分。
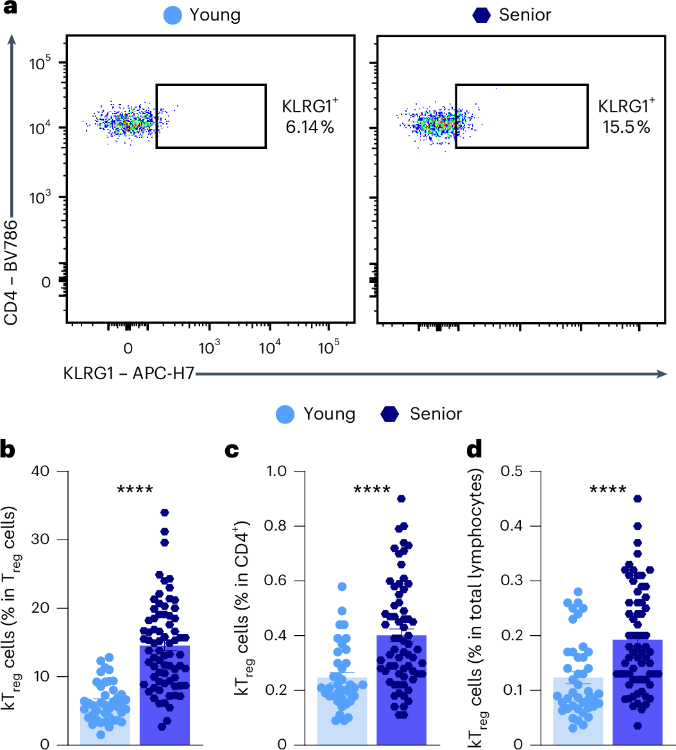
圖注:在衰老過程中,人血液中的KLRG1+ Treg細胞增加
不僅如此,研究者還發現,它們不僅自身會衰老、會堆積,還並非“善類”,像無數“不定時炸彈”一般誘發體內的慢性炎症,從而加速衰老!
那麼,這些kTreg細胞具體究竟有哪些特徵呢?

衰老的“罪證”
自身線粒體嚴重受損
研究人員使用了兩種特殊的熒光標籤來指示線粒體的活躍度,結果,在年老小鼠的CD4+ T細胞中,有相當一部分細胞的熒光強度降低,這代表它們的線粒體質量減少,活性也明顯下降。
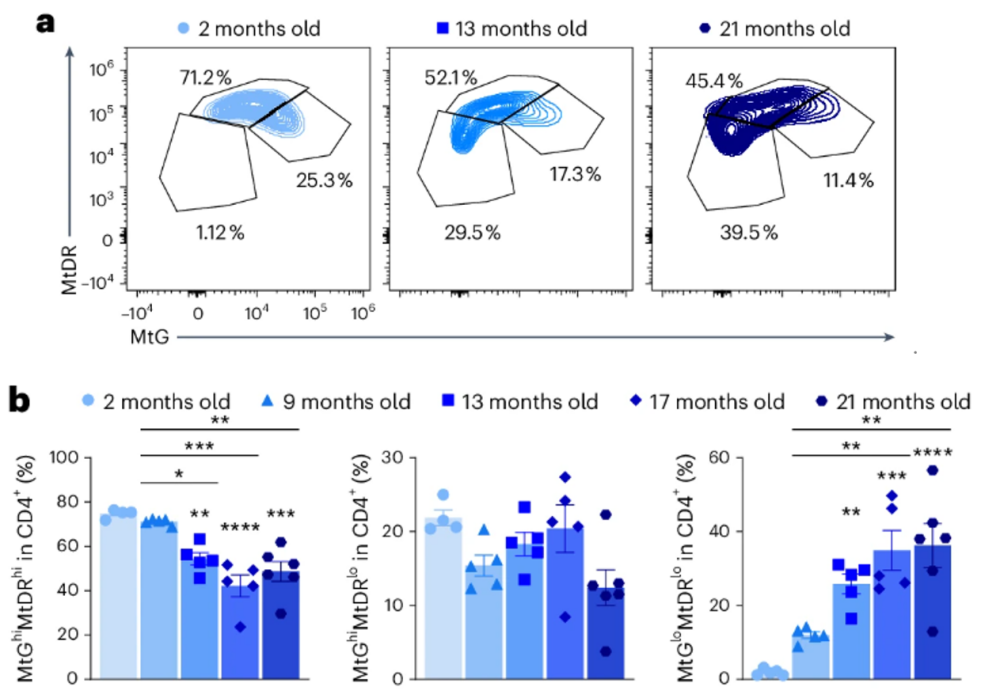
圖注:CD4+ T細胞中細胞比例隨年齡增加的流式圖和定量圖
而這些細胞的線粒體功能障礙非常突出。研究者通過電子顯微鏡看到,這些包含了kTreg細胞在內的細胞的線粒體形態變得又小又圓,內部重要的嵴結構也變得模糊甚至消失了,也就是説,它們的線粒體能量供應可能已經幾近崩塌。
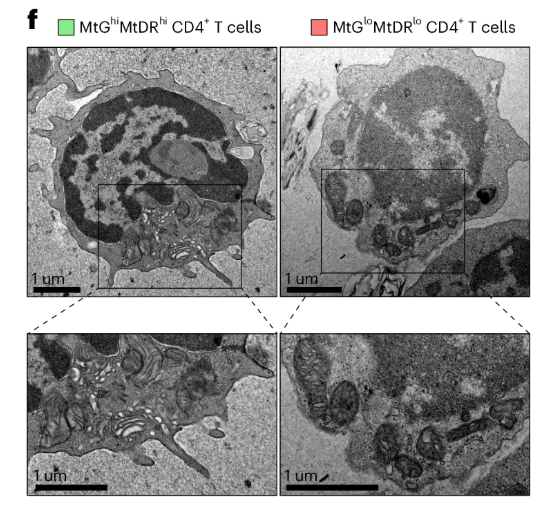
圖注:展示CD4+ T細胞的電子顯微鏡照片對比
而進一步的分析發現,在所有CD4+ T細胞亞羣中,kTreg細胞恰恰就是表現出這種線粒體質量低、活性低特徵的比例最高的羣體之一!而這導致的可不僅僅是細胞活力減弱那麼簡單,還可能造成細胞內部的代謝紊亂和氧化應激加劇等更多危害。
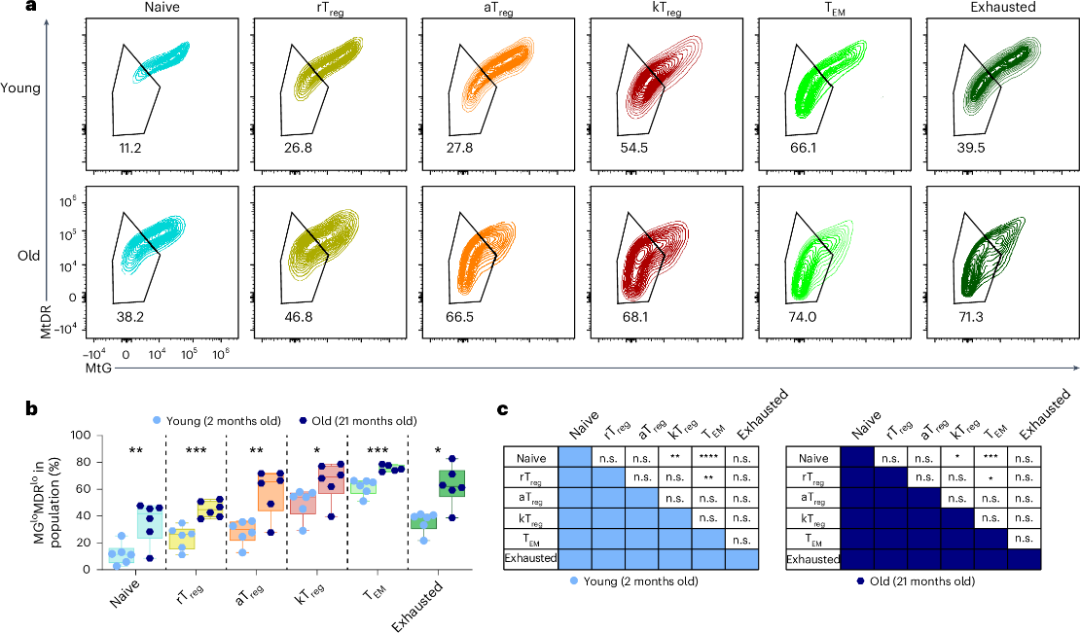
圖注:不同CD4+ T細胞亞羣中kTreg細胞的比例較高
多種衰老標誌物高表達
而除了線粒體的問題,kTreg細胞還表現出了明顯的細胞週期停滯、功能異常等細胞衰老特徵。在多種T細胞中,kTreg細胞的細胞週期調節蛋白P16和P21(過度表達會導致細胞停止分裂)的水平當屬最高。
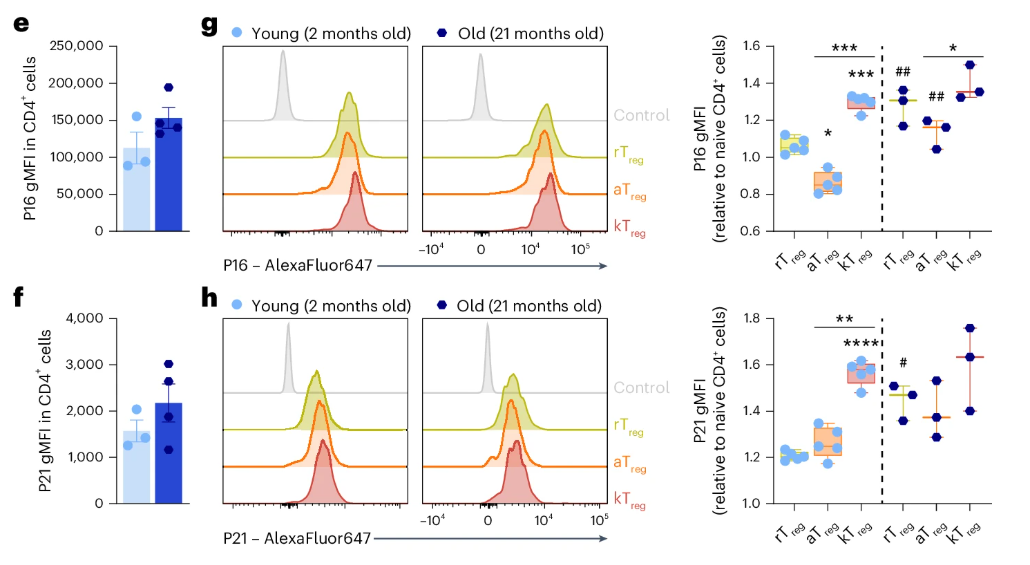
圖注:不同Treg亞羣中的P16和P21蛋白表達
同時,細胞衰老的另一個標誌、DNA斷裂的信號γH2AX也大量出現,説明DNA也出現了嚴重的損傷。
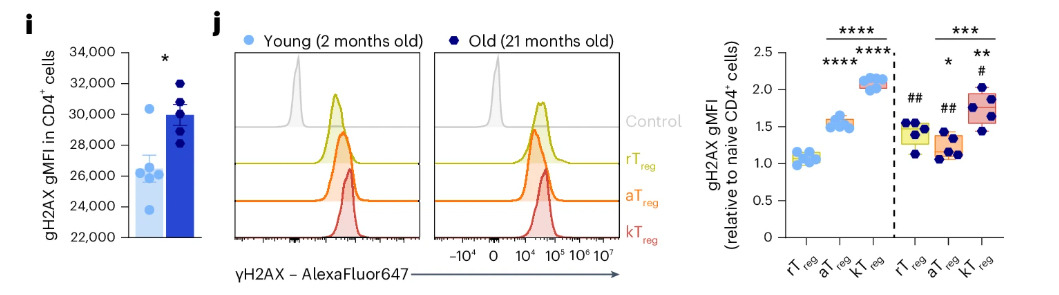
圖注:不同Treg亞羣中的γH2AX水平
抑制功能下降,促炎因子飆升
而作為Treg細胞,它們抑制免疫反應的核心功能也遭到了衰老的“制裁”。
雖然在細胞上表現尚可,但在更接近真實情況的動物體內實驗中,kTreg細胞的“抗炎效果”卻大打折扣:當研究者把kTreg細胞與效應T細胞一起注入缺乏免疫力的小鼠體內時,kTreg細胞並沒有有效組織效應T細胞誘發的炎症和體重的降低。
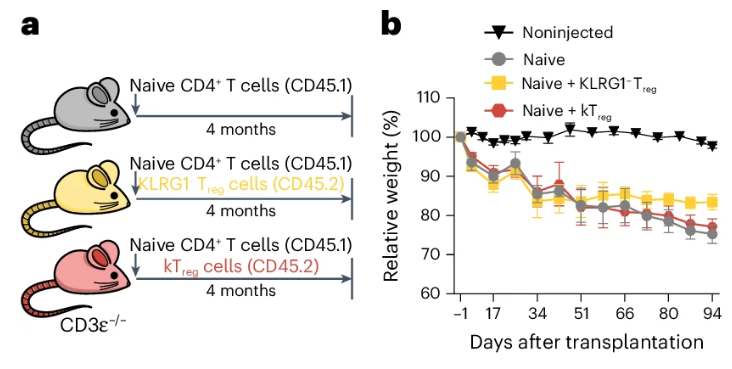
圖注:小鼠體重變化
更慘的是,這些kTreg細胞不僅抗炎不力,還會給慢性炎症“煽風點火”。研究者發現,衰老、堆積的kTreg細胞還會分泌如IL-1β、IL-6、IL-13、IFN-γ、GM-CSF、CXCL2等促炎、促衰的“衰老相關分泌表型(SASP)”細胞因子,從而進一步推動炎症衰老。
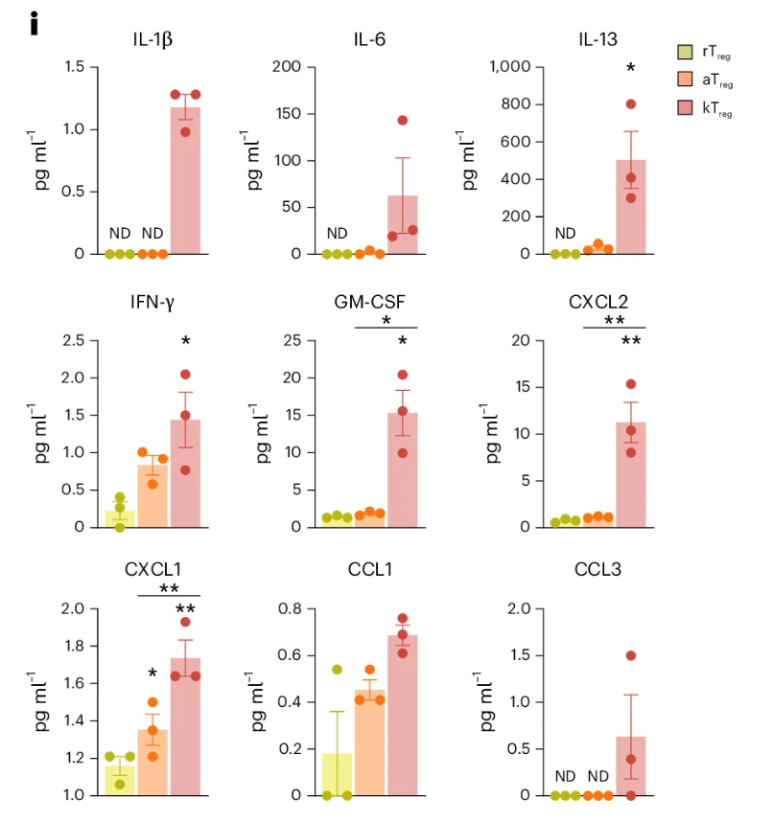
圖注:不同Treg亞羣分泌的SASP相關細胞因子水平
特徵已經明瞭了,但這些kTreg細胞究竟又是如何在衰老過程中大量產生的呢?研究人員順藤摸瓜,發現了一條重要的信號通路——IL-33/ST2通路。

揪出幕後“推手”
IL-33是通常在組織損傷或身體面臨壓力時釋放的一種因子,它就像是身體的“警報素”一樣,能迅速動員免疫細胞參與修復和防禦;而ST2蛋白則是細胞表面特異性接收IL-33信號的“接收器”。
而研究者通過檢測基因表達的具體變化和細胞特徵發現,這些kTreg細胞表面恰恰高表達了ST2蛋白。
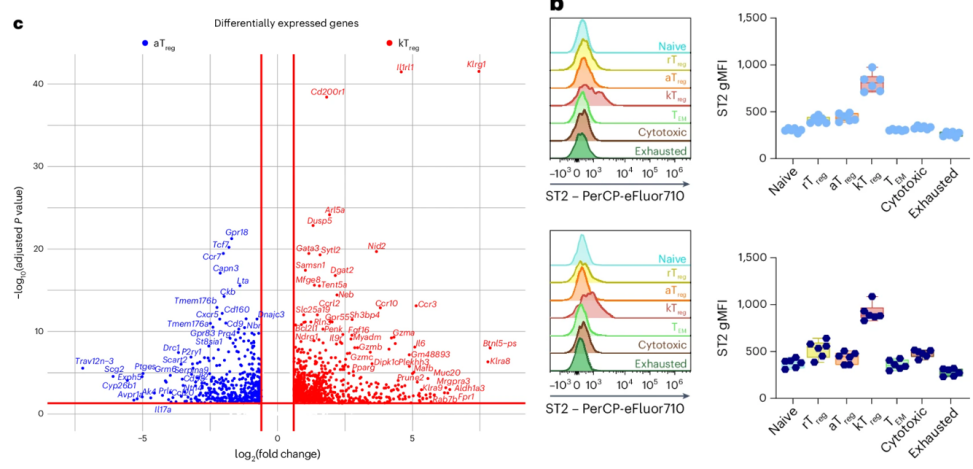
圖注:kTreg細胞RNA測序、表面的基因特徵
那麼,這是否就意味着IL-33與kTreg細胞的衰變、與慢性炎症的促衰之間其實暗藏聯繫呢?於是,研究者們給年輕小鼠注射了IL-33,結果,小鼠體內kTreg細胞的數量果然顯著增加了!
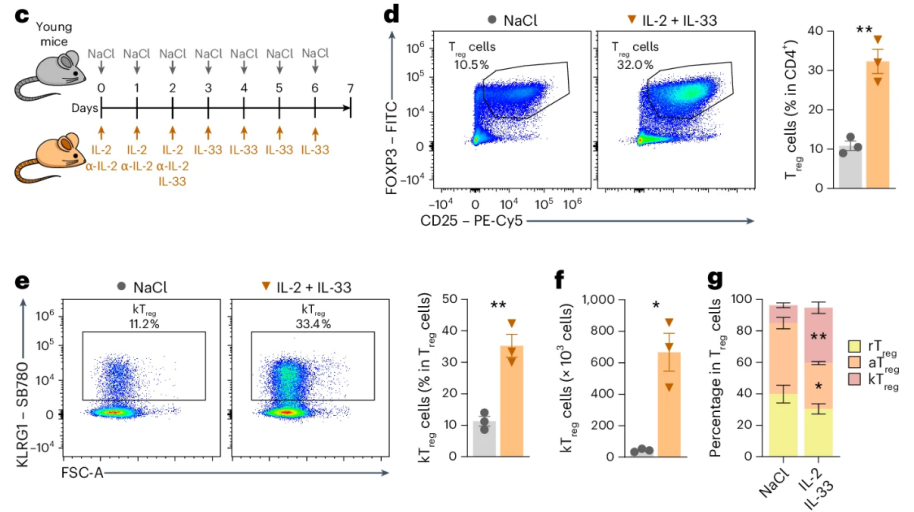
圖注:L-33可能誘導Treg細胞轉變為kTreg細胞,從而促炎
不僅如此,研究者進一步分析這些被IL-33“催生”出的kTreg細胞,發現它們也表現出了與年老小鼠體內自然積累的kTreg 細胞相似的促炎、促衰特徵,例如高表達了ST2相關的因子GATA3。
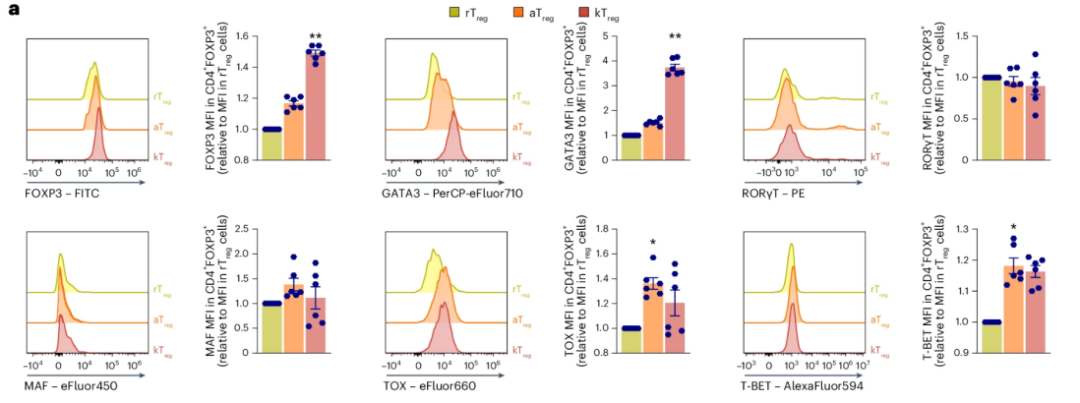
圖注:kTreg細胞中不同轉錄因子表達、ST2表達
綜上所述,就這樣,隨着年齡的增加、身體的衰老,IL-33的水平在某些組織中逐漸升高,而當這些損傷和應激信號增多,就可能會持續催化更多普通的Treg細胞轉變為異常的kTreg細胞,最終形成了一種“惡性循環”,不斷地推動着慢性炎症和衰老……
所以,原本在我們體內負責捍衞免疫“和平”的Treg細胞在這機制之下逐漸“黑化”、累積,淪為了慢性炎症的“衰老幫兇”。
在未來,如果我們能夠找到有效的方法來阻止kTreg細胞的這種“黑化”,或者想辦法清除它們,説不定就有可能從源頭上減輕慢性炎症對我們的損傷。
也許,“根治”慢性炎症,真的能做到呢?
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Soto-Heredero, G., Gabandé-Rodríguez, E., Carrasco, E., Escrig-Larena, J. I., Gómez de las Heras, M. M., Delgado-Pulido, S., . . . Mittelbrunn, M. (2025). KLRG1 identifies regulatory T cells with mitochondrial alterations that accumulate with aging. Nature Aging. doi:10.1038/s43587-025-00855-9