多吃蛋黃?吃蛋黃激活體內天然產物,軟化血管、清除衰老細胞,5天搞定!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯10分钟前

扎過頭髮的友友們或許都有過這樣的糟心事:一個常用的髮圈,剛開始Q彈給力,用着用着就鬆鬆垮垮,最後“啪”的一聲,在你最需要它的時候原地“去世”,留下一頭凌亂的秀髮與一臉的無奈。
先別光顧着心疼髮圈!因為更扎心的是:同樣的劇情也正在你的血管中上演(bushi),沒錯,隨着衰老,它們也會像用舊的髮圈一樣,越來越沒彈性,越來越脆,越來越硬,直到……
不過,先別急着為我們的血管默哀!近期,科學家們發現了一種天然存在於我們體內的物質,它或許能成為清除這些衰老細胞、讓血管恢復年輕態的秘方!


血管健康的隱形殺手
與橡皮筋老化一個道理,我們的血管也會隨着衰老,發生結構與功能的退化,雖然血管衰老本身可能你沒有直接的感覺。但是!別小看它!它埋下的雷可不小,一旦沾上高血壓、冠心病這些麻煩,那你的生活質量……可能就得大打折扣了。
再來説説血管老化的核心表現?這主要包括了彈性纖維斷裂與膠原沉積(血管彈性下降)[2]、一氧化氮(NO)生物利用度降低(血管舒張能力受損)[3]以及促炎因子(TNF-α、IL-6等)的持續激活(不斷驅動血管損傷)[4],形成炎症—衰老的死循環,讓你越老越炎,越炎越老。
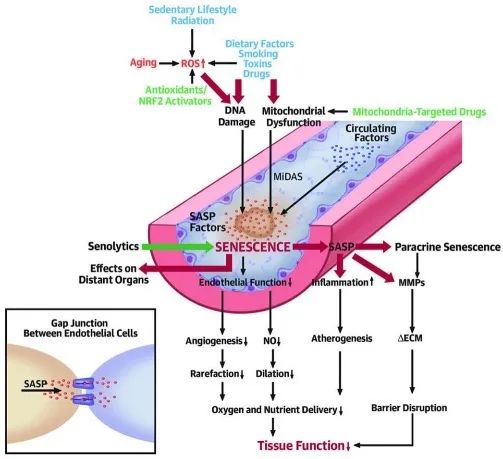
圖注:ROS、DNA損傷、毒素等因素共同誘導血管細胞衰老,通過SASP放大炎症與組織損傷[5]
血管壁的彈性纖維越來越少,硬邦邦的膠原蛋白越堆越多越多,這該怎麼恢復?來自科羅拉多大學的科學家們提供了一個反直覺的答案:吃點膽固醇!


大顯神通的25HC
平時躲膽固醇還來不及,這要是再補……膠原沉積和彈性纖維降解豈不是更嚴重[6]?不過,此“膽固醇”非彼膽固醇——25-HC!(25-羥基膽固醇),它是一種膽固醇的天然代謝產物。
25-HC是膽固醇在第25位碳原子上多了個羥基(—OH)[7]。它廣泛分佈於人體的血漿、肝臟、肺、腦組織及免疫細胞(如巨噬細胞)中,兼具脂質代謝、免疫調節和抗病毒防禦三重功能。
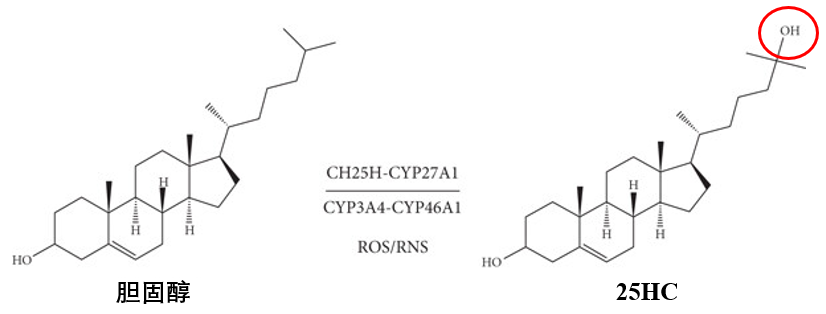
圖注:正常生理狀態下,血漿濃度約為ng/mL級,但在炎症或感染時明顯升高
而在給衰老小鼠補充了 25-HC 之後,僅僅過了5天,奇蹟便已發生:
軟化血管
最明顯的改變:血管軟化,25-HC處理的小鼠,其主動脈脈搏波速度(PWV,數值越高血管越硬)遠低於對照組,表明血管整體僵硬度得到改善。
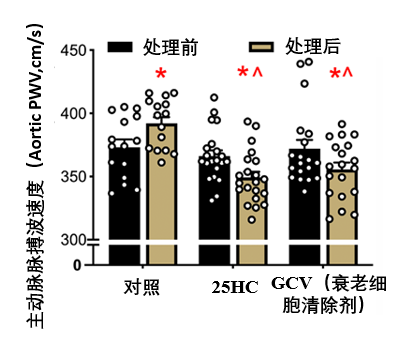
圖注:25HC在在降低血管僵硬度的效果堪比直接清除衰老細胞(效果與衰老細胞清除劑GCV相當)
改善血管壁彈性
好消息接踵而至:25-HC處理還提升了血管壁本身的彈性,無論是體外(取出主動脈環)還是體內,經由25-HC處理,其主動脈彈性模量(該值越低,血管壁的固有柔韌性越好)相比對照小鼠,下降約30%(體內為37.5%)。
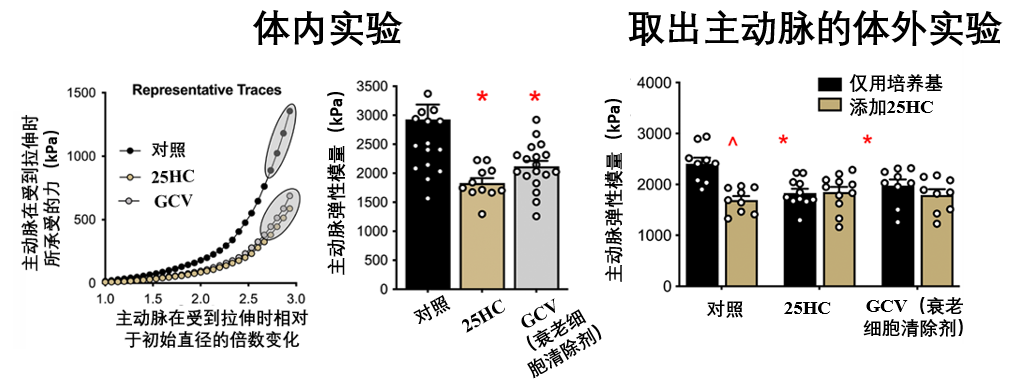
圖注:25HC可以降低衰老小鼠主動脈的內在機械硬度(越低柔韌性越好)
此外,一個有趣的現象是:對於已經接受過體內25-HC、GCV處理的小鼠主動脈,到體外再用25-HC處理,其彈性模量並沒有進一步降低……或許體內的給藥效果可能已經達到了對血管固有彈性改善的限度,使得體外的額外直接作用空間變小。
血管結構年輕化
最後則是血管的微觀結構的變化:相比對照,25-HC組主動脈中的膠原蛋白-1(Collagen-1,血管衰老過程中,這種僵硬的膠原蛋白會異常增多,取代原有的彈性纖維,成為血管硬化的主因)含量降低了約42%,從根源上改善了血管彈性。
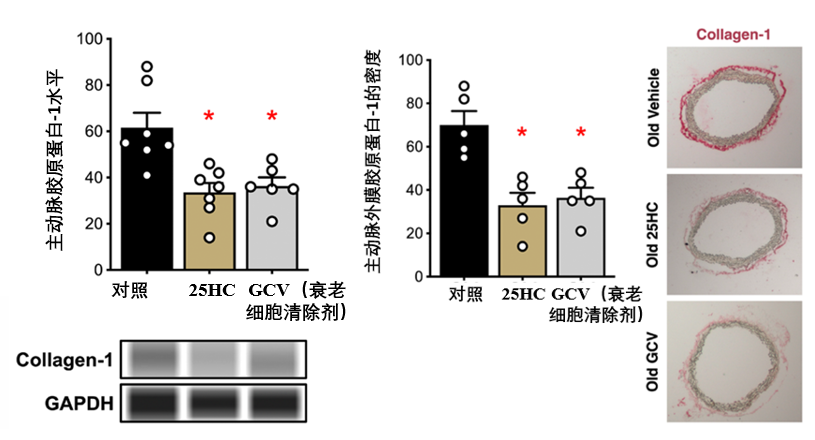
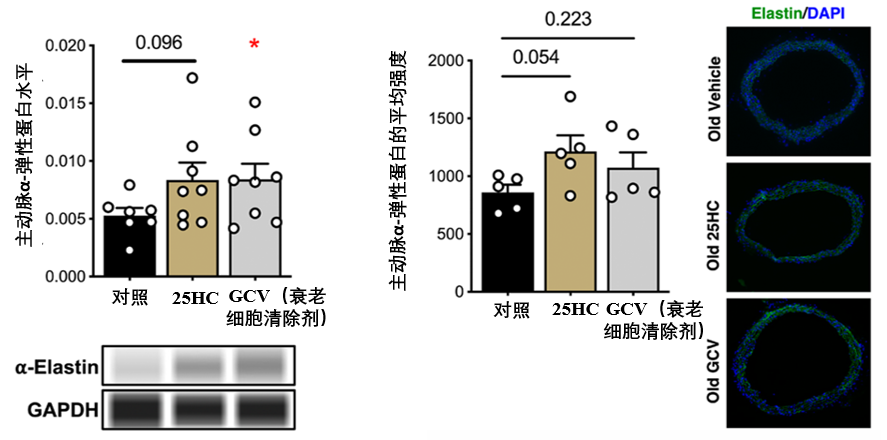
還有賦予血管彈性的關鍵蛋白——α-彈性蛋白,其含量不降反升,增加了約 59%****(該蛋白的減少與衰老相關)。免疫熒光染色(圖中綠色部分代表α-彈性蛋白)顯示,25-HC處理組的α-彈性蛋白熒光強度增強約41%,表明彈性纖維含量的恢復。
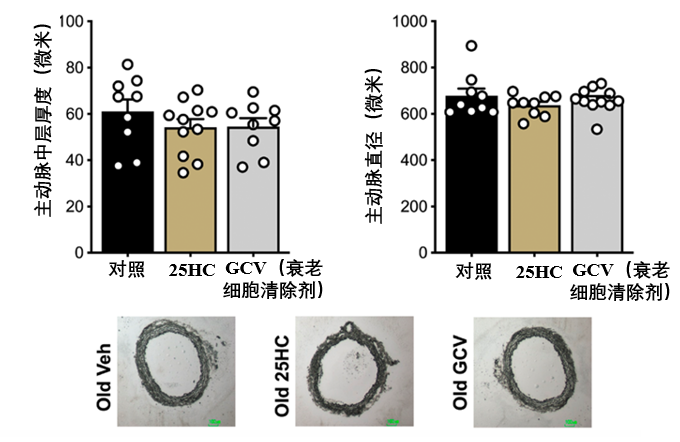
尤其值得強調是,25-HC帶來的這些有益改變,並非通過改變血管壁的整體厚度,或者血管管腔尺寸來實現,説明25-HC主要作用於改善血管壁的組分質量和力學特性,而不是簡單的結構尺寸變化。
再説回抗衰這事,既然25-HC能和清除衰老細胞的GCV一樣改善血管功能,那……這就讓人忍不住琢磨了:難道它的作用機制,也是通過清除衰老細胞這條路子,來發揮抗衰效果的?

靶向清除秘籍是?
對於之前提出的疑問——25-HC 的作用機制是否與清除衰老細胞相關,科學家們給出了一個明確的答案:是的!通過分析衰老小鼠主動脈中的分子變化,他們發現了25-HC修復衰老血管三大機制:

減少衰老標誌物水平
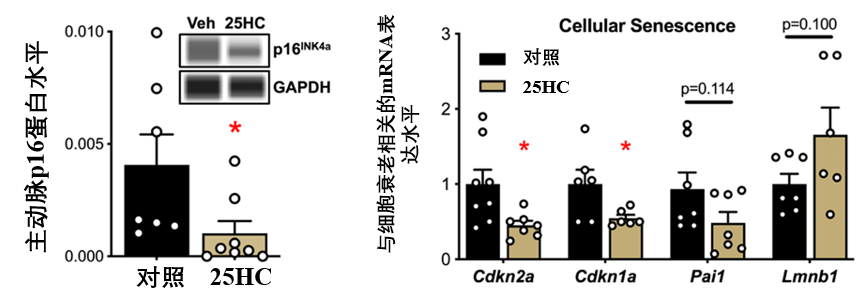
首先,25-HC能減少血管中衰老細胞的關鍵標誌物——p16INK4a蛋白的水平(約75%)。還沒完,再來個“一箭多雕”:多個與細胞衰老相關基因(Cdkn2a、Cdkn1a、Pai1)的表達水平降低以及Lmnb1的上調(其表達下調通常與衰老相關)。
清除衰老細胞的保護膜
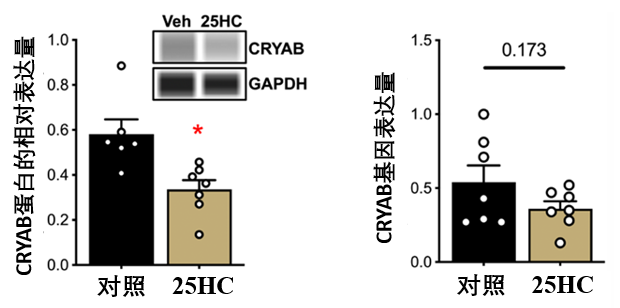
其二,順藤摸瓜,科學家們鎖定了25-HC的一個關鍵作用靶點:αB-晶狀體蛋白(CRYAB)。這是一種熱休克蛋白,通常在衰老細胞中上調並聚集,它能通過激活衰老細胞抗凋亡通路(SCAP),保護衰老細胞,讓它們賴着不“死”。
實驗結果有力地證實了 25-HC 對該靶點的抑制作用: 經由25-HC處理,老年小鼠主動脈中的CRYAB基因表達量與蛋白丰度相比對照均出現降低,分別降低了33%和38%。
重啓衰老細胞的自毀程序
而當CRYAB被25-HC有效抑制後,原先被CRYAB等因素抑制的細胞凋亡通路就得以重新激活(p53、Casp3、Bax、Parp1、Cycs等),使得衰老血管細胞失去抗凋亡的保護,從而走向自我毀滅。
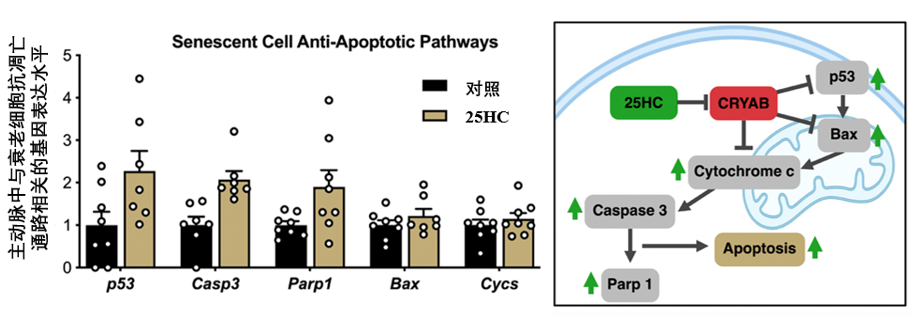
圖注:25-HC抑制CRYAB,使Bax等蛋白釋放細胞色素c,進而激活Caspase 3和Parp 1介導細胞凋亡
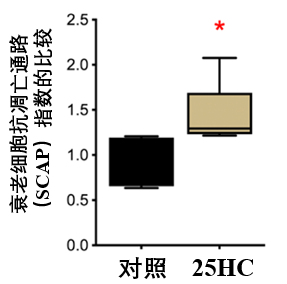
為了更全面地評估這一效應,研究人員計算了一個綜合的SCAP指數,為了方便理解,我們也可以把它叫做“衰老細胞凋亡傾向指數”,該指數越高,代表細胞越傾向於啓動自我清除程序。
結果則是,25-HC組的SCAP指數明顯高於對照組,説明25-HC通過抑制抗凋亡因子CRYAB,調控衰老細胞內的抗凋亡/促凋亡信號之間的平衡,最終達到清除衰老細胞、改善血管健康的目的。

如何補充25-HC?
有關 25-HC 的探索到此暫告一段落。那麼,在我們日常生活中該如何提升25-HC的水平呢?這裏派派為大家梳理了兩條可能的補充途徑:高膽固醇飲食(劃掉)[8]和維生素D[9]。
先説高膽固醇飲食,有研究表明[9],食用富含膽固醇的食物後,25-HC 的合成會迅速增加[9]。但事實上來説,這絕非一個值得推薦的補充 25-HC 的方法(畢竟這個研究的初衷還為了改善動脈硬化,而不是換一種方式得動脈硬化)……那就試試第二條路,維生素D。

話説回來……吃點蛋黃倒也是個不錯的選擇
同樣是該研究發現[9],在維生素 D 缺乏症的患者中,通過飲食補充維生素 D(每週 50,000 IU,持續八週)並結合光療後,他們的血漿中 25-HC 的濃度出現增加(這個方向看起來不錯!)。
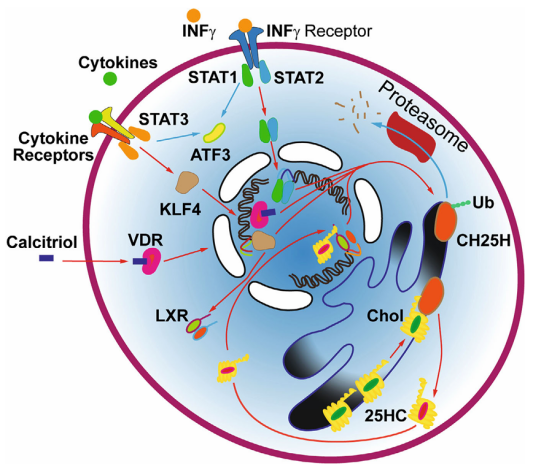
圖注:刺激維生素 D 受體 (VDRs) 可以激活 CH25H(是細胞內產生25-HC的主要酶)的表達
未來,我們或許能通過類似25-HC這樣的天然產物,真正實現血管的逆生長,讓我們遠離心血管疾病的困擾,享受更健康的晚年生活!
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Mahoney, S. A., Darrah, M. A., Venkatasubramanian, R., Ciotlos, S., Rossman, M. J., Campisi, J., Seals, D. R., Melov, S., & Clayton, Z. S. (2025). Late Life Supplementation of 25-Hydroxycholesterol Reduces Aortic Stiffness and Cellular Senescence in Mice. Aging cell, e70118. Advance online publication. https://doi.org/10.1111/acel.70118
[2] Liu, Y., Weng, W., Gao, R., & Liu, Y. (2019). New Insights for Cellular and Molecular Mechanisms of Aging and Aging-Related Diseases: Herbal Medicine as Potential Therapeutic Approach. Oxidative medicine and cellular longevity, 2019, 4598167. https://doi.org/10.1155/2019/4598167
[3] Pacinella, G., Ciaccio, A. M., & Tuttolomondo, A. (2022). Endothelial Dysfunction and Chronic Inflammation: The Cornerstones of Vascular Alterations in Age-Related Diseases. International journal of molecular sciences, 23(24), 15722. https://doi.org/10.3390/ijms232415722
[4] Izzo, C., Carrizzo, A., Alfano, A., Virtuoso, N., Capunzo, M., Calabrese, M., De Simone, E., Sciarretta, S., Frati, G., Oliveti, M., Damato, A., Ambrosio, M., De Caro, F., Remondelli, P., & Vecchione, C. (2018). The Impact of Aging on Cardio and Cerebrovascular Diseases. International journal of molecular sciences, 19(2), 481. https://doi.org/10.3390/ijms19020481
[5] Ungvari, Z., Tarantini, S., Sorond, F., Merkely, B., & Csiszar, A. (2020). Mechanisms of Vascular Aging, A Geroscience Perspective: JACC Focus Seminar. Journal of the American College of Cardiology, 75(8), 931–941. https://doi.org/10.1016/j.jacc.2019.11.061
[6] Kılıç, A., Baydar, O., Elçik, D., Apaydın, Z., & Can, M. M. (2021). Role of dyslipidemia in early vascular aging syndrome. Turkish journal of medical sciences, 51(2), 727–734. https://doi.org/10.3906/sag-2008-165
[7] Cao, Q., Liu, Z., Xiong, Y., Zhong, Z., & Ye, Q. (2020). Multiple Roles of 25-Hydroxycholesterol in Lipid Metabolism, Antivirus Process, Inflammatory Response, and Cell Survival. Oxidative medicine and cellular longevity, 2020, 8893305. https://doi.org/10.1155/2020/8893305
[8] Griffiths, W. J., & Wang, Y. (2021). Sterols, Oxysterols, and Accessible Cholesterol: Signalling for Homeostasis, in Immunity and During Development. Frontiers in physiology, 12, 723224. https://doi.org/10.3389/fphys.2021.723224
[9] Odnoshivkina, U. G., Kuznetsova, E. A., & Petrov, A. M. (2022). 25-Hydroxycholesterol as a Signaling Molecule of the Nervous System. Biochemistry. Biokhimiia, 87(6), 524–537. https://doi.org/10.1134/S0006297922060049