當“救命藥”變“天價難尋”:是偶然爆雷,還是行業必然之痛?_風聞
中访网-中访网官方账号-优质商业信息大数据平台1小时前
來源|中訪網
責編|朱怡然
2025年6月,一則消息如巨石投入平靜湖面,在醫藥領域激起千層浪——用於治療阿爾茨海默病的甘露特鈉膠囊(商品名“九期一”)停產了。綠谷醫藥科技被曝出將關閉相關辦公區、生產區,這一消息迅速成為輿論焦點,引發無數患者、家屬以及業內人士的密切關注。
斷貨潮起,停產塵埃落定
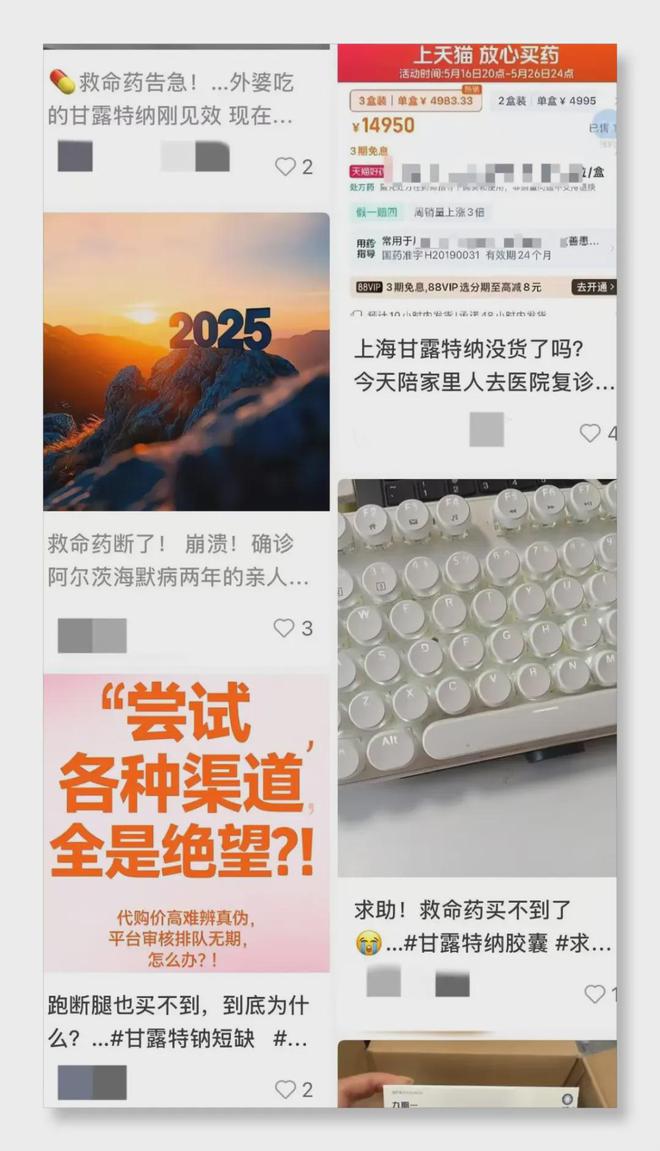
事情並非毫無預兆,早在5月,甘露特鈉膠囊就出現了斷貨現象。家住廣州的陳女士,母親在今年1月被診斷為阿爾茨海默病早期,開始服用此藥。然而5月初複診時,醫院告知沒藥了,附近的醫院和藥店也均無貨。這種情況並非個例,北京、上海、天津等多地網友在社交平台紛紛求助,稱跑遍各處都買不到一盒藥。
隨着斷貨情況愈發嚴重,甘露特鈉膠囊的市場價格也一路飆升。據華夏時報報道,近幾個月來,其價格累計上漲約40%,電商平台上部分藥房甚至標出高達5000元/盒的“天價” 。在美團、天貓、京東等平台,普遍售價漲至428元/盒 - 534.5元/盒,患者下單後還常因“無貨”或“藥方審核不通過”被商家退款,退款後價格還會繼續上調。
面對洶湧的輿論和患者的急切需求,綠谷方面起初表示正與有關部門密切溝通,竭盡全力處理供貨問題,可不到兩週,停產的消息就被證實。5月30日,綠谷發佈內部通知,宣佈甘露特鈉膠囊產品線相關崗位停工停產,原因是藥品註冊證到期,正在等待藥監局審批結果。

爭議纏身的研發之路
甘露特鈉膠囊的誕生,本被寄予厚望。2019年11月2日,它在中國獲附條件批准上市,成為2003年以來全球首個被批准的阿爾茨海默病新藥,填補了該領域多年的空白,給無數患者和家屬帶來了希望的曙光。其研發歷程長達22年,由中國海洋大學、中科院上海藥物研究所、上海綠谷製藥有限公司聯合研發,凝聚了眾多科研人員的心血。
但從上市之日起,甘露特鈉膠囊就深陷爭議的泥沼。首先是獲批時的“有條件批准”,藥監局要求申請人繼續進行藥理機制方面的研究和長期安全性有效性研究,完善寡糖的分析方法,按時提交有關試驗數據。這無疑給藥品的安全性和有效性打上了問號。雖藥物主要發明人耿美玉解釋稱,是因大鼠長期(104周)致癌毒性實驗資料未及時提交,但這並未完全打消外界疑慮。
其三期臨牀試驗僅持續36周(約9個月),對於治療慢性退行性疾病阿爾茨海默病而言,這樣的試驗週期相對較短,通常需要12 - 18個月甚至更長期的觀察,才能確認藥物對認知功能的持續改善效果。
原首都醫科大學校長饒毅也曾多次發文,質疑相關研究真實性和藥物有效性,直指GV - 971研發造假,這一質疑將甘露特鈉膠囊推向了輿論的風口浪尖。耿美玉提起名譽侵權訴訟,卻以敗訴告終,法院認為應當允許正當的學術爭論和批評,這也從側面反映出該藥物面臨的爭議之激烈。
國際新藥衝擊下的困境
在甘露特鈉膠囊陷入停產風波之時,不能忽視的是全球阿爾茨海默病藥物研發的大環境。自2024年初,我國接連批准了兩款AD靶向新藥上市,分別是衞材的侖卡奈單抗和禮來的多奈單抗,它們在多個國家和地區都已獲得批准,用於治療由AD引起的輕度認知功能障礙和AD輕度痴呆。
這兩款國際新藥的出現,給國內阿爾茨海默病藥物市場帶來了巨大沖擊。它們憑藉先進的研發技術和大量的臨牀數據,在國際市場上佔據了一席之地。相比之下,甘露特鈉膠囊在療效、臨牀試驗設計等方面的爭議,使其在競爭中處於劣勢。
對於患者和家屬來説,他們急需有效的治療藥物,在甘露特鈉膠囊斷貨停產的情況下,或許會將目光轉向這些國際新藥。這不僅是患者的無奈選擇,也反映出國內創新藥在面對國際競爭時的壓力。
國產創新藥未來在何方?
甘露特鈉膠囊的停產,猶如一記警鐘,敲響了國產創新藥發展過程中面臨的種種問題。在追求創新的道路上,如何平衡研發速度與質量?怎樣才能獲得更紮實的臨牀證據,讓創新藥經得起市場和學術的雙重檢驗?這些都是亟待解決的問題。
一方面,藥企需要加大研發投入,提高科研水平,注重藥物研發的每一個環節,從作用機制研究到臨牀試驗設計,都要做到嚴謹科學。不能為了追求上市速度而忽視了藥物的安全性和有效性。
另一方面,監管部門也應發揮重要作用,嚴格把控藥品審批關卡,在鼓勵創新的同時,確保上市藥品的質量。對於有爭議的藥品,要加強監管和後續跟蹤,督促藥企完善研究。
從更宏觀的角度看,國產創新藥的發展離不開良好的科研環境和政策支持。只有多方共同努力,才能讓國產創新藥在國際舞台上站穩腳跟,真正為患者帶來福音,而不是像甘露特鈉膠囊一樣,在爭議和困境中黯然停產。