人類夢想的超能力!4釐米小魚暗藏“不死之心”_風聞
剑啸易水寒-深知身在情长在,前尘不共彩云飞。47分钟前
來源:中國科學報
文 |《中國科學報》記者 廖洋 通訊員 張慧
在中國海洋大學海洋生物多樣性與進化研究所的實驗室,一羣藍銀相間的熱帶淡水魚正在透明的實驗水箱中游弋。這羣看似十分普通、身形纖細、最長不過4釐米的觀賞魚,就是中國海洋大學教授蘇穎和趙龍團隊長期研究的核心對象——斑馬魚。
人的心肌細胞一旦受損或缺失,便難以補充、修復。可神奇的是,斑馬魚卻擁有一個可再生的心臟。
“它們的心臟在損傷後,可通過一系列細胞生物學事件生成新的心肌細胞及其他類型的心臟細胞,實現結構和功能的完全恢復。”趙龍告訴《中國科學報》,“解析再生過程的細胞動態與分子調控網絡,被視為破解心臟再生醫學難題的關鍵突破口。”
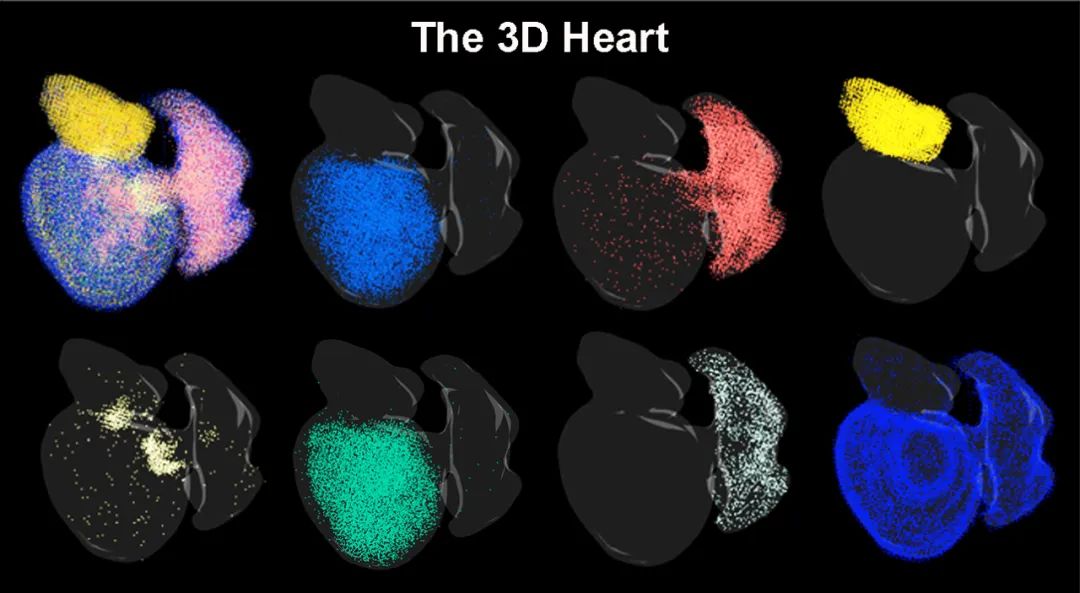
斑馬魚的3D心臟影像。
為揭開心臟再生的奧秘,中國海洋大學團隊聯合青島華大基因研究院潛心繪製了斑馬魚心臟再生單細胞與時空轉錄組圖譜,開創性揭示了心臟再生的分子機制,被國際同行評價為“再生醫學領域的重要突破”。近日,相關研究成果發表於《自然-通訊》,並被選為重點推薦文章,編入《臨牀與轉化研究》特刊。
斑馬魚擁有心臟再生的“超能力”
在心臟疾病研究領域,哺乳動物模型是主流。2002年,斑馬魚非凡的心臟再生能力被《科學》報道。
趙龍説:“此次的研究方向就是基於這20多年的積累,並結合近年來飛速發展的空間組學和單細胞組學技術確定的。”
蘇穎和趙龍最初接觸斑馬魚,還是20多年前在清華大學讀研究生時。“在導師孟安明院士指導下,我們當時研究斑馬魚的胚胎髮育過程,其中就包括心臟的發育。”趙龍説,後來,他出國進行博士後階段研究,轉向斑馬魚再生方向。
2016年和2019年,蘇穎和趙龍先後入職中國海洋大學海洋生物多樣性與進化研究所,帶着幾位研究生開展心臟再生研究。

蘇穎(左一)、趙龍(右一)和團隊成員合影。受訪者供圖
團隊成員或用剪刀切除斑馬魚約20%的心室部分,或用液氮局部冷凍損傷心臟(模擬人類心肌梗死),再將這些心臟受損的斑馬魚放回養殖系統正常飼養。一段時間後,他們發現,前者的心室可以重新長出,並完全恢復心臟結構和功能,後者的心臟經過更長時間,也同樣能再生並恢復如初。
這種再生能力,正是人類心臟缺失的“超能力”。
為更加透徹瞭解這種“超能力”,蘇穎和趙龍進一步明確了研究內容,即從時間尺度和空間尺度上,對斑馬魚心臟再生全過程全器官層面的細胞動態與基因表達變化進行系統刻畫。
就此,他們走上了對斑馬魚心臟再生“超能力”的探索之路。
破譯心臟再生的時空密碼
2020年左右,空間轉錄組技術得到蓬勃發展。在青島華大基因研究院的支持下,研究團隊從2021年起進行初步技術摸索,並陸續產出各個時間點的多組學數據,2023年他們正式進入集中研究階段。
“我們的研究分3步:釐清斑馬魚心臟損傷前後細胞類型及其分子特徵——刻畫這些細胞在關鍵時間點出現的變化,找出對心臟再生特別重要的細胞類型和基因,探究其功能和生物學運行機制。”蘇穎告訴《中國科學報》。
研究中,團隊藉助空間轉錄組和單細胞轉錄組這兩項“黑科技”,首次構建了斑馬魚心臟再生全過程全器官的、包含時間和空間維度的高分辨率細胞與基因表達動態圖譜。
這就像給心臟做了一個動態的“3D基因地圖”,不僅能顯示損傷修復過程中有哪些細胞和基因活躍或沉默,也能精確定位它們發生這些變化的時間和位置。
依照圖譜,結合分子、細胞實驗,研究團隊鎖定了一個名為tpm4a的關鍵基因。而這個tpm4a基因,恰巧是趙龍的博士論文研究對象,當時他已經解析了其在斑馬魚胚胎期心臟發育中的功能。
研究人員迅速聯繫孟安明,獲得了突變體品系。他們分析發現,心臟受損後,該基因的活性降低,斑馬魚的新生心肌細胞再分化功能顯著下降。
為更直觀展示心臟再生過程,研究團隊利用研究數據構建了具有時間序列的虛擬三維斑馬魚心臟,首次使斑馬魚心臟再生過程中細胞類型、基因表達的時空演變規律得到了數字化呈現。這些數據被收錄到公共平台,可供領域內研究人員隨時使用,為再生醫學研究提供了強大工具與資源支撐。
中國海洋大學團隊負責科學問題提出、整體研究方向把控、部分數據的處理及全部的實驗驗證,青島華大基因研究院團隊則高效完成了數據處理分析工作和三維心臟的構建。雙方通過資源與技術互補,合作完成了這一研究。
心臟也能“長回來”?
別看現在研究團隊取得了“再生醫學領域的重要突破”,但實驗室初創時困難重重。
當時,團隊裏幾位研究生都是剛接觸再生生物學的新人,生物信息學基礎薄弱、心臟再生領域知識匱乏……面對心臟再生領域最前沿的時空組學技術研究,他們只能硬着頭皮,一邊學習新知識,一邊嘗試分析數據、摸索研究方法。
論文作者之一、中國海洋大學博士生蘆美娜回憶説:“當時遇到最棘手的問題,是把數據分析和相關科學問題結合起來。這不僅需要掌握複雜的分析技術,還得熟悉大量相關的專業知識。”為攻克這個難關,課題組所有人都閲讀了海量的文獻,從文獻洪流中“打撈”出有用的內容。
論文作者之一、中國海洋大學博士生張雪嬌負責空間轉錄組的制樣,尤其是在構建3D心臟樣品時,需要將一個心臟通切成連續的近200個切片。為最大限度利用空轉的芯片,她需要在每一張芯片上貼6至9個心臟切片。由於切片位置不可二次調整,當時剛入學半年的張雪嬌反覆練習一個多月,最終成功實現191個心臟切片的零失誤切割,且全部精準貼在空轉的芯片上。
對於整個團隊來説,發現tpm4a在心臟再生中的功能只是開始。 通過進一步研究,他們找到了兩個可能直接關聯心臟可再生能力的關鍵基因——ifrd1和atp6ap2。這些基因的發現“為臨牀心血管疾病治療研究提供了潛在靶標”,也提示後續或許可以通過藥物等方式“激活”人類心臟中類似的修復基因,讓受損心臟實現再生。
“我們希望進一步挖掘鑑定更多潛在的功能基因和細胞類型,重點關注這些基因與細胞的功能分析與機制研究,尋找並鑑定可能的提高心臟再生能力的靶標,助力心臟再生醫學的發展。”趙龍説。
相關論文信息:
https://doi.org/10.1038/s41467-025-59070-0