聽錯、聽混、聽反=衰老徵兆?神經元衰老後,我們如何感知世界?_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

我們的皮膚細胞死了又長,身體機能得以維持,這似乎理所當然。但對於大腦——這個由幾乎不可再生的神經元組成的器官來説[1],當腦細胞隨着衰老一個接一個永久死去時,我們的感知、記憶和思考能力,為何還能在幾十年裏依舊穩定持久?
近期,來自德國的科學家們,就在Nature子刊上的一篇研究,為我們揭開了這個謎團的一角[2]:即使部分腦細胞死亡,我們的大腦也能在短短幾天內自動修復,維持功能的穩定。

為了讓大家能夠吃透本文內容,這裏先介紹兩個關鍵的前置信息:1、大腦如何處理信息;2、神經元的工作方式。
以大腦理解聲音來舉個栗子:大腦並不會為每種聲音(如狗叫或鋼琴聲)都準備一個專屬神經元,相反,大腦會通過激活神經元羣體來識別。
它們有點像音樂庫中的標籤,如高音、人聲,甚至周杰倫風格(bushi)。當你聽到一首鋼琴曲時,其實是一大羣相關的神經元(標籤)被同時激活,它們被打上中音、節奏舒緩等一系列標籤,這個獨特的標籤組合,就構成了大腦對鋼琴曲的獨特神經編碼。


怎麼樣都不會想成一種聲音吧……
核心來了,通過分析這些組合之間的相似程度,我們就能為所有聲音建立一張聲音關係圖(表徵圖),它代表了大腦對整個聲音世界的理解。比如Do音和Re音,它們因為組合相似,所以在這張圖上的位置非常接近,而鳥叫和汽車喇叭……不用説你也懂——相隔甚遠。
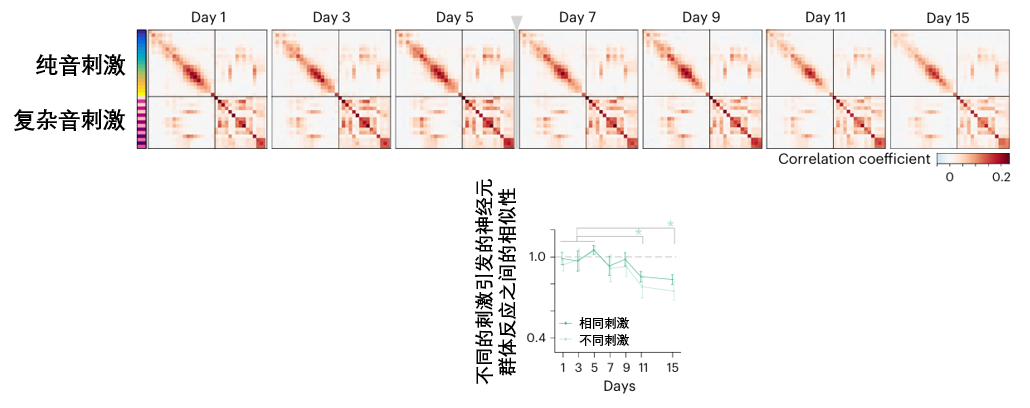
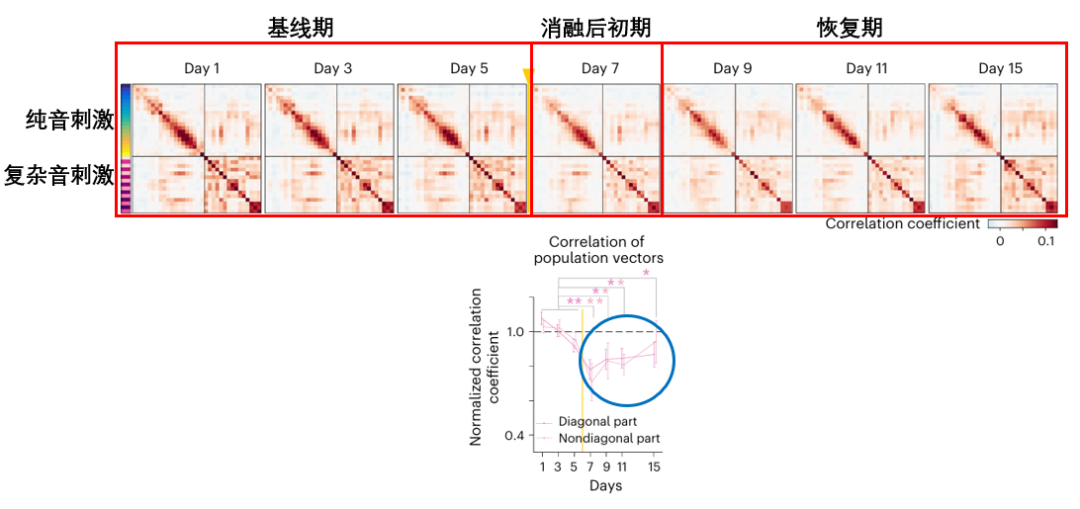
圖注:來自本研究的34種不同聲音均會激活一個特定的神經元組合,構成了小鼠聽覺皮層的聲音地圖(對角線上的方格,對應的都是同一個聲音與它自身的比較,非對角線上的每一個方格,對應的都是兩種不同的聲音之間的比較)
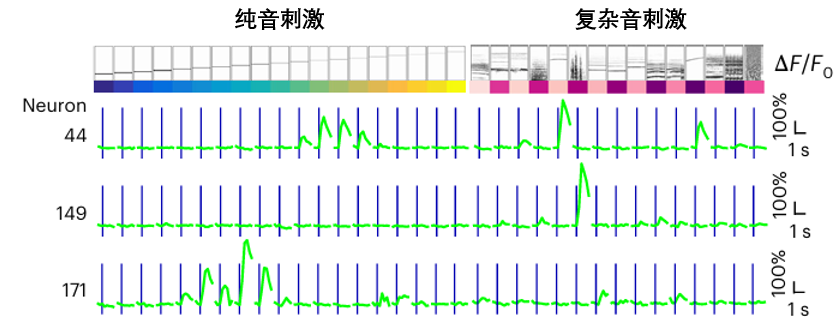
另一個關鍵概念是神經元調諧(Tuning)。雖然聽起來很專業,但其實就是説,每個神經元都有自己的口味偏好。
就像收音機要調準頻道聲音才最清晰。一個神經元可能只對1000赫茲的音高反應最強烈,對500赫茲的聲音可能置若罔聞,這個偏好的精確度,決定了其調諧曲線是專一(高而尖)還是博愛(矮而胖)。
圖注:就像收音機,只有準確調到某頻道才會發出最清晰的聲音
有趣的是,即使在大腦完全健康的狀態下,每個神經元的偏好也並非一成不變,它總是在悄悄地變化和漂移。不過儘管單個神經元如此善變,整個大腦對聲音的理解(表徵圖)卻能保持驚人的穩定。
圖注:大腦能不斷地協調神經元的變化
好了,前菜上齊,現在讓我們正式進入這篇腦科學研究。

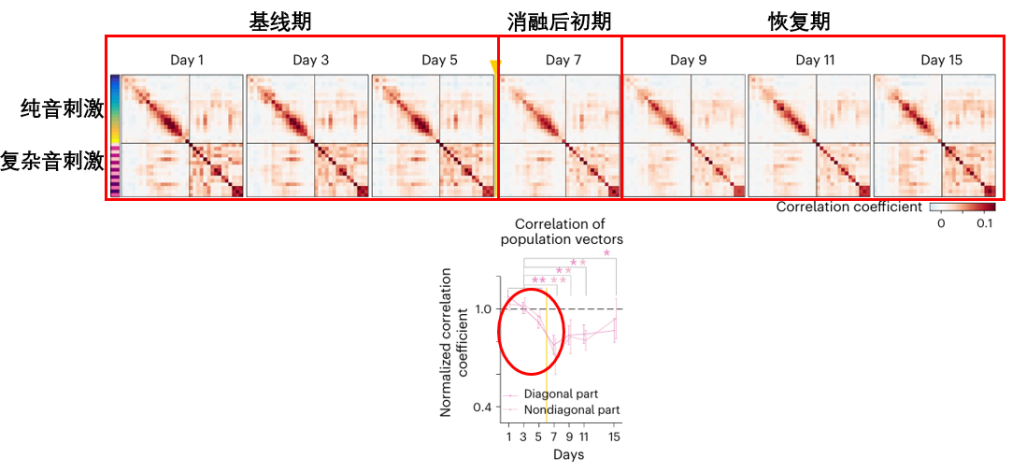
鑑於衰老過程中神經元損失的必然性,科學家們通過移除大腦聽覺皮層中30-40個對聲音反應最活躍、貢獻最大的神經元(約佔觀察區域的3%),來模擬功能性神經元隨着衰老發生不可逆損失的真實情景。而在移除這些核心神經元的第二天(Day 7)後,災難便發生了:
原本結構清晰、色彩分明的“聲音關係圖”(表徵圖)變得一片模糊,其內部相關性急劇下降(表現為圖片顏色對比度降低),大腦不僅喪失了識別單個聲音的能力,還失去了判斷不同聲音之間關係的能力,導致整個聲音分類體系陷入混亂。
就像是一輩子和一杯子, 大腦不再能清晰地劃出“yī bèi zi”和“yī bēi zi”之間的界限。當聽到其中一個詞時,被激活的神經元羣體可能與另一個詞的羣體有大量的重疊,最終,大腦做出了一個最省力的判斷,將聽到的聲音錯誤地歸類到了那個相似但錯誤的詞上。
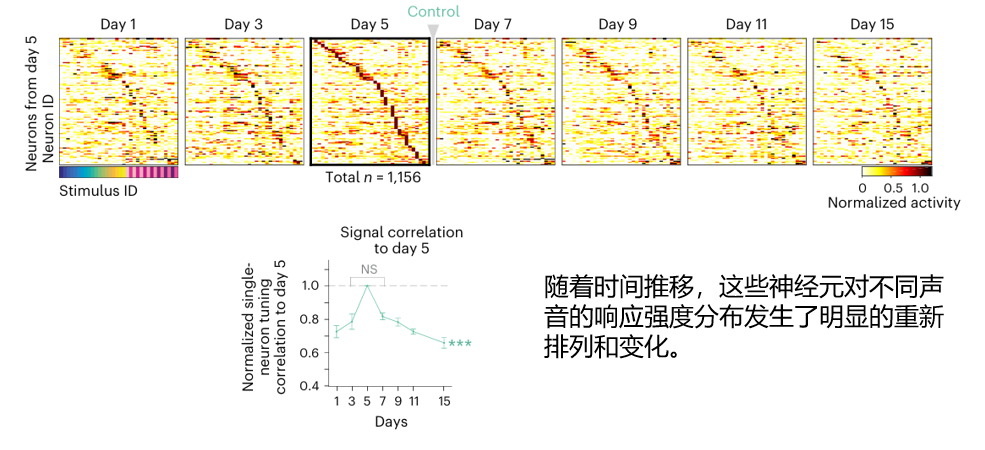
不過,這個受損的狀態並不是永久的。在接下來的幾天裏(Day 9, 11, 15),科學家們發現那張被破壞的、模糊的圖譜,結構一天天變得清晰,色彩對比度也慢慢增強,等到實驗結束時,這張圖的功能已經恢復到接近受損前的水平。
可別以為只是簡單的回到過去,在觀察恢復過程的時候,科學家們發現了一個直擊真相的反常現象:那些倖存下來的、原本活躍的神經元,它們的調諧曲線變得異常的狹窄和尖鋭,只對自己最喜歡的聲音產生強烈反應。
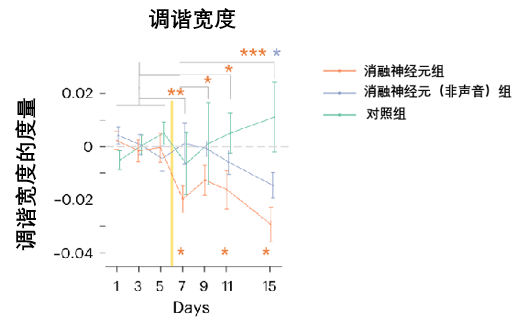
圖注:數值越小代表調諧曲線越窄、越尖鋭
這是否意味着大腦是靠這些倖存者老兵變得更專一來完成修復?並非如此,單靠這種收縮防禦的策略,並不足以“重建”整個大腦,真正扭轉乾坤的,是一股新生力量的崛起。
這股力量,正是那些先前在大腦網絡中沉睡的神經元。 它們並非沒有功能,只是在損傷前被調諧至其他任務從而保持沉默。當大腦網絡受損後,這些沉睡細胞(unresponsive neurons)被迅速激活,其反應強度隨着時間推移持續增強,最終主導了整個修復過程。
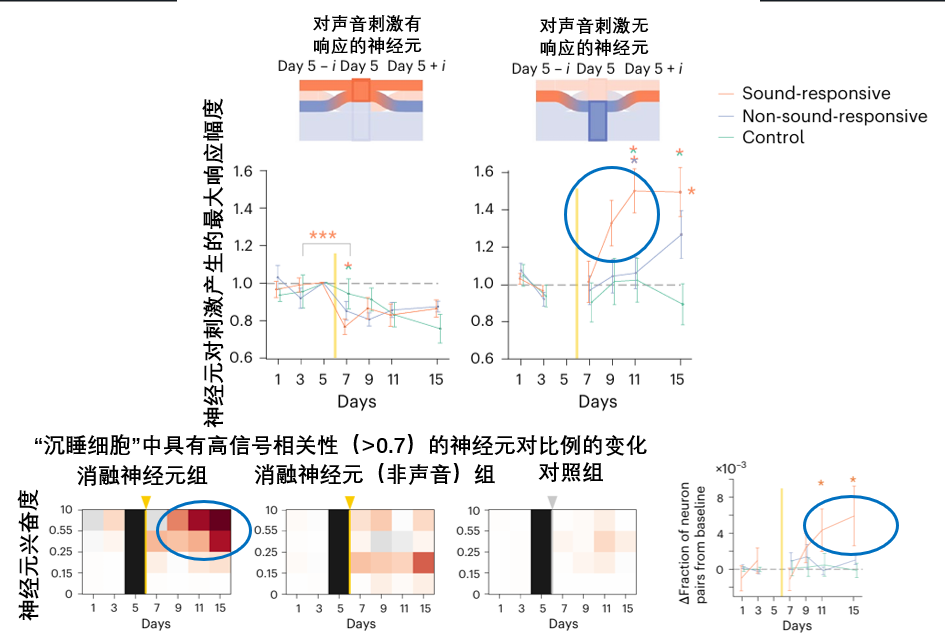
而且這些細胞,似乎還展現出驚人的“智能”:它們能感知到大腦網絡中功能上的缺失,並主動調整自身調諧特性,去模仿和繼承那些開頭被移除的精英神經元,最終重新穩定整個網絡迴路,填補了大腦因損傷而失去的功能。
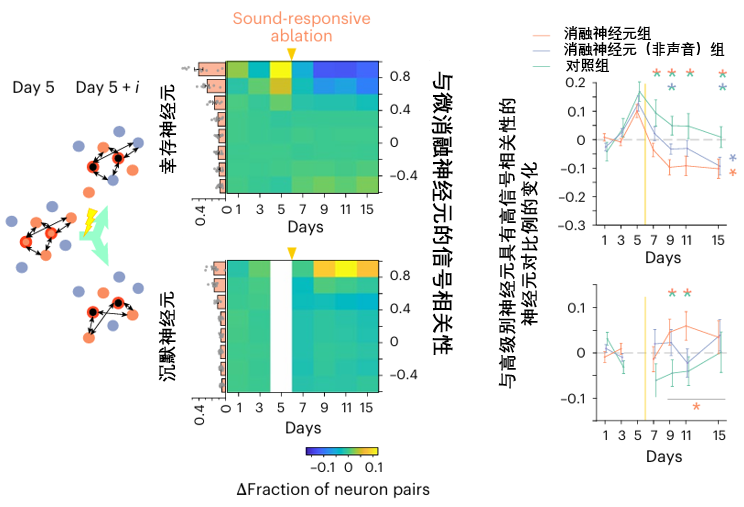
不過,這個看似強大的自愈過程,也並非萬無一失。我們都知道,大腦中的神經元主要分成興奮性神經元(負責傳遞處理信息)和抑制性神經元(調節神經元活動、維持大腦網絡平衡),所以移除不同類型的神經元,所引發的自愈反應及其最終後果……可能天差地別。

先來移除一下興奮神經元,大腦的修復機制確實能夠被有效激活:沉睡細胞被喚醒,大腦網絡恢復。但在此過程中,倖存的抑制神經元細胞表現出更劇烈且持久的反應不穩定性,其響應穩定性也因此受到了影響。
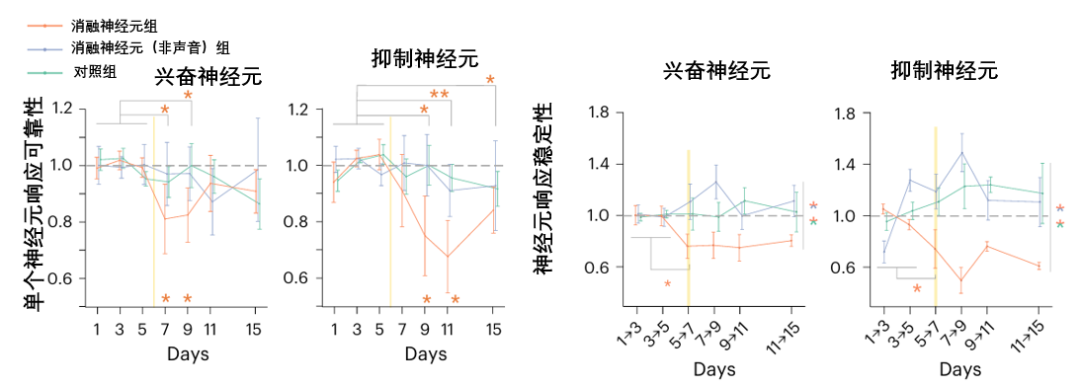
圖注:抑制神經元對神經網絡的完整性極為敏感,它們是維持秩序的核心
換個目標,移除抑制神經元?那神經系統就會非常不穩定,聲音表徵圖陷入了持久的模糊和混亂,其功能在長時間內都無法恢復至正常水平,神經元響應狀態的穩定性遭到破壞,整個系統失去了有效的自我修復與引導,導致本應發生的修復過程未能成功啓動或完成。
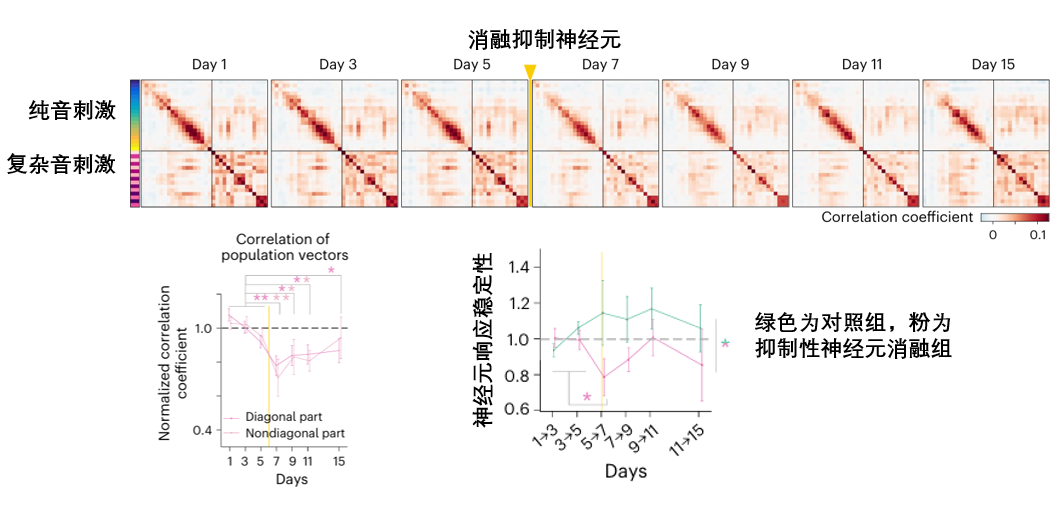
在最後的總結性示意圖中,這兩種截然不同的修復命運形成了鮮明對比:移除興奮性神經元后,大腦網絡尚能恢復;移除抑制性神經元,網絡則會陷入持久且嚴重的功能障礙。所以想要這種修復機制的有效運作,還需抑制性神經元的持續調控。
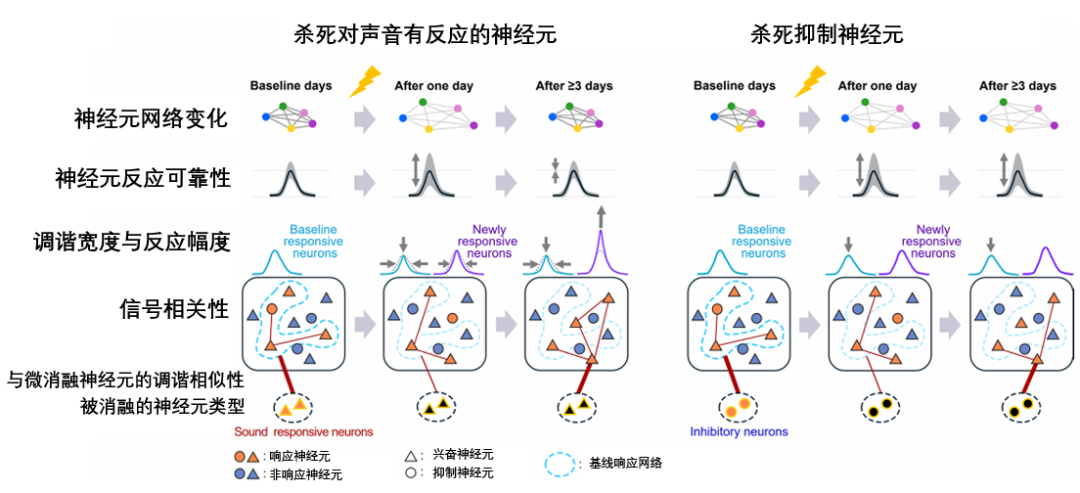
大腦這種神奇的自我修復能力,並非憑空產生。在神經科學領域,科學家們將其稱為認知儲備(Cognitive Reserve)[3]——一種對抗大腦損傷和衰老效應的內在保護機制。
這份儲備從何而來?此前研究表明,它主要由兩部分構成:一是天生優勢,比如更大的腦容量(腦儲備,涉及遺傳、大腦的物理大小和神經元數量);二是,也是更重要的,即個體通過後天生活經歷和學習所獲得的、靈活的補償與應對能力。
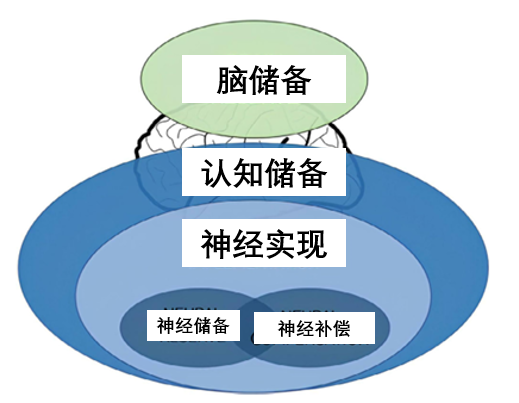
圖注:腦儲備、內層的認知儲備二者共同決定了我們對抗大腦損傷的能力
簡單來説,你一生中所有挑戰大腦、讓它保持忙碌和學習的活動,都在為你的認知儲備添磚加瓦。
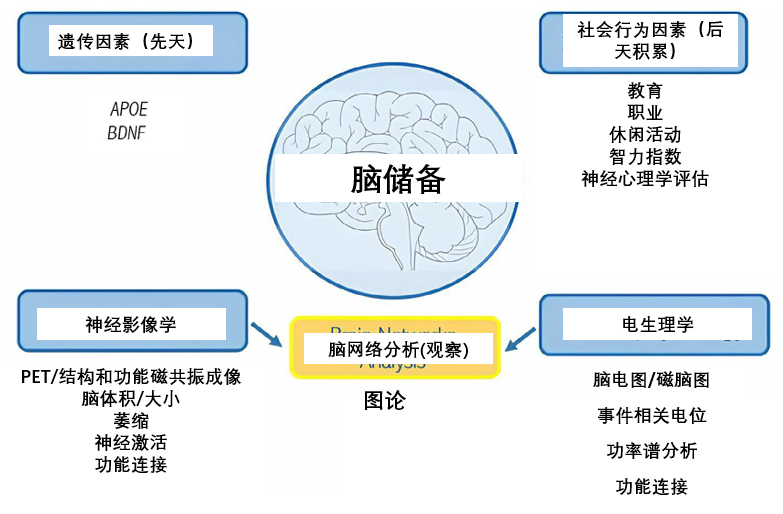
圖注:認知儲備受教育、生活習慣和基因影響,可通過腦成像和腦電技術測量
比如更高的教育水平:賦予你更高效的思考模式和問題解決策略;
或是更復雜的職業(醫生、教師或工程師等):強化了你的多任務處理與決策能力;
再比如豐富的休閒活動,無論是學一門樂器、掌握一門外語,還是堅持閲讀和社交等等。
雖然以上經歷,並不能讓你的腦細胞變得現不可摧,但它們會在你人生的不同階段,持續不斷塑造和優化你的神經網絡,讓它運作更高效、更具靈活性。當面對衰老帶來的神經元丟失時,一個擁有更高認知儲備的大腦,就能更快地定位問題所在,執行修復機制的能力自然更強,效率也更高。
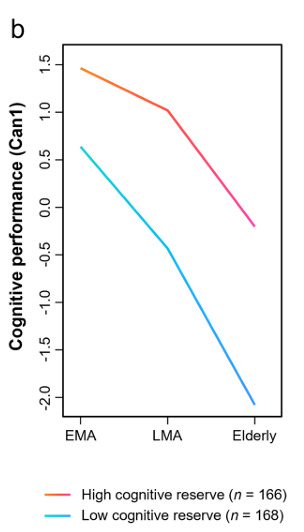
圖注:高認知儲備人羣(橙紅線)的認知能力可以長期維持在較高水平;低認知儲備人羣(藍線)則會經歷更快速的認知衰退[4]
而我們今天深入解析的這項研究,則首次在細胞層面,為這個認知儲備理論提供了一個實驗論證:這個高效的補償過程,極度依賴於抑制性神經元的精準調控,這也説明認知儲備不僅是知識和技能的積累,更是一個健康、平衡的神經網絡生態。
所以,想要安然度過不可避免的衰老過程,關鍵或許不在於如何阻止每一個神經元的凋亡,而在於我們從年輕時起,為大腦儲備了多少應對風浪的資本。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Huebner, E. A., & Strittmatter, S. M. (2009). Axon regeneration in the peripheral and central nervous systems. Results and problems in cell differentiation, 48, 339–351. https://doi.org/10.1007/400_2009_19
[2] Noda, T., Kienle, E., Eppler, J. B., Aschauer, D. F., Kaschube, M., Loewenstein, Y., & Rumpel, S. (2025). Homeostasis of a representational map in the neocortex. Nature neuroscience, 10.1038/s41593-025-01982-7. Advance online publication. https://doi.org/10.1038/s41593-025-01982-7
[3] Pappalettera, C., Carrarini, C., Miraglia, F., Vecchio, F., & Rossini, P. M. (2024). Cognitive resilience/reserve: Myth or reality? A review of definitions and measurement methods. Alzheimer’s & dementia : the journal of the Alzheimer’s Association, 20(5), 3567–3586. https://doi.org/10.1002/alz.13744
[4] Habich, A., Garcia-Cabello, E., Abbatantuono, C., Gonzalez-Burgos, L., Taurisano, P., Dierks, T., Barroso, J., & Ferreira, D. (2024). The effect of cognitive reserve on the cognitive connectome in healthy ageing. GeroScience, 10.1007/s11357-024-01328-4. Advance online publication. https://doi.org/10.1007/s11357-024-01328-4