35歲後,警惕甲狀腺“偽健康”!熬夜或致其早衰,還查不出來?這幾招可解!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

“熬夜有害健康”這句話想必各位一定早就聽得耳朵起繭子了。不過説歸説做歸做,最後大概率還是會一邊唸叨着早睡一邊心虛地熬到一兩點,甚至更晚。

太喜歡熬夜了,有種和閻王單挑的感覺
短期看可能沒什麼太大的影響。但是!不要天真地被體檢指標“一切如常”而迷惑,以為萬事大吉然後繼續美美熬夜。有句古話説得好:熬夜,熬的是甲狀腺的壽命。其實,甲狀腺正在為你表面的健康負重前行!
近日,《Aging Cell》上的一篇研究就發現[1]:就算體檢的甲狀腺指標完好,它也有可能正在因為你熬的每一次夜而衰老。而我們看似“善待自己”的身體,卻是一個壓榨健康甲狀腺細胞的“血汗工廠”……


甲狀腺的衰老
説到甲狀腺,大家可能並不陌生,它位於喉嚨下方、形似蝴蝶,又像兩個“盔甲”,才得名甲狀腺。雖然只有區區20~30g,卻是人體最大的內分泌腺,是身體新陳代謝的“總閘門”。
圖注:甲狀腺的示意圖
甲狀腺利用碘為原料合成、分泌甲狀腺激素,作用於全身各大器官,分解脂肪、維持體温、保持骨骼肌肉健康和器官的活力等等都要靠它。正因如此,甲狀腺還被稱作頸部的“命門”。
而垂體則是時刻監控、調控甲狀腺激素水平的“上司”,它會派出“促甲狀腺激素”來催促甲狀腺加班加點生產,如果甲狀腺激素產量過剩,垂體就會減少促甲狀腺激素的分泌,達到調節的作用。
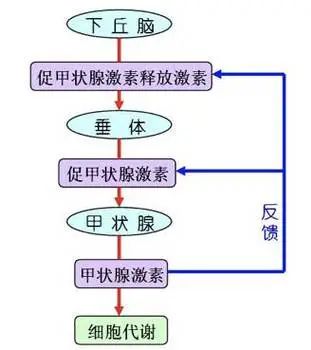
圖注:甲狀腺激素的調節
但是,再英明神斷的垂體也有誤判的時候,再努力的甲狀腺也有累壞的時候。當甲狀腺出現了異常,就出現了甲亢、甲減,以及許多“違章建築”,也就是成年發生率高於20%,每五個人裏就有一個的甲狀腺結節。
最近,隨着年齡增長,這些甲狀腺問題似乎變得越來越普遍了。那麼,甲狀腺這個不眠不休的工廠,究竟是為什麼會一步步走向衰老和失靈的呢?答案就在某些細胞裏——
首先,研究者對比了年輕人、中年人和老年人的甲狀腺組織,年輕人的甲狀腺濾泡排列整齊、結構飽滿,而到35-65歲中年組的甲狀腺,就已經結構混亂、組織疏鬆,非常接近老年組了。
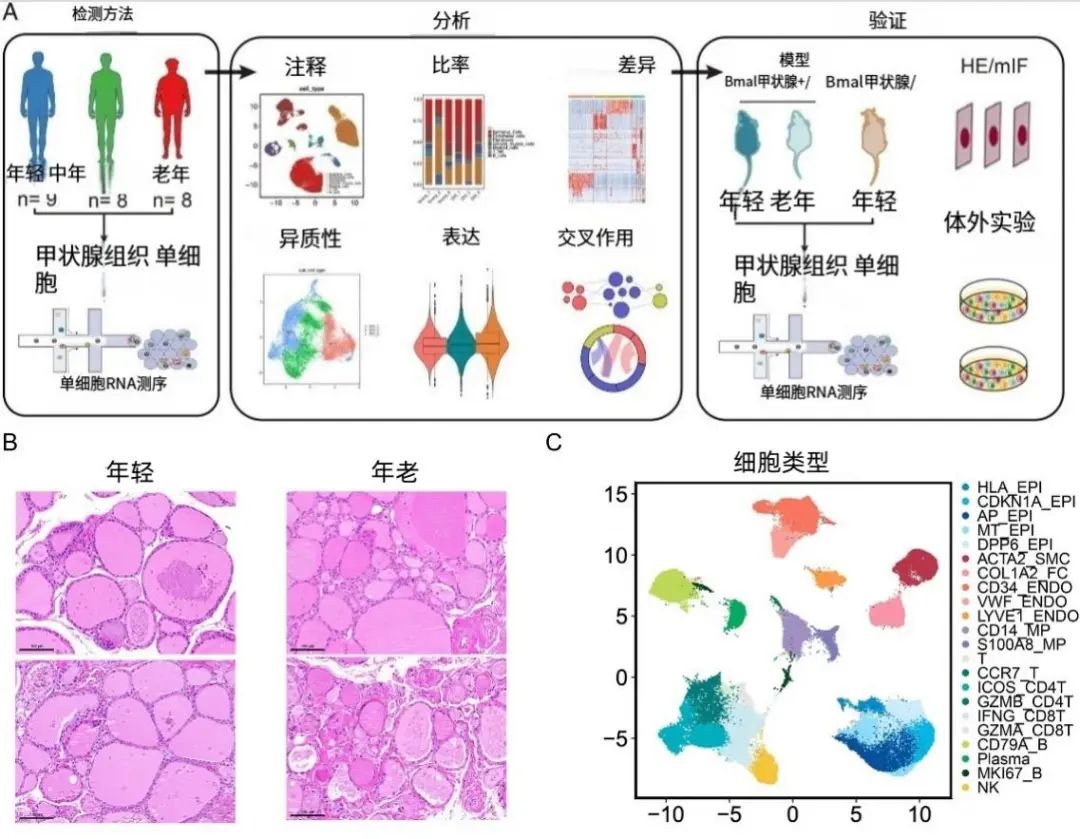
圖注:實驗總流程以及年輕與年老甲狀腺組織結構與細胞類型
進一步觀察後,研究者發現,衰老的甲狀腺裏出現了越來越多消極怠工的“摸魚細胞”(CDKN1A_EPI細胞),它們表現出了衰老特徵,並且它們負責生產激素的基因(如TG、TPO、TSHR和PAX8)表達也大幅降低。
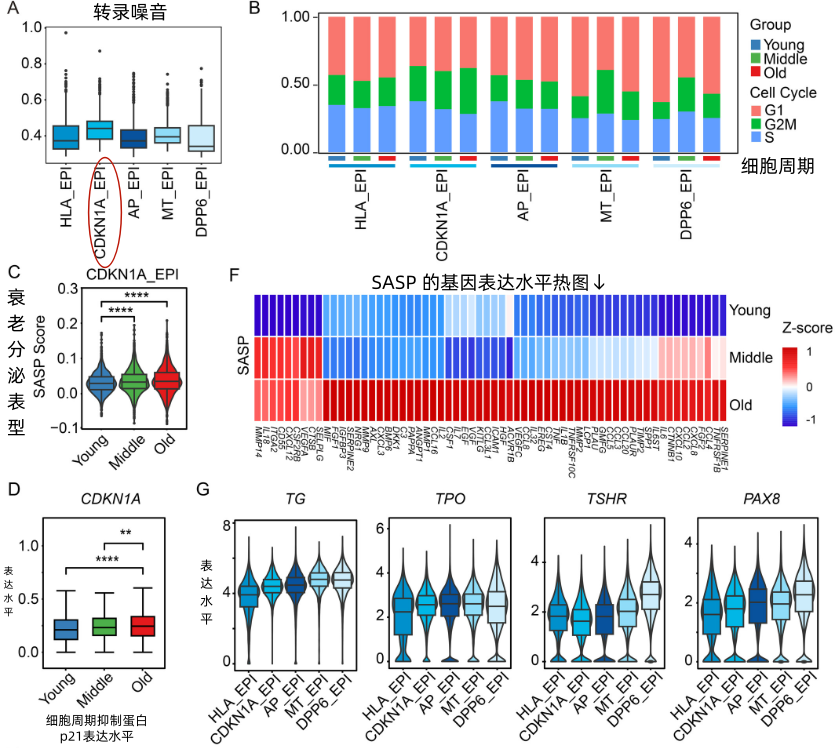
圖注:衰老的甲狀腺中一部分細胞表現出衰老特徵,生產激素的基因表達降低
但是,它們的“摸魚”並沒有導致甲狀腺整體垮掉——為了完成甲狀腺激素生產KPI,剩下的活兒就由其他健康的甲狀腺細胞“同事”加班加點來完成了:
研究者發現,隨着年齡增長,與激素合成相關的基因(TG,TPO等)的總表達量反而是增加的,這可能是對衰老導致促甲狀腺激素(TSH)水平升高的一種反應,從而“催促”着健康細胞加班來完成任務。
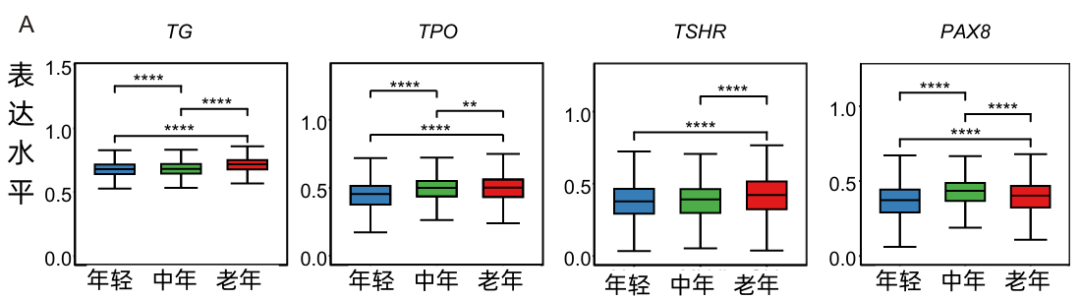
圖注:與激素合成相關的基因總表達量增加
**所以,一個看似平穩的激素水平,有可能是甲狀腺內部的衰老細胞啥也不幹+無數健康細胞“拼死加班”換來的。**而這也帶來了一種可能:即使體檢報告上的指標一切正常,也並不代表甲狀腺內就無事發生,因為你的身體可能在“粉飾太平”。並且,這種不平衡還在嚴重透支甲狀腺未來的健康!
那麼,究竟是什麼導致了甲狀腺的提前“透支”呢?答案,可能就是我們經常想戒掉又戒不掉的——熬夜。

揪出關鍵——晝夜節律
日出而作日落而息,一直刻在我們的生物本能中。生物鐘調控着細胞內成千上萬個基因的表達,確保身體各項機能有條不紊。而研究者發現,有種與晝夜節律的調節高度相關的關鍵基因BMAL1,它的表達水平會隨着年齡的增長而降低。
圖注:甲狀腺中隨衰老而改變的基因
説到BAML1基因,派派以往可能在文章中有提及過,但並沒有詳細地介紹。從機制上來講,BMAL1編碼的蛋白可以與CLOCK蛋白(在甲狀腺中也會隨衰老而減少)結合,激活下游的Per和Cry基因,開啓活力的一天。
而當PER和CRY蛋白積累到一定數量,它們就會返過來作用於BMAL1-CLOCK,調控身體強制“下班休息”。在休息的過程中,PER和CRY就會逐漸減少,直到重新在新的一天被BMAL1激活。就這樣,它們日復一日地來回變化,從而調節晝夜節律[2]。
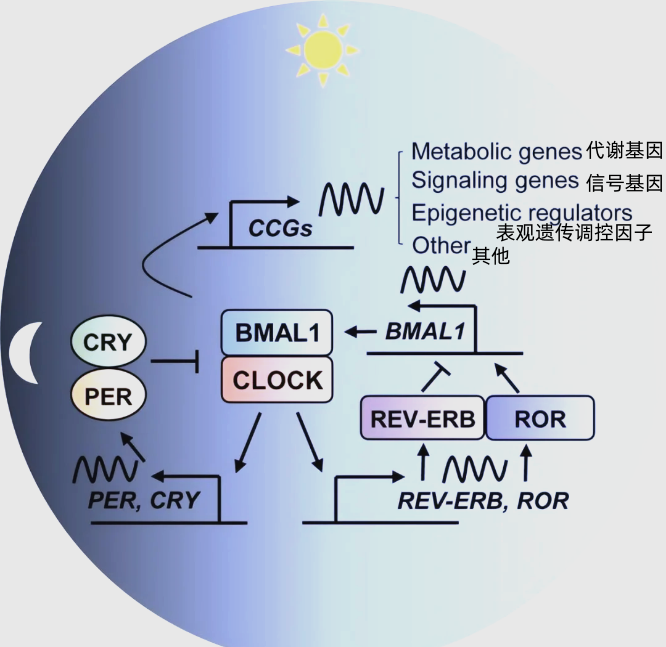
圖注:晝夜節律的調控機制
因此,BMAL1可以説是生物鐘調節與衰老的核心基因,在探討生物鐘紊亂的影響時,從BMAL1入手是一個更直接、有代表性的選擇。
於是,研究者提出了一個假設:生物鐘的紊亂,會不會就是甲狀腺細胞衰老,造成上文中甲狀腺細胞生產效率“不平衡”的現象的重要原因呢?
果然,當細胞的BMAL1被敲低或敲除後,原本健康的甲狀腺細胞出現了衰老的徵兆。
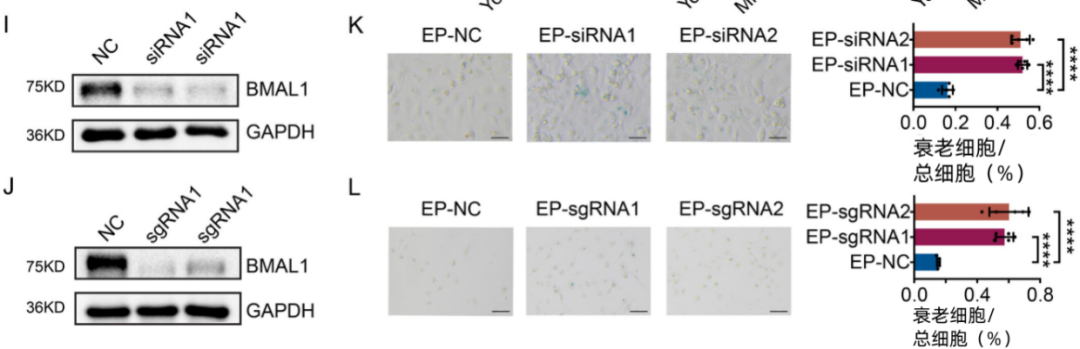
圖注:在BMAL1被敲低或敲除後甲狀腺細胞的衰老率增加
而小鼠身上的結果也十分一致。那些只有3~4個月大的青少年小鼠在失去Bmal1基因後,甲狀腺細胞和組織呈現出了與衰老小鼠幾乎一樣的衰老狀態——
甲狀腺細胞的衰老評分顯著增加,細胞週期也出現了停滯,細胞衰老相關標誌物Cdkn1a、Cdkn2a和SA-β-gal的表達增加。
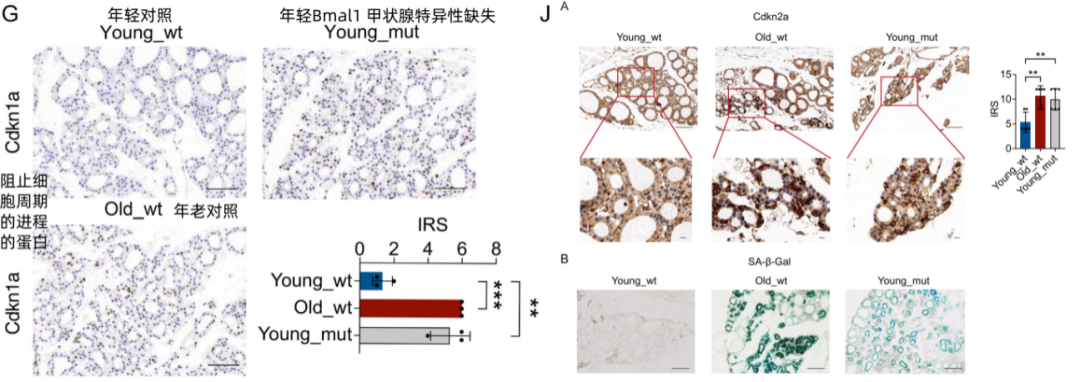
圖注:在BMAL1敲除小鼠體內的甲狀腺組織和細胞也出現了衰老
並且,它們的甲狀腺組織結構變得鬆散無序,甲狀腺激素水平大幅降低,而催促甲狀腺素分泌的TSH水平飆升。同時,甲狀腺激素的前體物質和TSH受體的表達有所增加,以響應TSH的“催促”。如此,也就催生了上文中講到的甲狀腺細胞生產效率“不平衡”的現象。
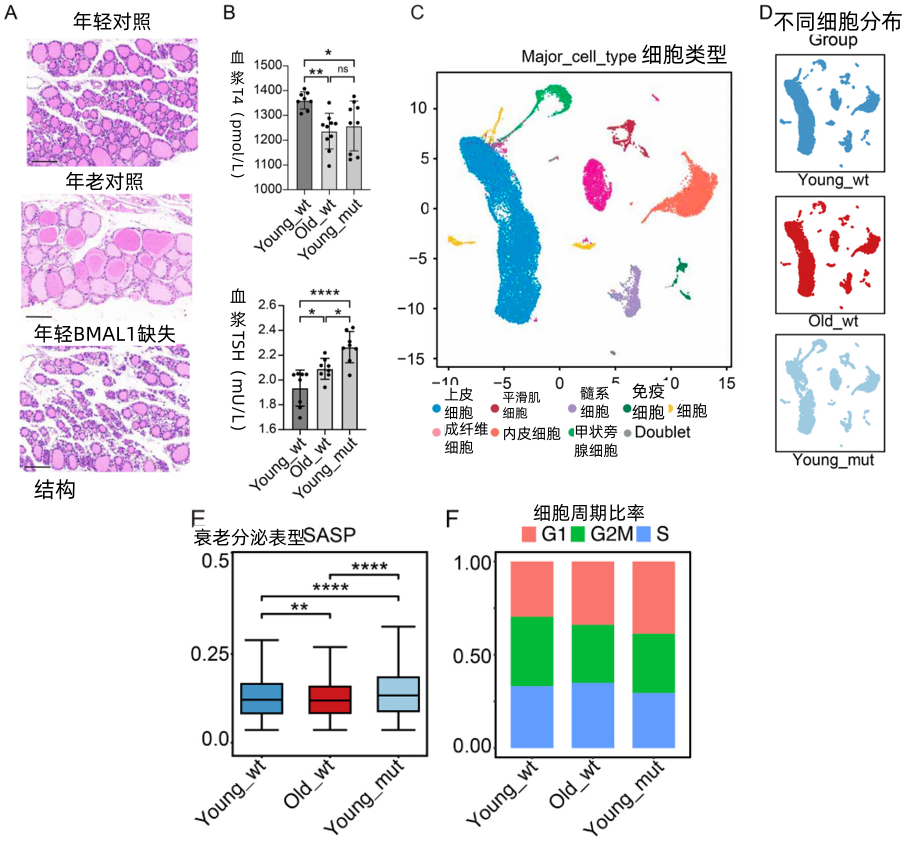
圖注:Bmal1小鼠的甲狀腺組織結構衰老,激素分泌受到影響,出現衰老特徵
而BMAL1之所以能夠調控晝夜節律,進而影響甲狀腺激素的合成和分泌,主要是通過對炎症的調控來達到的:
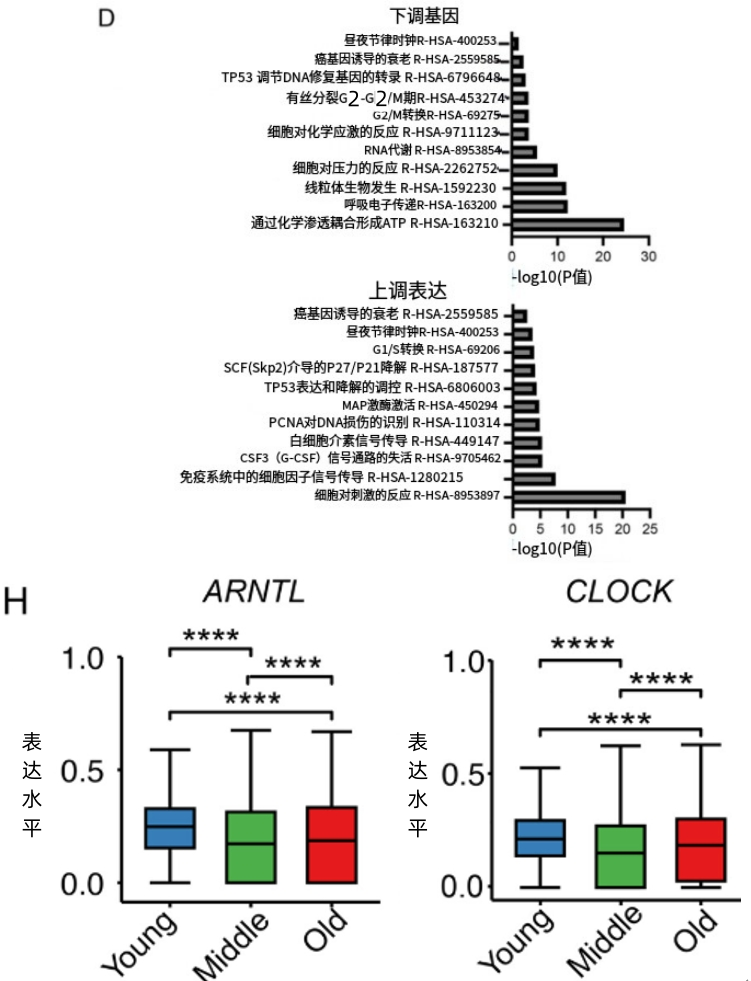
研究者們發現,有125個基因表達隨着衰老或BMAL1的減少而改變,其中,大部分的常見基因都與NF-κB這個炎症通路有關。而BMAL1的一個重要職責就是抑制NF-κB,沒有了bmal1,NF-κB的就會“解禁”,在甲狀腺內促進炎症和細胞衰老。
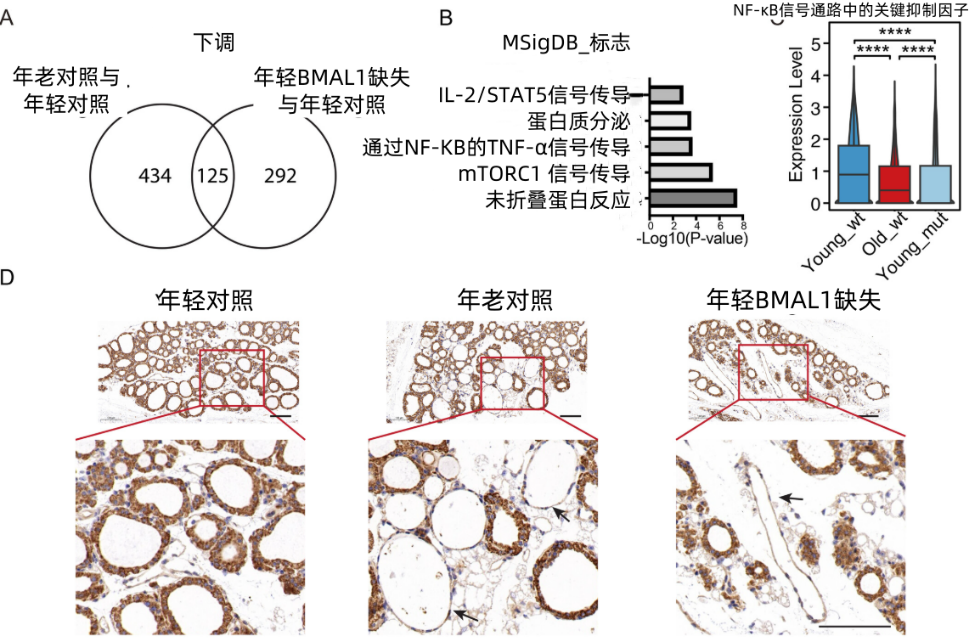
圖注:NF-κB炎症通路與Bmal1的下調有關
於是乎,在NF-κB的煽動下,越來越多的甲狀腺細胞不堪重負,提前進入了衰老狀態,當“摸魚”員工越來越多,而加班的健康細胞也終於被耗盡時,甲狀腺便會逐漸衰老。
當然,不要忘了,這一切的罪魁禍首,就是熬夜!

抓到關鍵基因!如何利用?
看完這篇文獻,派派只想説,熬夜傷身可不只是嘴上説説而已,是真的會肉眼可見地衰老啊!而導致甲狀腺衰老的關鍵——BMAL1基因,可不僅僅只控制困不困、甲狀腺老不老,它還影響着身體的每一個角落:
BMAL1能確保我們身體的“抗衰功能”(修復、自噬、免疫等)能在正確時間做正確的事。研究發現,敲除掉小鼠的Bmal1,它們就會喪失晝夜節律,導致嚴重的早衰、關節炎、代謝紊亂等[3]。此外,Bmal1還被證實與老年痴呆、骨骼發育、肌肉力量等與衰老相關的疾病與因素有關。
而熬夜、不規律作息,就是對BMAL1最直接的損害。不過……除了狠下心來戒掉熬夜、早睡早起、規律生活,還有什麼方法能喚醒BMAL1基因呢?
派派發現,一些**擁有抗衰效果的“老朋友”**都被發現對BAML1基因有調控作用!
熱量限制
研究發現,在熱量限制所帶來的壽命延長益處中,生物鐘(晝夜節律)的調整起到了重要的作用,熱量限制能上調BMAL1,保持晝夜節律的穩定,從而減緩衰老進程和減少衰老相關疾病的風險[4]。

NAD+補劑
有研究發現,NAD+能夠通過Sirtuins長壽蛋白直接影響生物鐘基因CLOCK和BMAL1[5],而NAD+前體補充劑(NMN、NR)的一些抗衰益處,也被認為來源於它們重新調節正常生物鐘的作用[6]。
此外,從Bmal1調控晝夜節律從而影響全身各大器官、系統來看,它的應用面顯然比想象中還要廣泛。
於是,一些能直接或間接對bmal1起作用的化合物就逐漸被研究者們開發,以在未來用於對抗衰老和治療各種老年疾病:
例如,有一種物質叫做核心晝夜節律調節劑(CCM,Core Circadian Modulator),它不僅能直接調節baml1的表達,還能夠靶向結合BMAL1,使其膨脹並改變結構,從而調節晝夜節律[2]。
此外,南加州大學凱克醫學院的研究人員還發現了化合物SHP1705,它能夠特異性激活BMAL1上游的CRY2,以抑制BMAL1和CLOCK的轉錄活性。目前,它正作為一種破壞膠質母細胞瘤幹細胞節律的藥物,在I期臨牀試驗中取得了良好結果[7]!
當然,從實驗室到人人可及的抗衰物質,還有很長的路要走。未來,派派期待着BMAL1能被真正、完全地發揮價值,持續守護我們的健康和青春~
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Zong, D., Sun, B., Ye, Q., Cao, H., & Guan, H. (2025). Circadian Gene BMAL1 Regulation of Cellular Senescence in Thyroid Aging. Aging Cell. doi:10.1111/acel.70119
[2] Pu, H., Bailey, L. C., Bauer, L. G., Voronkov, M., Baxter, M., Huber, K. V. M., . . . Rastinejad, F. (2025). Pharmacological targeting of BMAL1 modulates circadian and immune pathways. Nature Chemical Biology, 21(5), 736-745. doi:10.1038/s41589-025-01863-x
[3] Zheng, Y., Pan, L., Wang, F., Yan, J., Wang, T., Xia, Y., . . . Chen, Y. (2023). Neural function of Bmal1: an overview. Cell & Bioscience, 13(1), 1. doi:10.1186/s13578-022-00947-8
[4] Das, J. K., Banskota, N., Candia, J., Griswold, M. E., Orenduff, M., de Cabo, R., . . . Ferrucci, L. (2023). Calorie restriction modulates the transcription of genes related to stress response and longevity in human muscle: The CALERIE study. Aging Cell, 22(12), e13963. doi:https://doi.org/10.1111/acel.13963
[5] Nakahata, Y., Kaluzova, M., Grimaldi, B., Sahar, S., Hirayama, J., Chen, D., . . . Sassone-Corsi, P. (2008). The NAD<sup>+</sup>-Dependent Deacetylase SIRT1 Modulates CLOCK-Mediated Chromatin Remodeling and Circadian Control. Cell, 134(2), 329-340. doi:10.1016/j.cell.2008.07.002
[6] Xie, N., Zhang, L., Gao, W., Huang, C., Huber, P. E., Zhou, X., . . . Zou, B. (2020). NAD+ metabolism: pathophysiologic mechanisms and therapeutic potential. Signal Transduction and Targeted Therapy, 5(1), 227. doi:10.1038/s41392-020-00311-7
[7] Chan, P., Nagai, Y., Wu, Q., Hovsepyan, A., Mkhitaryan, S., Wang, J., . . . Kay, S. A. (2025). Advancing clinical response against glioblastoma: Evaluating SHP1705 CRY2 activator efficacy in preclinical models and safety in phase I trials. Neuro-Oncology, noaf089. doi:10.1093/neuonc/noaf089