高B12飲食延壽近30%?細胞更能扛、身體更耐造,維B12神奇喚醒全身抗衰力!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯38分钟前

在人類進化的長河中,為了節約資源,我們的機體很智慧地將那些生長需要、自己合成起來卻又極其耗能的物質“外包”給了第三方,維生素B12就是其一。
人類自身無法合成維B12,主要靠微生物合成,然後通過食物獲得。
合理攝入維B12有助於減緩認知衰退、預防貧血、改善情緒……特別是對容易缺乏維B12的老年人來説格外重要。
但除了營養作用,維B12對機體行為和壽命也有影****響[1]。最近,《Nature Communications》上的一項研究解釋了這背後的精妙機制。原來,神經元先“嘗”到維B12,然後“喊話”腸道,彼此十分默契地就把機體行為、抗壓力,甚至壽命給改善了[2]。

注:音頻同步上傳時光派【小宇宙】播客節目【衰老降噪實驗室】,歡迎文末訂閲

flr-4基因突變線蟲,絕佳模型
首先,不得不提下此次研究的大功臣——秀麗隱杆線蟲。
在人類等脊椎動物中,機體重要的代謝循環之一為蛋氨酸循環。簡單來説,這一循環就是把一種叫做同型半胱氨酸的物質轉化成蛋氨酸,然後再生成一種非常關鍵的“甲基供體”——S-腺苷蛋氨酸(SAM)。
SAM作用不小!它能給DNA、RNA等分子“貼上甲基標籤”,從而調控細胞的功能。我們平時説的DNA甲基化,那些甲基就是通過這個過程來的。而這個過程的順利進行,通常離不開維B12(主要途徑)或維B6的幫忙。
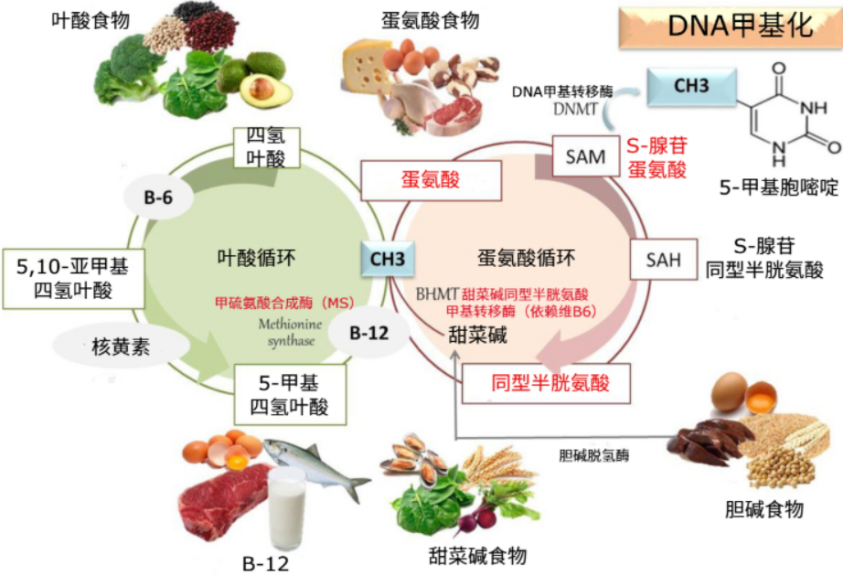
圖注:葉酸-蛋氨酸循環[3](PS:在脊椎動物中,同型半胱氨酸轉化為蛋氨酸主要有兩種機制:1)依賴維B12的甲硫氨酸合成酶(MS)催化 ;2)依賴維B6的甜菜鹼同型半胱氨酸甲基轉移酶(BHMT)催化)
與脊椎動物不同,線蟲等無脊椎動物體內,從同型半胱氨酸轉化為蛋氨酸沒有依賴維B6的BHMT備用通路,完全靠維B12路徑。這使它成了研究維B12機制的“簡化版模型”(即天然排除了維B6通路的干擾)。
這還不行,野生型線蟲體內有“適應性和代償性”機制調控,一般並不會因為某種食物成分而輕易發生機體狀態的改變,因此也就難以觀察到單獨的維B12帶來的明顯生理變化。
但研究者接着發現了flr-4基因突變線蟲(即flr-4(-),flr-4是一種絲氨酸/蘇氨酸激酶),這種線蟲對富含維B12的食物特別敏感,吃了富含維B12的食物後,它們會表現出明顯的生理改變。吃維B12的抗衰效果及機制,正由觀察它而來!

圖注:線蟲及其飲食方案(實驗室研究中線蟲主要以特定的大腸桿菌為食)

維B12,“點火”神經系統抗衰信號
在結合團隊的早期發現後,研究者首先指出,flr-4突變線蟲在吃了富含維B12的食物後會獲得:維B12和蛋氨酸濃度增加、抗壓能力增強、細胞“保護”基因增多、覓食行為改變和壽命延長(約30%)的“好處”。
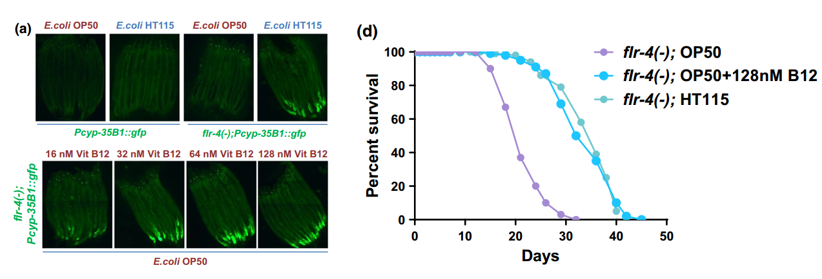
圖注:flr-4突變線蟲吃富含維B12的食物後細胞保護基因的表達和壽命增加(“Pcyp35B1::gfp”表徵細胞保護基因的表達,其中Pcyp35B1是p38-MAPK通路調控的細胞保護基因cyp35B1的啓動子,綠色熒光蛋白基因gfp用來可視化cyp35B1的表達)
不過這需要一定的前提條件:即突變體線蟲的蛋氨酸循環代謝通路要能正常工作。其次,吃的還得是富含B12或能產生蛋氨酸的代謝活躍菌,二者缺一不可!
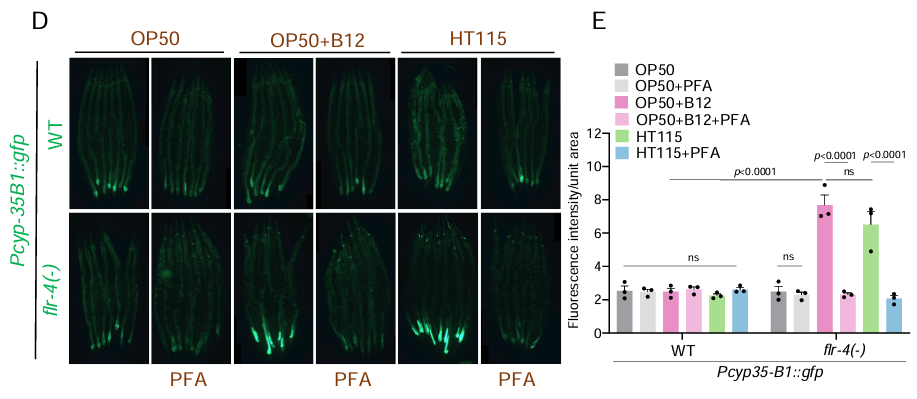
圖注:用甲醛(PFA)處理細菌飲食導致細菌死亡後,表型改善效果消失
比較有意思的是,通常我們認為吃維B12獲得抗衰“好處”,靠腸道的直接吸收利用。但突變體線蟲在這裏表示:不盡然!
研究發現,蛋氨酸合成酶缺乏的flr-4突變體線蟲因蛋氨酸循環通路故障,在吃了富含維B12的食物後沒有抗衰效果。但當恢復它們神經元中蛋氨酸合成酶的表達時,抗衰效果就能被恢復,在腸道中同樣操作則完全無效。
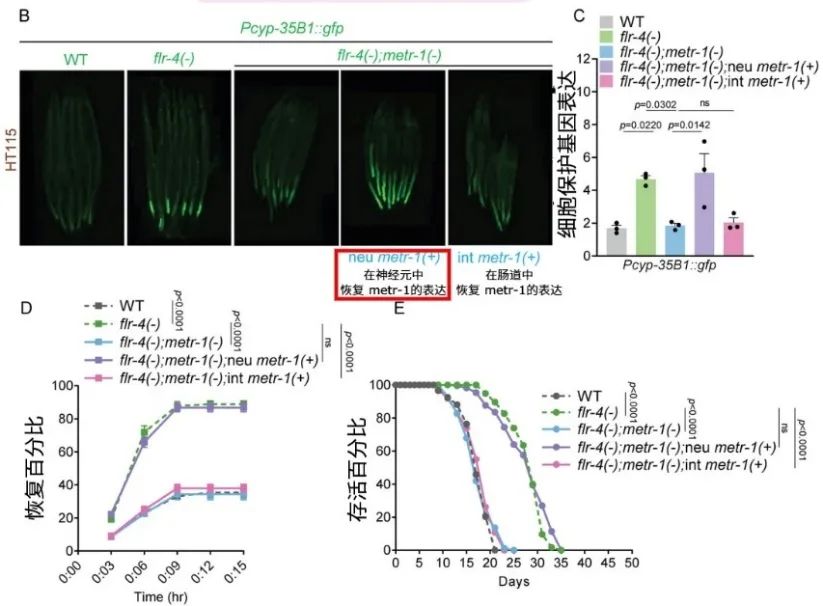
圖注:在神經元中恢復蛋氨酸合成酶metr-1的表達,能恢復抗衰效果,腸道中則不行
這表明,flr-4突變線蟲的抗衰效果可能始於神經系統,是維B12激活了神經元中的代謝感知(即蛋氨酸循環),然後驅動了全身的健康效應。
但儘管如此,研究者發現,最後抗衰的效果還是要靠腸道來執行:
團隊之前發現,flr-4突變線蟲表型的改善與其體內PMK-1通路(對應於人類中的P38 MAPK通路,且在許多功能上具有相似性[4,5])的激活有關。但組織特異性實驗顯示,只有在腸道敲除該通路或它的啓動蛋白sek-1時,上述的抗衰效果才會消失。
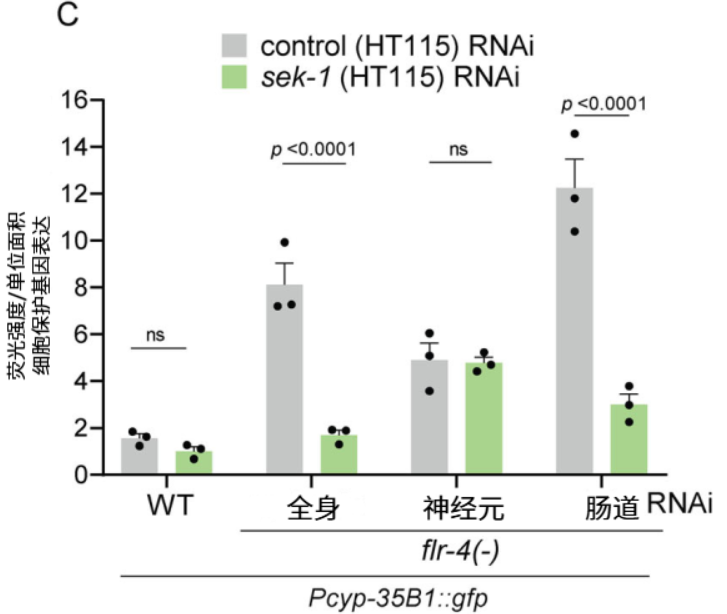
圖注:在線蟲各組織敲除PMK-1通路的啓動蛋白sek-1後,表型改善變化情況
這初步説明,神經系統最先感知維B12併發出抗衰信號,最後由腸道PMK-1通路運作來最終執行。

從神經到腸道,一場無間合作
從神經到腸道,這麼遠的“距離”,為了抗衰,它們究竟是怎麼配合完成的?接下來,是神經與腸道的“遠程聯動”:
首先,這趟旅程始於flr-4突變線蟲頭部的**ADF神經元(血清素能神經元的一種,感知外部環境信號)**中。
研究發現,對蛋氨酸循環失能(metr-1缺失)無法實現抗衰的flr-4突變線蟲來説,只有在ADF神經元中恢復metr-1的功能,才能“救回”延壽等抗衰表型,吃了維B12才有效果。表明ADF神經元是整條線的“總指揮”。
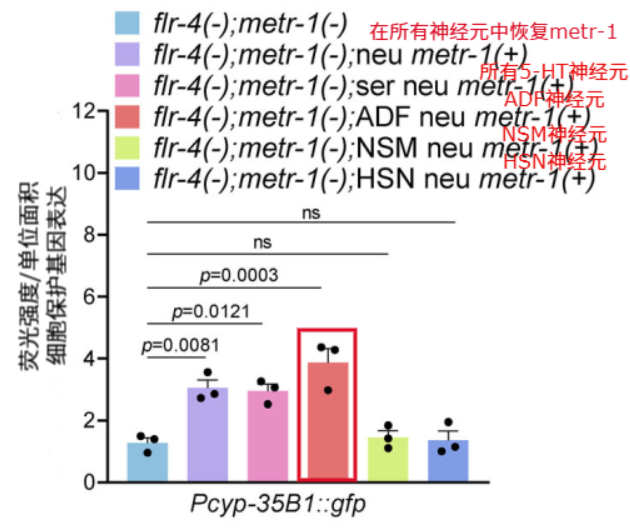
圖注:在ADF神經元中恢復metr-1功能,細胞保護基因表達增加(5-HT神經元包括ADF、NSM、HSN等)
具體而言,當吃了高維B12食物後,突變線蟲ADF神經元中的蛋氨酸循環將被激活,製造並釋放出了更多的血清素。血清素就是我們常説的“幸福荷爾蒙”,在這裏它扮演了第一個關鍵的信號分子。
血清素信號不會直接作用於遠方的腸道,而是會被後突觸中間神經元上的MOD-1受體所接收,促使該神經元分泌一種名為FLR-2的神經肽。FLR-2帶着抗衰信號,接手了將其從神經系統傳遞到身體其他部位的任務。
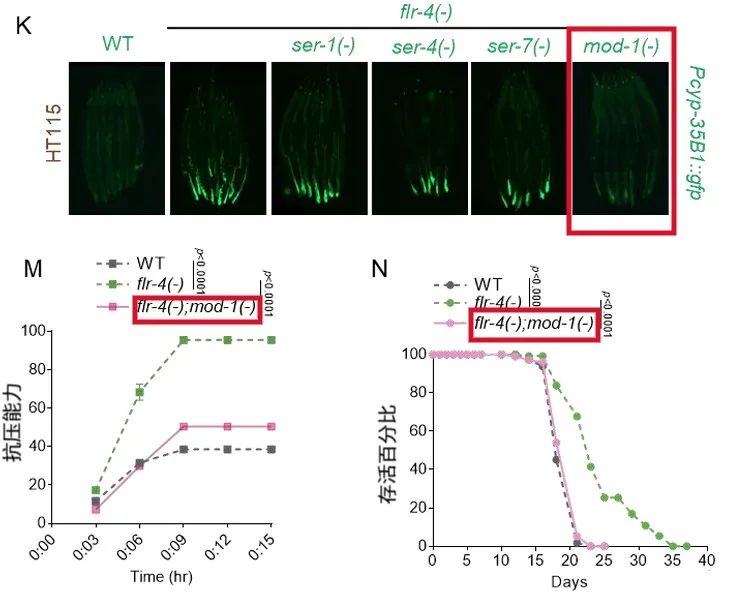
圖注:血清素可能的各種受體中,只有mod-1受體突變後表型改善效果消失
最後,FLR-2來到了它的目的地——線蟲的腸道,並與在腸道中表達的FSHR-1受體(參與低温應激及發育信號調控)進行了結合。
研究顯示,當FSHR-1發生突變時,FLR-2介導的所有抗衰效果完會全消失。僅在腸道中敲除FSHR-1也產生了同樣的抑制效果,表明腸道中的FSHR-1正是FLR-2的“信號接收人”。
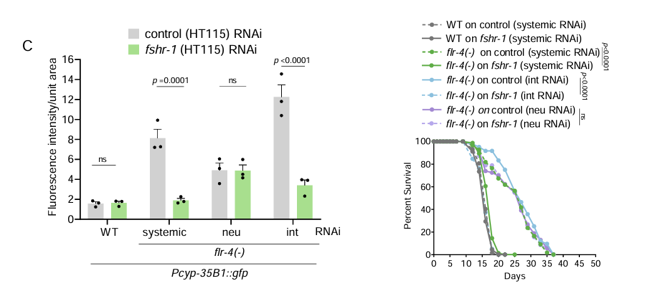
圖注:在腸道中敲除FSHR-1明顯使表型改善消失(左為細胞保護基因表達情況,右為壽命變化情況)
FSHR-1接收了FLR-2的抗衰信號後,會刺激腸道細胞內參與先天免疫反應和應激應答的TIR-1蛋白髮生聚合,激活突變線蟲腸道內的PMK-1通****路,全面啓動腸道防禦系統,最終讓線蟲在高B12飲食下能活得更長、更健康!
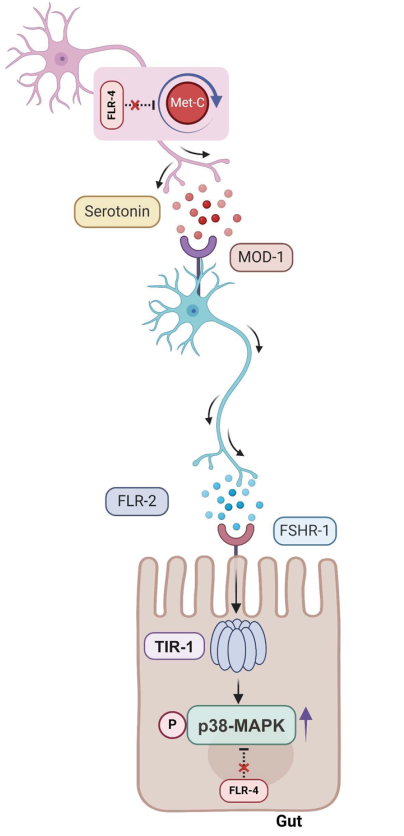
圖注:上下滑動查看ADF神經元與腸道遠程通話機制圖

叮!來自flr-4基因的啓示錄
目前,我們的結論有這樣一個大前提:flr-4基因發生突變的線蟲。那麼,flr-4基因正常情況下,是不是本來就是為了防止“系統過度激活”的?那對我們人類又有啥價值啊?

首先可以明確的是,flr-4確實是在神經元和腸道中踩“剎車”的,用來防止營養信號或應激反應被“過度激活”:
在ADF神經元中,flr-4能抑制蛋氨酸循環的過度激活,避免過量合成血清素;在腸道,flr-4抑制了PMK-1(或p38-MAPK)通路的過度激活,避免不必要的細胞保護反應。
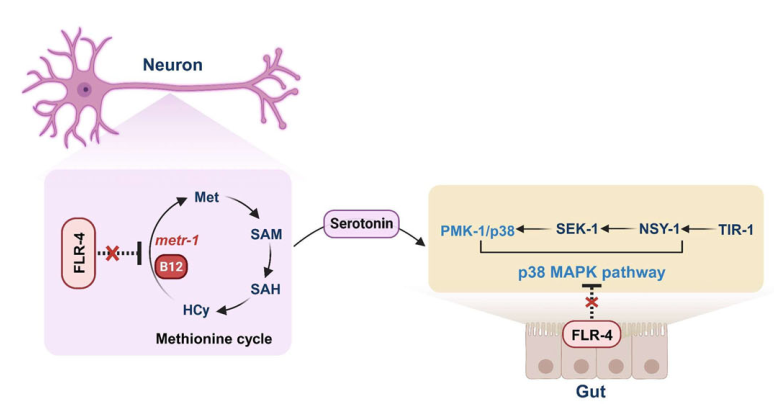
圖注:flr-4基因在神經元和腸道中同時發揮“抑制”效應
而flr-4突變,更像是解除了這些“抑制”,使神經-腸道信號鏈條被放大,最終表現出增強的壽命、提升的抗壓力等表型。不過這可不是要去研究怎麼模仿flr-4突變,畢竟flr-4突變線蟲能獲得抗衰好處只是特定條件下的副產物,比如線蟲需要攝入了大量的維B12、神經系統中蛋氨酸循環要被激活等等。
但儘管線蟲特有flr-4基因,flr-4基因調控的好幾個核心通路(如蛋氨酸循環、p38-MAPK)在哺乳動物中卻是高度保守的,且有類似的“負調控機制”。如果我們能加以借鑑,也許能實現:
調控神經元活動抗衰
已有研究表明,下丘腦中調控營養感知的神經元(如AgRP、POMC)對健康衰老有着顯著的影響[6,7]。如果我們在人類大腦中能找到類似ADF機制的神經元,然後調控它們,也許能發現“神經驅動延壽”新機制。
圖注:通過調節大腦中特定神經元的活動,探索健康衰老和延壽的可能
開發抗衰老藥物
現在我們知道,營養物質能通過神經通路被識別,並引發系統級反應。那如果能精確激活神經通路中的某些營養感應信號,是不是就能開發出更加安全高效的抗衰老藥物呢?
比如,通過口服某種小分子藥物,精準刺激ADF神經元,來模仿維B12被識別,繼而引發的連鎖抗衰效應。這或許就能避免傳統藥物或補劑吃了很多,副作用大、無效或吃了不一定到達目標組織的弊端。

個性化干預,勢在必行
最後,研究中只有f1r-4基因突變的線蟲才表現出抗衰反應。然而,在人類中,同樣存在蛋氨酸循環相關基因(如MTHFR基因)的多態性。
例如,一項中國人羣流行病學調查顯示,MTHFR C677T等位基因頻率和677TT基因型頻率在海南人羣中最低(分別為24.0%和6.4%),在陝西、天津、河南人羣中更高(分別為54.5-60.2%和30.4-37.0%)[8]。這可能影響不同人對營養物質(如維B12)的需求量和代謝能力。
正所謂“千人千方”,未來的健康管理,可能更多走向基於個體的基因組和代謝組,量身定製維B12、蛋氨酸等的補充方案,從而讓人人走上屬於自己的抗衰之路!
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Nair, T., Chakraborty, R., Singh, P., Rahman, S. S., Bhaskar, A. K., Sengupta, S., & Mukhopadhyay, A. (2022). Adaptive capacity to dietary Vitamin B12 levels is maintained by a gene-diet interaction that ensures optimal life span. Aging cell, 21(1), e13518.
[2] Rahman, S. S., Bhattacharjee, S., Motwani, S., Prakash, G., Ujjainiya, R., Chitkara, S., Nair, T., Keerthana, R. S., Sengupta, S., & Mukhopadhyay, A. (2025). Methionine cycle in C. elegans serotonergic neurons regulates diet-dependent behaviour and longevity through neuron-gut signaling. Nature communications, 16(1), 5118.
[3] Mafra, D., Esgalhado, M., Borges, N. A., Cardozo, L. F. M. F., Stockler-Pinto, M. B., Craven, H., Buchanan, S. J., Lindholm, B., Stenvinkel, P., & Shiels, P. G. (2019). Methyl Donor Nutrients in Chronic Kidney Disease: Impact on the Epigenetic Landscape. The Journal of nutrition, 149(3), 372–380.
[4] Chatterjee, N., Eom, H. J., & Choi, J. (2014). Effects of silver nanoparticles on oxidative DNA damage-repair as a function of p38 MAPK status: a comparative approach using human Jurkat T cells and the nematode Caenorhabditis elegans. Environmental and molecular mutagenesis, 55(2), 122–133.
[5] Zhu, X., Liu, F., Wu, Q., Li, S., Ruan, G., Yang, J., Yu, C., Jiang, N., Xiao, Y., & Liu, Y. (2022). Brevilin A enhances innate immunity and the resistance of oxidative stress in Caenorhabditis elegans via p38 MAPK pathway. International immunopharmacology, 113(Pt A), 109385.
[6] Ibeas, K., Griñán-Ferré, C., Del Mar Romero, M., Sebastián, D., Bastías-Pérez, M., Gómez, R., Soler-Vázquez, M. C., Zagmutt, S., Pallás, M., Castell, M., Belsham, D. D., Mera, P., Herrero, L., & Serra, D. (2024). Cpt1a silencing in AgRP neurons improves cognitive and physical capacity and promotes healthy aging in male mice. Aging cell, 23(2), e14047.
[7] Jiang, X., Liu, K., Luo, P., Li, Z., Xiao, F., Jiang, H., Wu, S., Tang, M., Yuan, F., Li, X., Shu, Y., Peng, B., Chen, S., Ni, S., & Guo, F. (2024). Hypothalamic SLC7A14 accounts for aging-reduced lipolysis in white adipose tissue of male mice. Nature communications, 15(1), 7948.
[8] (2016). 中國人羣MTHFR C677T,A1298C和MTRR A66G基因多態性分佈及其與代謝綜合徵關係的研究.