每天10萬次DNA損傷,超級增強DNA修復,或讓“無病老去”更近一步!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯53分钟前

過去150年內,人類的預期壽命已經翻倍,在許多發達國家,人類平均壽命已接近80歲。但活得越來越長,我們就真的越來越健康嗎?身邊的老人們,誰又不是一副身軀,多種慢病纏身。

醫療進步、營養改善倒是讓壽命更長了,但卻並沒有讓咱的基因更加優秀。自然選擇的意思是:只要確保體細胞基因在生育期間健康就行了,之後發生個基因變異啥的,管不鳥了。因此,咱的命雖然長了,但衰老進程和老年病並沒有獲得根本的改善。
這也是衰老研究領域中DNA損傷會被科學家們關注的原因。接下來,將一文回顧:面對衰老中的DNA損傷,人類的那些“硬核”出擊[1]!

時光派第六屆衰老幹預論壇將於今年9月開幕,我們有幸邀請到了本文作者之一、衰老遺傳學領軍人物Jan Vijg教授,為我們講述他所取得的學術研究成果。不過在此之前,讓我們先睹為快,看看今天這篇高分綜述中都有哪些精彩見解!

DNA損傷,衰老的“元兇”
頭髮會泛白、皮膚會褶皺,在我們一天天的變老中,作為生命信息模板的DNA,也會持續不斷地遭受到內源(如細胞新陳代謝“廢物”、氧化應激)和外源(如紫外線、化學物質)的攻擊而出現損傷。據估計,人體的每個細胞每天可能要承受高達10萬次的DNA損傷。
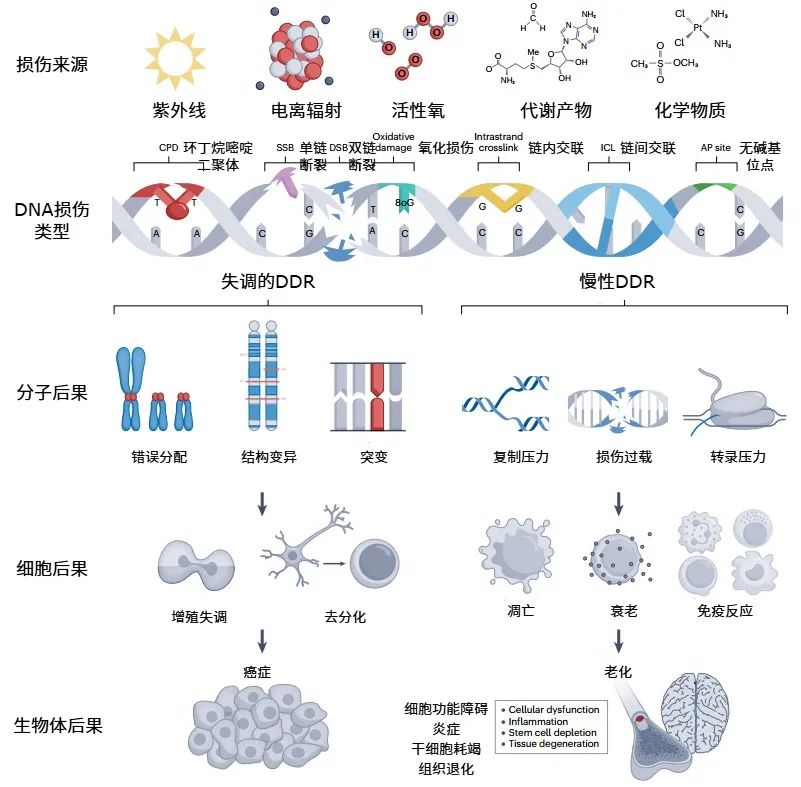
圖注:DNA損傷的來源和類型以及分子、細胞和生物體後果
像傾倒的第一張多米諾骨牌,DNA損傷不但會破壞自身結構,引發基因表達異常,還會影響RNA轉錄,蛋白質合成,最終影響體細胞的正常功能和身份。特別是,隨着衰老,DNA修復能力跟不上時,這種損傷還可能變成永久性的突變,在體細胞中累積下來。
為了應對損傷,細胞會啓動**“DNA損傷應答”(即DDR)自我保護機制**。修得了就修,損傷太嚴重修不了的,就命令細胞“自殺”(凋亡)或者“退休”(變成衰老細胞),以防止其繼續工作、出錯甚至變成癌細胞。
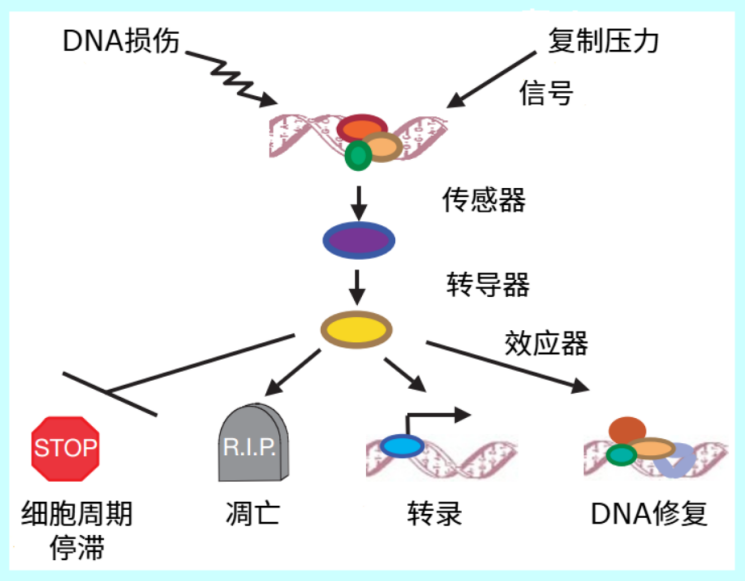
圖注:DNA損傷應答(DDR)信號傳導通路簡化圖(箭頭表示激活事件,垂直線表示抑制事件[2])
不過DDR機制也有副作用。一方面,衰老細胞會分泌大量有害因子引起慢性炎症,而過度的細胞凋亡也可能導致老年痴呆等疾病發生。也就是説,DDR雖是細胞保護機制,但長期激活反而會促進衰老。
在引發慢性炎症方面,核中受損的DNA片段如果不小心漏到細胞質中,也可能會激活先天免疫系統引起炎症。此外,DNA損傷和修復還會擾亂組蛋白修飾和DNA甲基化模式,加速表觀遺傳時鐘,促進衰老。
在人類中,多種早衰樣綜合徵都與DNA修復基因的突變有關,患者常表現出系統性、加速的衰老。對多種哺乳動物的研究也發現,體細胞突變率高的物種壽命更短[3],這可能與體細胞的DNA修復能力不足有關。綜合來看,DNA損傷和修復與衰老密切相關!
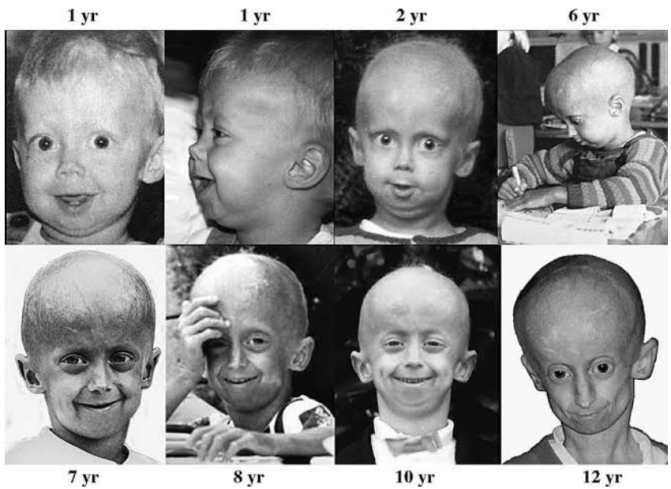
圖注:Hutchinson-Gilford早衰綜合徵,由於核纖層蛋白突變引發了DNA損傷的增加

破局,科學抗衰的“三板斧”
既然衰老的根兒出在DNA損傷和修復力不足這裏,那見招拆招,科學家們的靈光閃了又閃:
No.1
清除或改造衰老細胞
衰老細胞在正常生理下雖有助於組織修復和傷口癒合,但更多時候它們會不斷釋放炎症信號,“污染”周圍的好細胞,誘發慢性炎症。DNA損傷應答是衰老細胞出現的重要來源。因此,對這些衰老細胞下手,會是應對DNA損傷產生的負面影響的一種手段。
辦法一:清除衰老細胞
衰老細胞之所以難被清除,是因其啓動了多種“自我保護機制”,如抵抗凋亡和表達異常的膜蛋白等。針對這些特點,清除藥物也具有多樣性,包括達沙替尼和槲皮素組合(DQ組合),尼達尼布(酪氨酸激酶抑制劑),以及天然成分山奈酚、木犀草素等等,其中很多已進入慢病的臨牀試驗階段。
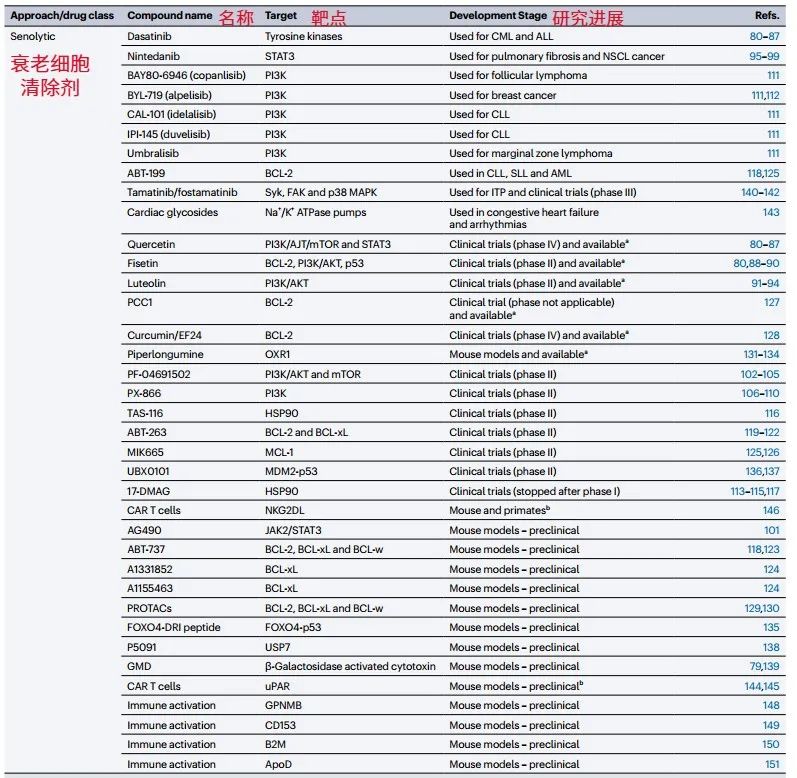
圖注:衰老細胞清除劑及其靶點和研究進展
辦法二:“改造”衰老細胞
許多PI3K/AKT和mTOR,以及HSP90抑制劑有望減少衰老細胞有害物質的釋放,緩解慢性炎症,這包括了有這方面潛力的癌症用藥PX-866(多種癌症)和BYL-719(乳腺癌),以及目前正研究火熱的雷帕黴素等。
No.2
平息“無菌性炎症”
前面提到,當DNA損傷嚴重時,DNA碎片可能會“跑”出細胞核,進入細胞質。這時,細胞內的“報警系統”會被激活:感應蛋白cGAS首先會識別這些“異物”,並製造出一種信號分子cGAMP,進一步激活幹擾素基因刺激因子STING,最終引發慢性炎症反應。
這在病毒感染時是好事,比如能清除掉宿主細胞質中外來的病毒DNA碎片。但衰老時,由於細胞會經歷大量持續的DNA損傷,系統可能會經常被錯誤觸發,從而把自己的DNA當成病毒一樣去攻擊,最終引發持續的慢性炎症。

對此,醫藥公司Ventus Therapeutics最近公佈了其研發新藥VENT-03的I期人體試驗數據。
作為cGAS抑制劑,VENT-03能阻斷細胞對“異常DNA碎片”的過度反應,進而減輕由DNA損傷引發的慢性炎症,臨牀安全性和耐受性均表現良好。雖為治紅斑狼瘡而來,VENT-03倒不失為一個干預衰老相關慢性炎症的種子選手。

圖注:Therapeutics公佈VENT-03的I期人體試驗數據
其他藥物還包括能阻斷cGAS與DNA結合的氫氯喹、喹啉和阿司匹林,抑制STING活性的H-151和BB-Cl,以及影響下游信號通路的T0901317和JQ1等。這些藥物也正用於研究治療紅斑狼瘡、神經退行性疾病和與衰老相關的慢性炎症。
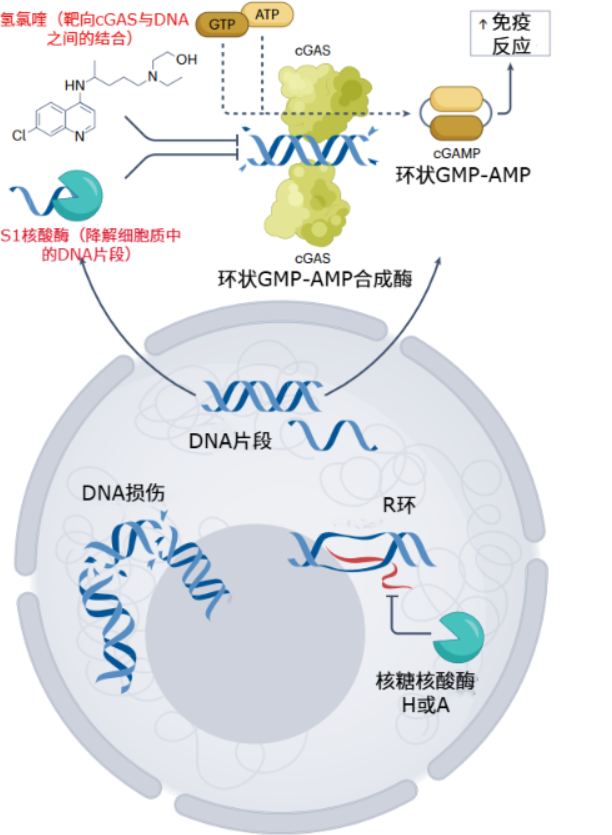
圖注:DNA損傷後,細胞內激活cGAS合成cGAMP,進而引發免疫反應的過程
No.3
給DNA修復系統“充充電”?
既然DNA損傷和修復能力不足帶來的不良後果咱可以減輕,那給DNA的修復能力來點助力也不是不行!
補充NAD+及其前體
在DNA修復方面,NAD+可分別作為DNA修復酶PARPs和Sirtuins的底物和必需輔因子。補充NAD+及其前體(如NMN、NR)可能有助於DNA修復。
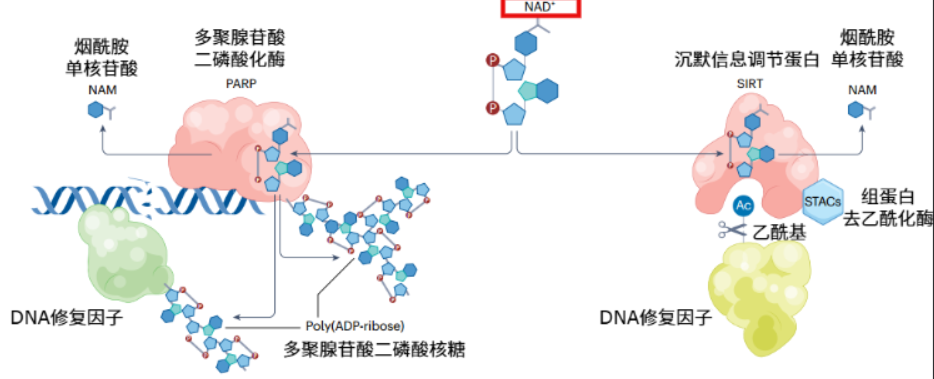
圖注:NAD+可分別作為PARPs和Sirtuins的底物和必需輔因子,幫助DNA修復
在動物試驗中,補充NAD+促進了DNA修復和線粒體自噬的改善[5,6]。目前一些臨牀試驗正在測試其是否對人類也有幫助。例如,服用NAD⁺前體物質NR後,慢性肺病患者體內的炎症標誌物(IL-8)有所減輕[7]。
抑制DREAM複合物
DREAM複合物是一個高度保守的基因抑制因子,就像細胞裏的“DNA修復剎車”,壓制了很多DNA修復基因的活性,是造成體細胞DNA修復能力有限的重要原因。
研究發現,通過藥物(如哈爾明鹼)抑制DREAM複合物,可以安全地“解開封印”,重新激活被關閉的修復基因,讓體細胞獲得類似生殖細胞的強大修復能力,從根本上提升基因組的穩定性。
(PS:哈爾明鹼能特異性地抑制DYRK1A蛋白,目前正處於臨牀前研究階段,在唐氏綜合症患者相關細胞和類器官模型中表現出減少DNA損傷、改善腦類器官形態和功能的潛力[8])
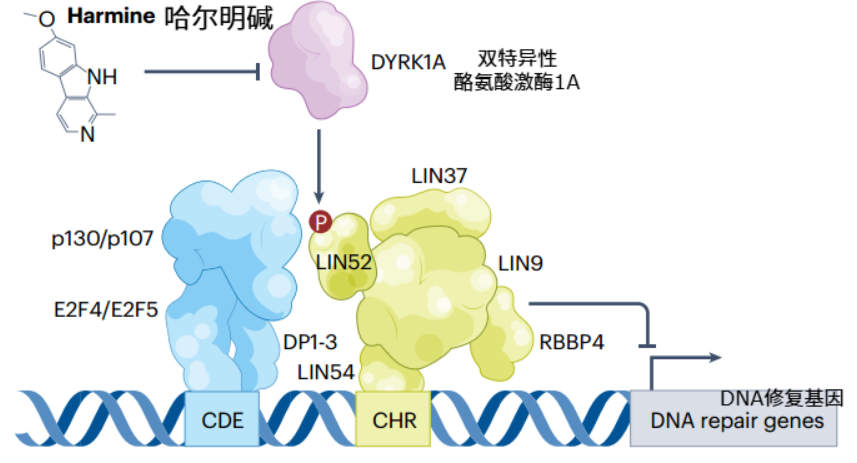
圖注:哈爾明鹼通過抑制DYRK1A,進而影響參與細胞內信號傳導的LIN-37等蛋白,最終促進DNA修復基因的表達(PS:DREAM複合物的組裝和功能主要受蛋白LIN52與蛋白p130/p107之間的結合調控,DREAM複合物能識別DNA修復基因中的CDE-CHR基序,抑制修復基因表達)
基因療法
過去十年中,基因編輯技術(如CRISPR-Cas9)取得了革命性的進展,使利用基因治療修復基因突變來減輕DNA損傷成為可能。
在HGPS小鼠模型中,接受基因治療的小鼠表現得更健康,壽命延長了一倍以上[9]。對來自Cockayne綜合徵患者的誘導多能幹細胞衍生的間充質幹細胞進行基因治療,這些細胞也表現出了較少的衰老標誌物、更好的分化潛力等特徵[10]。
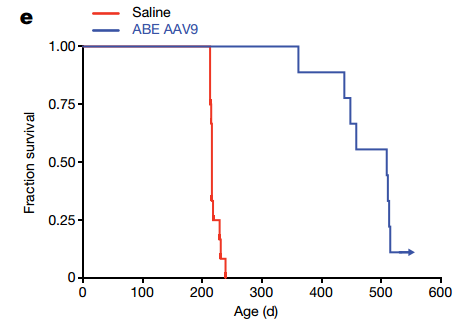
圖注:在小鼠出生後第14天進行干預,大大延長了小鼠的中位生存期,從215天延長至510天
此外,研究者還在探索用高效DNA修復酶(如光解酶,已作為DNA修復酶在人類皮膚損傷和老化中進行研究[11])或細胞重編程(已發現能改善早衰小鼠的DNA損傷修復[12])來增強人類DNA的修復能力。或者,從那些能在極端環境中仍保持基因組穩定的物種身上“取取經”,説不定也能為人類提供一些靈感!

圖注:嗜輻射菌(左);水熊蟲(右)

人類最長壽命115歲?
一位遺傳學家的遠見卓識
作為本研究的作者之一,Jan Vijg教授是少數明確提出“人類壽命存在極限”的科學家之一。他認為,人類的最長壽命很可能在115歲左右,只有極少數人能達到絕對最大壽命125歲[13,14],這也就意味着,在有限的生命裏極大限度地延緩衰老是一件非常有意義的事情。
Jan Vijg教授自身專於研究“基因組不穩定性與衰老”方向,他的整個職業生涯都在研究DNA損傷和突變是如何隨着年齡累積並導致衰老的。

早在上世紀90年代,Jan Vijg教授就在國際上率先建立了可以檢測體細胞突變的轉基因小鼠模型——Muta™Mouse,並首次證明,體細胞突變頻率會隨着年齡不斷增長,這為“老化源自DNA損傷積累”理論提供了強有力的證據。
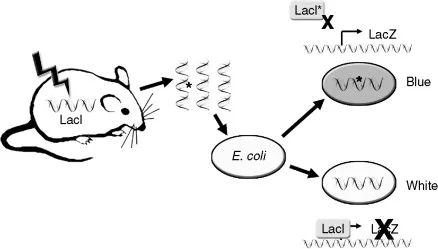
圖注:Muta™Mouse小鼠被植入了一種λDNA記錄體細胞突變,提取λDNA放入大腸桿菌中,後者會根據突變結果改變顏色,由此來計算突變頻率
“我們衰老,是因為我們的基因組在不斷地被破壞。”Jan Vijg教授如是説。在幾十年對這一命題的深入探索後,如今,他與團隊回顧了眾多幹預策略,提出了一個愈發明確的方向:不是隻等DNA損傷發生後才去處理,而是可以關注從源頭激活細胞自身的修復機制。
除了是遺傳學家,Jan Vijg教授還是一位敢於走出專業領域,思考技術、社會乃至文明演進的公共知識分子。
他不僅是多家生物技術公司的創始人,還先後撰寫了《基因組衰老》、《美國的技術挑戰》和《創造我們現代世界的信仰與財富》三本著作,並獲得了Brian Kennedy教授在內的多為同行的高度評價。

圖注:Brian Kennedy教授評價《美國的技術挑戰》
這些書彰顯了一位遺傳學家對人類命運的一種整體性視角。或許在Jan Vijg教授的內心,也會縈繞這樣一個疑問:如果科技能延長生命,我們是否準備好從社會、道德和宗教層面去接受這種變化?

2025年9月20-21日,時光派第六屆衰老幹預論壇將盛大開幕!Jan Vijg教授也將親臨現場發表精彩演講。如果對他或本研究感興趣,歡迎參加本次論壇與他進行面對面交流,還有機會聆聽來自全球各地數十位衰老生物學界頂尖學者分享的最新研究成果和前沿見解!
參考文獻
[1] Bujarrabal-Dueso, A., Garinis, G.A., Robbins, P.D. et al. Targeting DNA damage in ageing: towards supercharging DNA repair. Nat Rev Drug Discov (2025).
[2] Zhou, B. B., & Elledge, S. J. (2000). The DNA damage response: putting checkpoints in perspective. Nature, 408(6811), 433–439.
[3] Cagan, A., Baez-Ortega, A., Brzozowska, N., Abascal, F., Coorens, T. H. H., Sanders, M. A., Lawson, A. R. J., Harvey, L. M. R., Bhosle, S., Jones, D., Alcantara, R. E., Butler, T. M., Hooks, Y., Roberts, K., Anderson, E., Lunn, S., Flach, E., Spiro, S., Januszczak, I., Wrigglesworth, E., … Martincorena, I. (2022). Somatic mutation rates scale with lifespan across mammals. Nature, 604(7906), 517–524.
[4] Gonzales, M.M., Garbarino, V.R., Kautz, T.F. et al. Senolytic therapy in mild Alzheimer’s disease: a phase 1 feasibility trial. Nat Med 29, 2481–2488 (2023).
[5] Fang, E. F., Scheibye-Knudsen, M., Brace, L. E., Kassahun, H., SenGupta, T., Nilsen, H., Mitchell, J. R., Croteau, D. L., & Bohr, V. A. (2014). Defective mitophagy in XPA via PARP-1 hyperactivation and NAD(+)/SIRT1 reduction. Cell, 157(4), 882–896.
[6] Fang, E. F., Kassahun, H., Croteau, D. L., Scheibye-Knudsen, M., Marosi, K., Lu, H., Shamanna, R. A., Kalyanasundaram, S., Bollineni, R. C., Wilson, M. A., Iser, W. B., Wollman, B. N., Morevati, M., Li, J., Kerr, J. S., Lu, Q., Waltz, T. B., Tian, J., Sinclair, D. A., Mattson, M. P., … Bohr, V. A. (2016). NAD+ Replenishment Improves Lifespan and Healthspan in Ataxia Telangiectasia Models via Mitophagy and DNA Repair. Cell metabolism, 24(4), 566–581.
[7] Norheim, K. L., Ben Ezra, M., Heckenbach, I., Andreasson, L. M., Eriksen, L. L., Dyhre-Petersen, N., Damgaard, M. V., Berglind, M., Pricolo, L., Sampson, D., Dellinger, R. W., Sverrild, A., Treebak, J. T., Ditlev, S. B., Porsbjerg, C., & Scheibye-Knudsen, M. (2024). Effect of nicotinamide riboside on airway inflammation in COPD: a randomized, placebo-controlled trial. Nature aging, 4(12), 1772–1781.
[8] Murray, A., Gough, G., Cindrić, A., Vučković, F., Koschut, D., Borelli, V., Petrović, D. J., Bekavac, A., Plećaš, A., Hribljan, V., Brunmeir, R., Jurić, J., Pučić-Baković, M., Slana, A., Deriš, H., Frkatović, A., Groet, J., O’Brien, N. L., Chen, H. Y., Yeap, Y. J., … Nižetić, D. (2023). Dose imbalance of DYRK1A kinase causes systemic progeroid status in Down syndrome by increasing the un-repaired DNA damage and reducing LaminB1 levels. EBioMedicine, 94, 104692.[9] Koblan, L. W., Erdos, M. R., Wilson, C., Cabral, W. A., Levy, J. M., Xiong, Z. M., Tavarez, U. L., Davison, L. M., Gete, Y. G., Mao, X., Newby, G. A., Doherty, S. P., Narisu, N., Sheng, Q., Krilow, C., Lin, C. Y., Gordon, L. B., Cao, K., Collins, F. S., Brown, J. D., … Liu, D. R. (2021). In vivo base editing rescues Hutchinson-Gilford progeria syndrome in mice. Nature, 589(7843), 608–614.
[10] Wang, S., Min, Z., Ji, Q., Geng, L., Su, Y., Liu, Z., Hu, H., Wang, L., Zhang, W., Suzuiki, K., Huang, Y., Zhang, P., Tang, T. S., Qu, J., Yu, Y., Liu, G. H., & Qiao, J. (2020). Rescue of premature aging defects in Cockayne syndrome stem cells by CRISPR/Cas9-mediated gene correction. Protein & cell, 11(1), 1–22.
[11] Emanuele, E., Spencer, J. M., & Braun, M. (2014). An experimental double-blind irradiation study of a novel topical product (TPF 50) compared to other topical products with DNA repair enzymes, antioxidants, and growth factors with sunscreens: implications for preventing skin aging and cancer.
[12] Paine, P. T., Rechsteiner, C., Morandini, F., Desdín-Micó, G., Mrabti, C., Parras, A., Haghani, A., Brooke, R., Horvath, S., Seluanov, A., Gorbunova, V., & Ocampo, A. (2024). Initiation phase cellular reprogramming ameliorates DNA damage in the ERCC1 mouse model of premature aging. Frontiers in aging, 4, 1323194.
[13] Dong, X., Milholland, B., & Vijg, J. (2016). Evidence for a limit to human lifespan. Nature, 538(7624), 257–259.
[14] https://www.npr.org/sections/health-shots/2016/10/05/496532976/has-the-human-lifespan-hit-the-ceiling?utm_source=chatgpt.com.