張鋒團隊開發新型基因編輯器NovaIscB,實現持久高效基因組編輯_風聞
艾迪基因-加速基因编辑进程,造福人类健康25分钟前
2025年5月,《Nature Biotechnology》在線發表了題為"Evolution-guided protein design of IscB for persistent epigenome editing in vivo“的研究論文。該研究由華人科學家張鋒團隊主導,研究通過整合進化引導的蛋白質工程策略,開發出新型緊湊型基因編輯器NovaIscB,併成功構建單AAV遞送的持久表觀遺傳編輯系統OMEGAoff,為慢性病基因治療提供了突破性工具。

文章亮點
1. 百倍效率的提升:通過同源基因篩選獲得高活性IscB變體OrufIscB,經REC結構域工程改造後,NovaIscB的編輯效率較野生型提升100倍,最高可達40% indel效率。
2. 精準靶向突破:有效引導RNA長度從13bp擴展至20bp,並且脱靶率顯著低於現有緊湊編輯器。
3. 單載體體內遞送:融合甲基轉移酶構建出OMEGAoff系統,NovaIscB與截短ωRNA可封裝至單AAV載體,突破大尺寸編輯器難遞送的瓶頸。
4. 持久的基因沉默:小鼠體內單次注射OMEGAoff,靶基因表達抑制持續≥6個月,血清膽固醇水平顯著降低且無肝毒性。
傳統CRISPR-Cas編輯器具有尺寸過大,難以兼容AAV載體遞送,且難以平衡高效編輯與低脱靶性的缺點。IscB作為Cas9的祖先蛋白雖具緊湊優勢,但存在編輯效率低、引導RNA短等缺陷。因此研究人員通過自然進化多樣性挖掘與蛋白質工程優化的方式,旨在開發高效精準的微型編輯器。
一、 進化引導的蛋白質設計
1. 同源基因的篩選
研究人員通過測試144個IscB及6個II-D型Cas9同源物,鑑定出高效變體OrufIscB,其編輯效率為8%,較前代提升10倍。
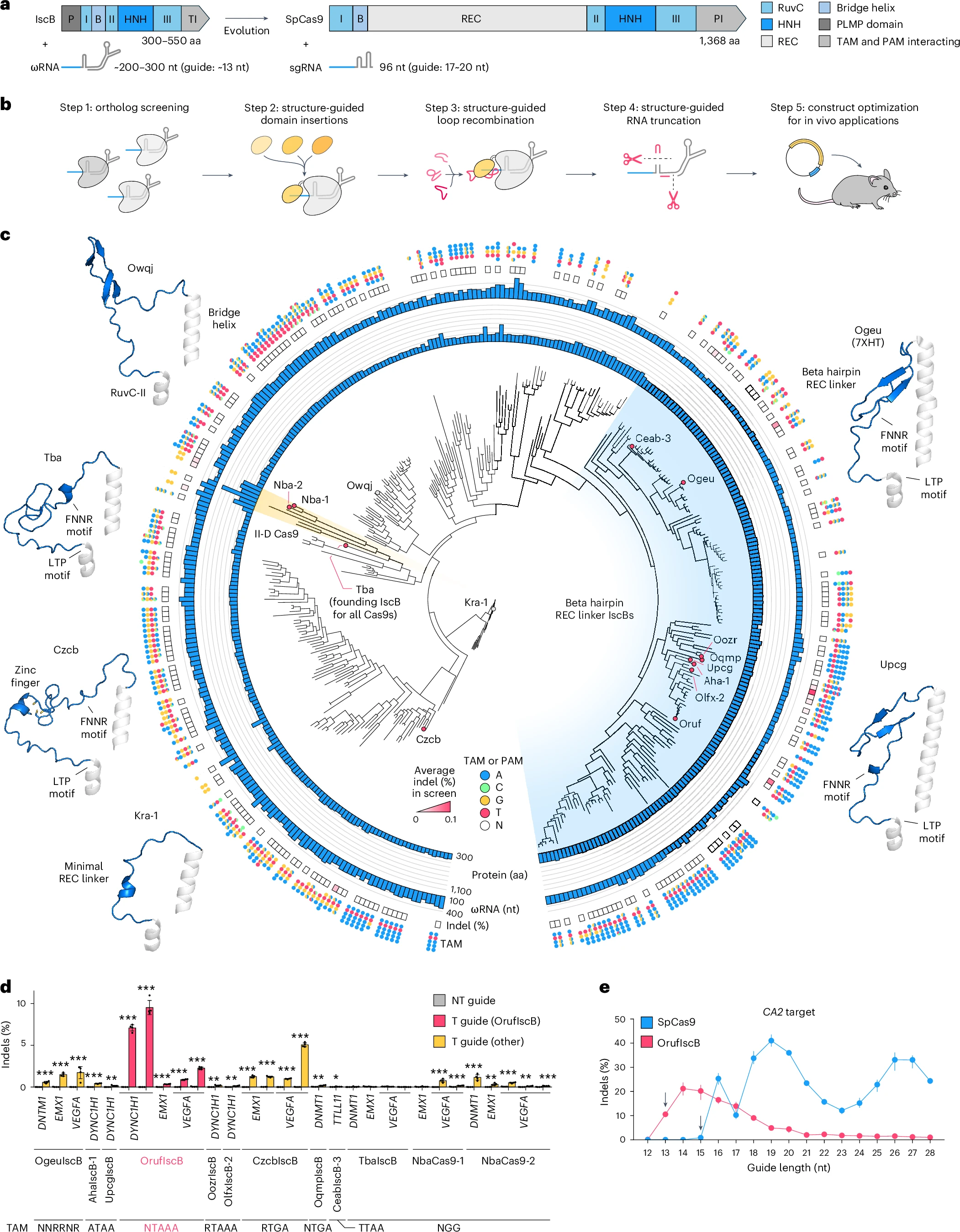
圖1. 篩選天然IscB變體2. REC結構域嵌合
研究人員將Cas9的REC識別域插入OrufIscB的保守位點,並從183個嵌合體中優選出Nba-1 REC變體,其有效引導長度增加至15bp。
3. 關鍵環區優化
通過54種REC環交換組合,最終獲得NovaIscB,其有效引導長度20bp,特異性較野生型提升200倍。
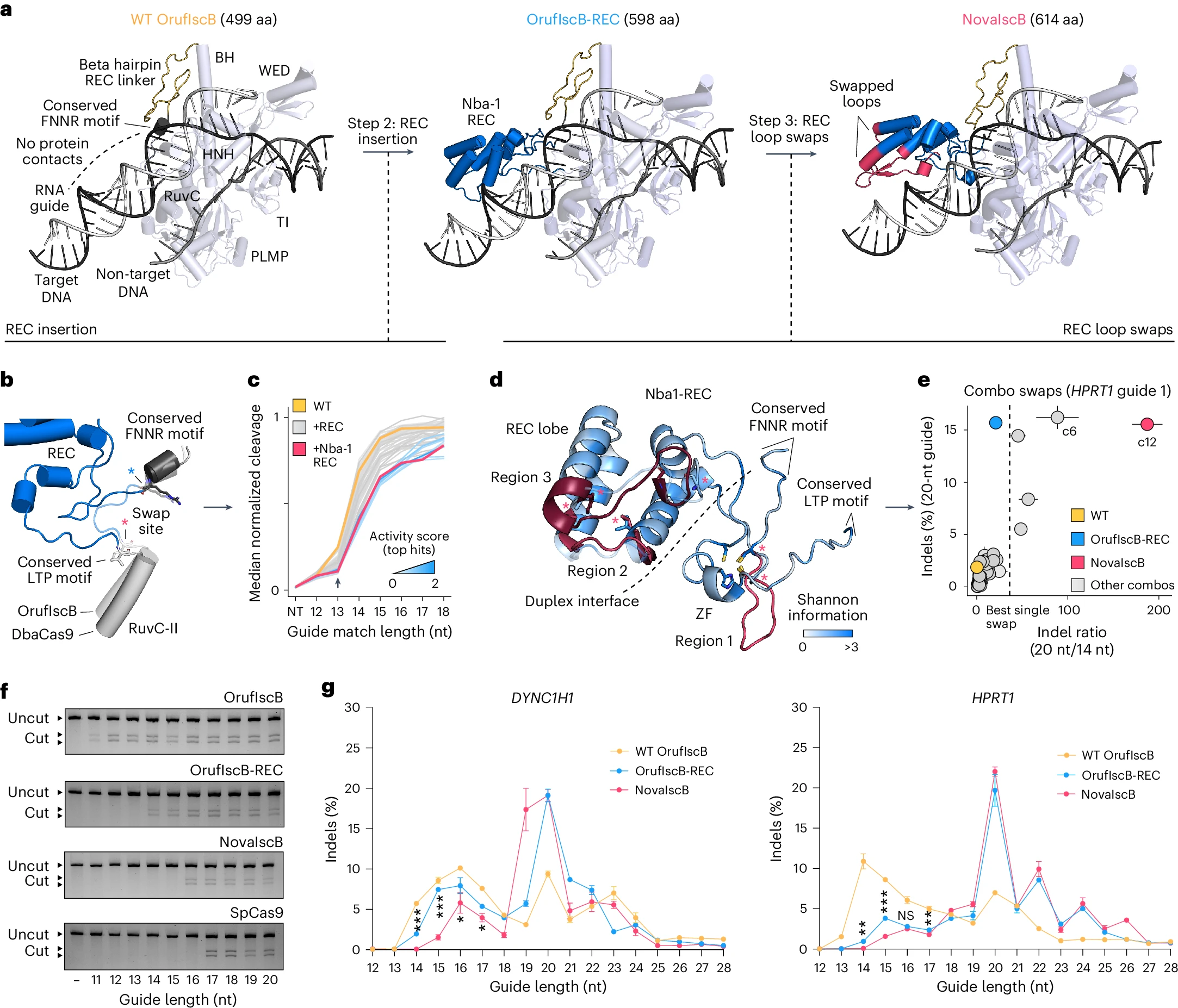
圖2. OrufIscB的重新設計以實現高效編輯二、 ωRNA工程改造
研究人員通過刪除ωRNA5’端42nt 與 3’端17nt的非必需莖環結構,使ωRNA總長從225nt降至166nt。結果顯示:截短版的ωRNA在人細胞中的表達量提升了4倍。
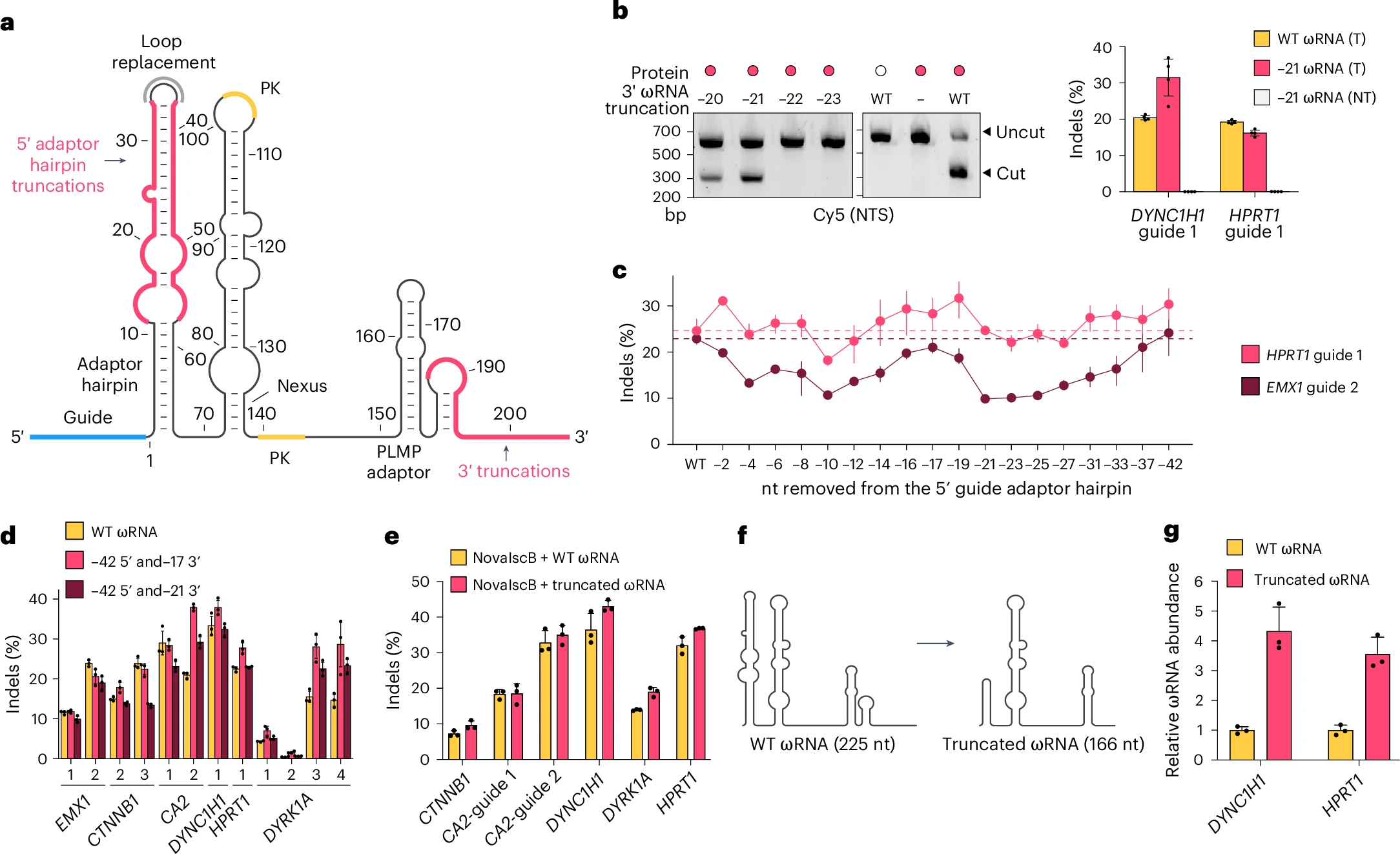
圖3. ωRNA支架的結構導向工程
三、OrufIscB可作為多功能基因組調控工具
研究人員通過融合失活型OrufIscB-KRK(RuvC/HNH結構域失活)與DNA甲基轉移酶(Dnmt3A-3L)和轉錄抑制域(KRAB),構建出了緊湊型表觀編輯器OMEGAoff。在HEK293FT和AML12細胞中OMEGAoff實現了與CRISPRoff相當的轉錄抑制效果,通過優化融合架構,靶基因表達被抑制至對照組的20%-30%。
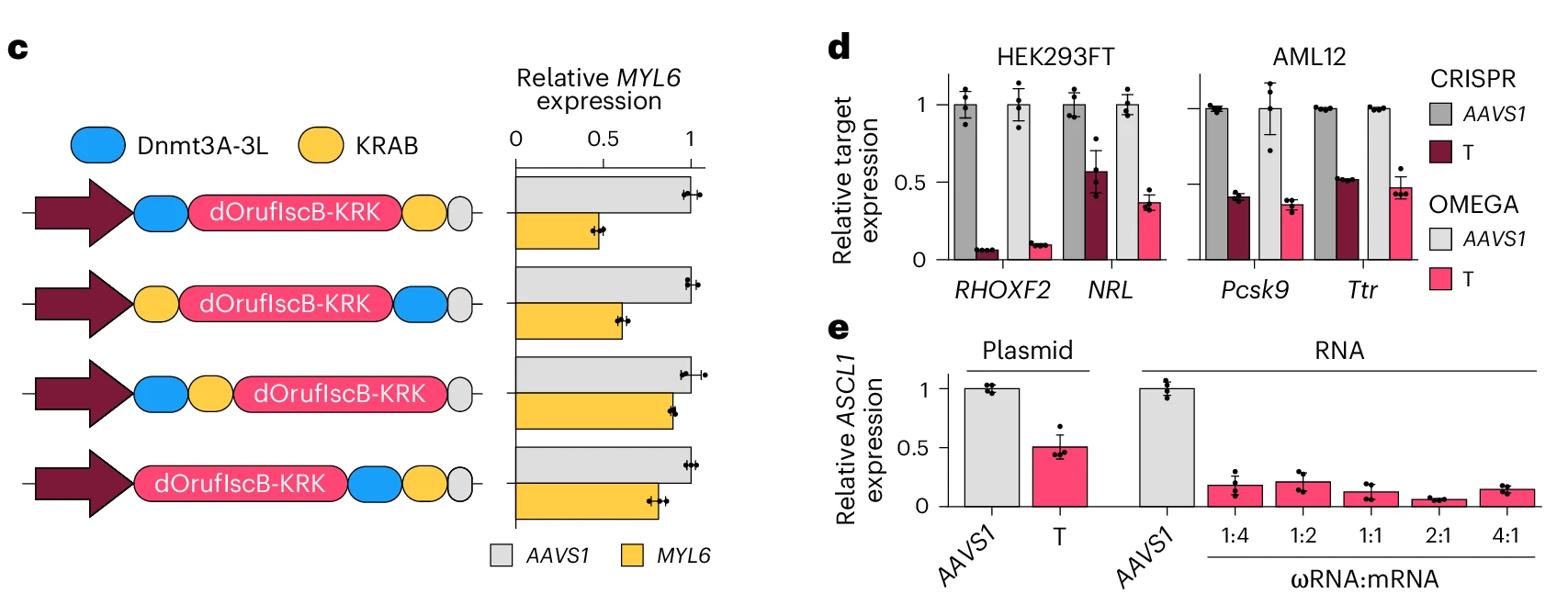
圖4. OMEGAoff與CRISPRoff相當的轉錄抑制效果
同時研究人員以每隻動物2×10*11個總病毒顆粒的劑量向小鼠靜脈內注射編碼OMEGAoff的AAVs和Pcsk 9/Rosa 26靶向指導物,並在不同時期收集小鼠血液樣品以分離血清用於測量PCSK 9蛋白和膽固醇水平。結果顯示注射3周後,靶向組血清PCSK9下降70%,膽固醇降低40%,且效果可持續6個月。在安全性方面未檢測到小鼠肝損傷標誌物(膽紅素/ALT)升高。
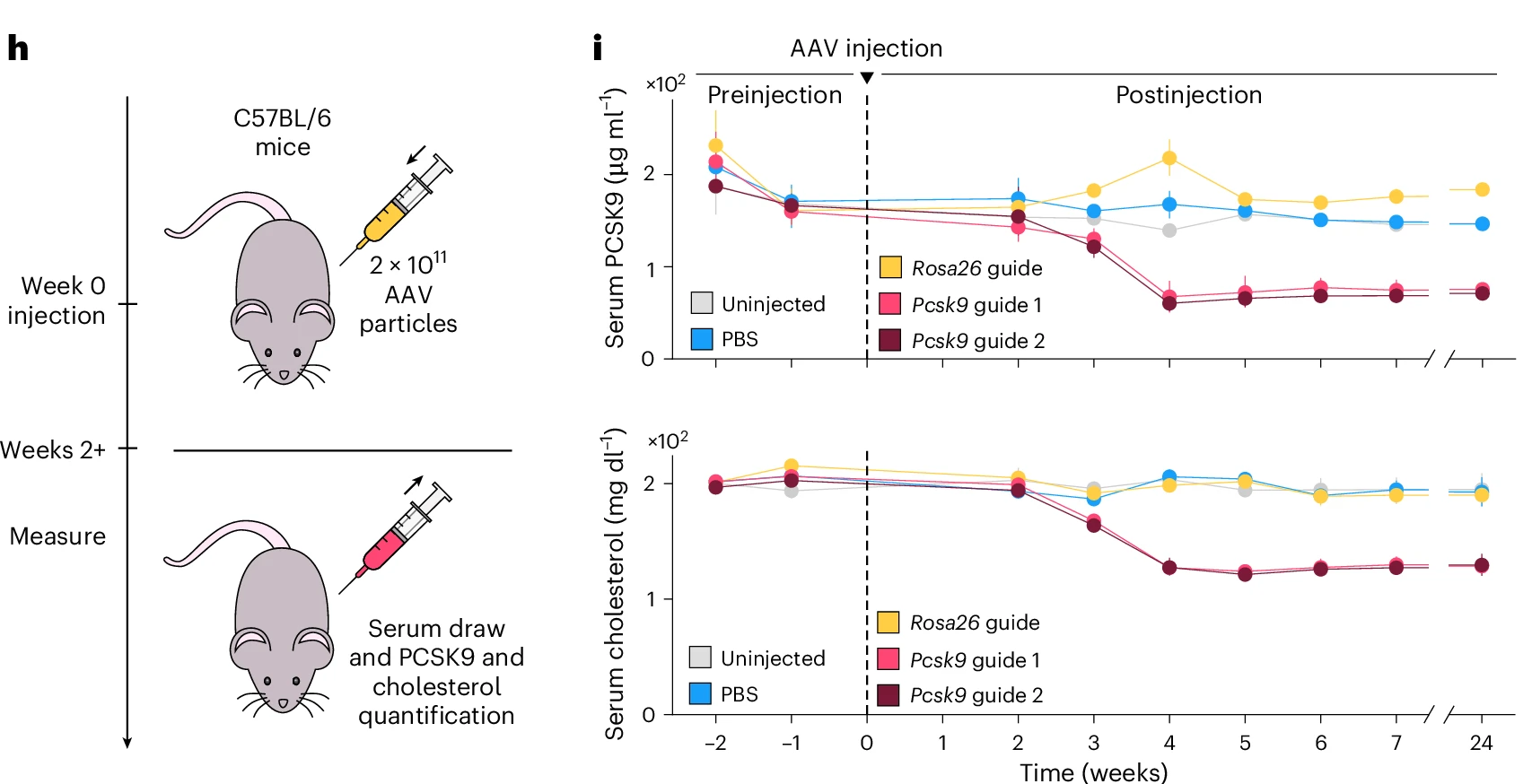
圖5. AAV遞送OMEGAoff進行體內Pcsk 9抑制的實驗及結果分析
總結與展望:
該研究通過進化引導蛋白質的工程策略,成功開發出緊湊型RNA引導核酸酶NovalscB。其融合表觀編輯器OMEGAoff在單AAV載體遞送下實現了持久性基因調控,且靶基因表達抑制持續≥6個月,血清膽固醇水平顯著降低且無肝毒性,證明了其在慢性疾病治療中的潛力,為慢性病基因治療提供了突破性工具。