缺硒意外激活體內“續命菌菌”? Akk菌逆風爆發,修補腸道屏障延緩衰老!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯49分钟前

你是否有過這種身體被掏空的感覺?在放肆熬夜一整晚後,第二天身體就用一場近乎“強制關機”般的沉睡,讓你把欠下的“睡眠債”連本帶利地還回來。這是我們身體再熟悉不過的代償反應—當系統受到壓力/損傷時,身體會主動調動資源,試圖找補平衡。
不過,當壓力變成衰老和營養缺乏這種更類似於“温水煮青蛙”式的持久折磨時,一場你毫不知情的“代償大戲”,可能正在你的腸道深處即時上演……
一篇發表在《Aging Cell》上的研究表明[1]:**在因缺硒而加速衰老的小鼠腸道中,Akk菌反而出現反常,瘋狂增殖!**這到底是早有預謀的趁火打劫,還是另有隱情?歡迎收看今天的《走 近 派 派》!


缺硒?可不太妙
首先,我們必須直面現實:缺硒,確實會給衰老拉響警報!
作為人體中必需的微量元素,硒在體內並不是直接發揮作用,而是作為合成硒蛋白家族的必需組分,被特異性地整合進硒代半胱氨酸中,最終構成功能強大的硒蛋白(比如有抗氧化、修復DNA功能的谷胱甘肽過氧化物酶GPXs)。
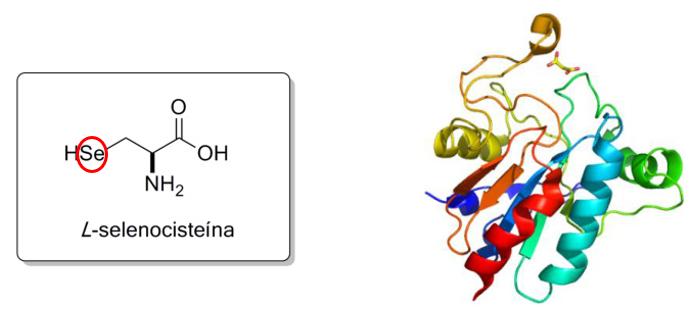
圖注:L-硒代半胱氨酸三維結構(原子色標:Se=黃,O=紅,N=藍)與蛋白結合位點
**因此,我們一般所説的身體缺硒,就是細胞沒法合成出足夠多、功能正常的硒蛋白了。**這就意味着那些原本由硒蛋白負責的清除自由基、維持基因組穩定的蛋白質等任務,會因為少了它(硒蛋白),效率大打折扣(這下想不衰老也難!)。
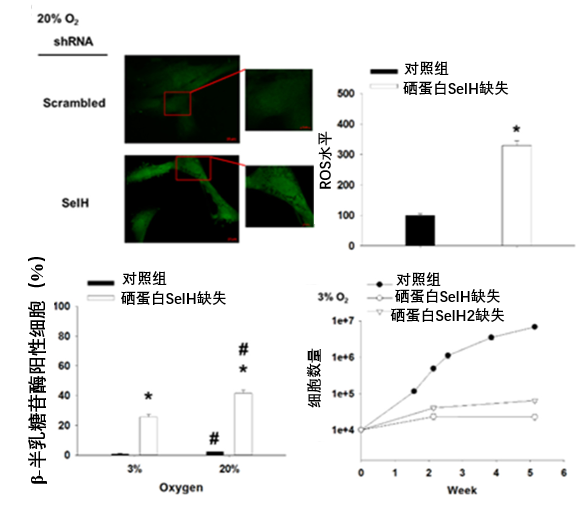
圖注:在人類成纖維細胞(MRC-5)中敲低SelH後,這些細胞表現出典型的加速衰老特徵(ROS水平增加、衰老標誌物陽性率升高、增殖停滯)[2]
動物模型中的現象則更為直觀:長期的膳食缺硒會誘發明顯的2型糖尿病症狀,血糖控制能力嚴重受損[3]……所以説不管是人還是動物,缺硒,確實是衰老和相關代謝疾病的強力“加速器”。
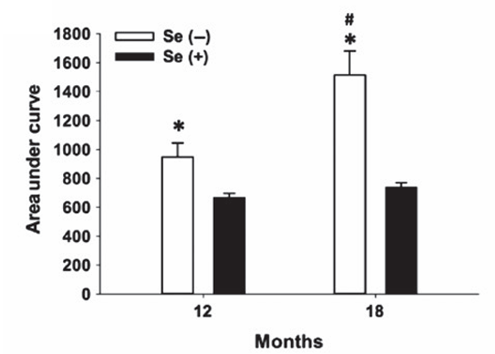
圖注:柱子越高,代表血糖控制能力越差
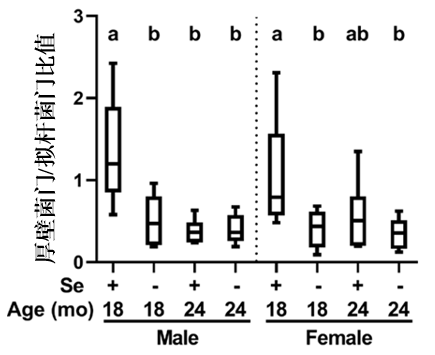
回到本篇研究,缺硒造成的壓力還發生在腸道微生態系統上,通過基因測序,科學家們發現,缺硒小鼠體內厚壁菌門/擬桿菌門的比值,出現明顯降低(其降低與肥胖、炎症以及2型糖尿病等代謝性疾病密切相關,被視為腸道菌羣失衡的一個核心標誌)。
以雄性小鼠為例,在遭受缺硒與衰老雙重“debuff”後,其體內兩種能夠產生短鏈脂肪酸(丁酸)的益生菌丰度明顯降低:梭菌綱(Clostridia)和放線菌門(Actinobacteria)(它們恰好是腸道里少數幾個“吃硒大户”)。
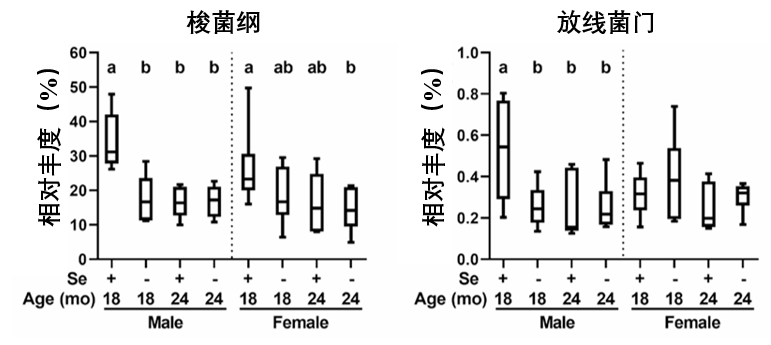
背後的邏輯其實不難理解,首先,身體缺硒,肯定會削弱腸道產生有益代謝物的能力,其次,這些同樣依賴硒的細菌,可能在與宿主的生存競爭中處於劣勢,導致其丰度下降,菌羣結構惡化(一個停不下來的惡性循環……)。


廢墟之上
然而,故事到這,難道就只是一個單向奔赴衰敗的悲劇嗎? 科學界中存在一個名為毒物興奮效應(Hormesis)的假説:一點點恰到好處的壓力或毒性刺激,反而可能激活生物體內的適應性保護機制,甚至帶來延壽益處[4]。
而在缺硒這個明確的壓力源之下,並非所有物種都走向衰敗,有個菌菌的響應方式堪稱反常,其丰度並非像其他有益菌那樣減少,反而出現激增——Akk菌!

數據顯示,Akk有着驚人的增長幅度**:與年輕健康的雄性小鼠相比,僅是膳食缺硒這個因素,就能使腸道內Akk菌的丰度飆升22倍;而自然衰老(18—24月齡)則增加了38倍**。在缺硒與衰老的雙重壓力下,Akk菌幾乎成為了腸道菌羣中絕對的優勢物種。
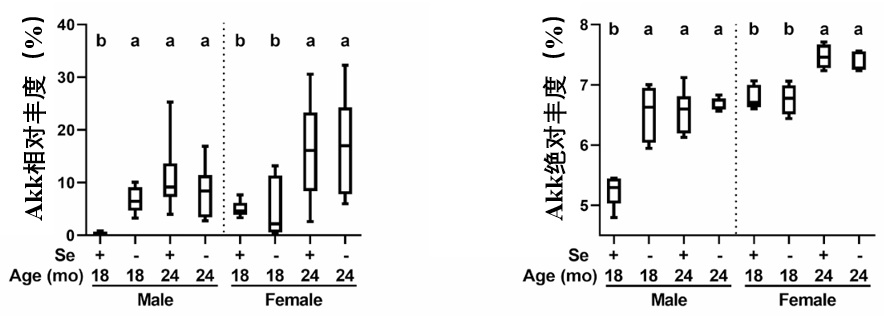
簡單回顧一下Akk菌(Akkermansia muciniphila)。作為人體內腸道菌的一種,它能在我們腸道里啃食黏液,順便產生有益代謝物[5]。過往研究均表明,Akk能加速傷口癒合,修復腸粘膜,改善代謝紊亂,減少炎症,甚至是給鼠鼠“+1s”,具有延壽潛力。
有點意思……一個公認的“好菌”,在一個明確有害的環境(衰老且缺硒)裏,反而混的風生水起?難道説Akk菌的崛起,正是身體在絕境中啓動的強大代償機制?但問題是,這根獨苗的力量,是否足以挽救這場健康危機?

英雄還是惡棍?
直接上實驗,看看Akk療效如何,科學家們給那些因缺硒而出現2型糖尿病症狀的小鼠,安排了一波Akk菌口服大餐。結果表明,Akk菌給這些小鼠的狀態帶來了肉眼可見的改善:
改善小鼠糖代謝紊亂
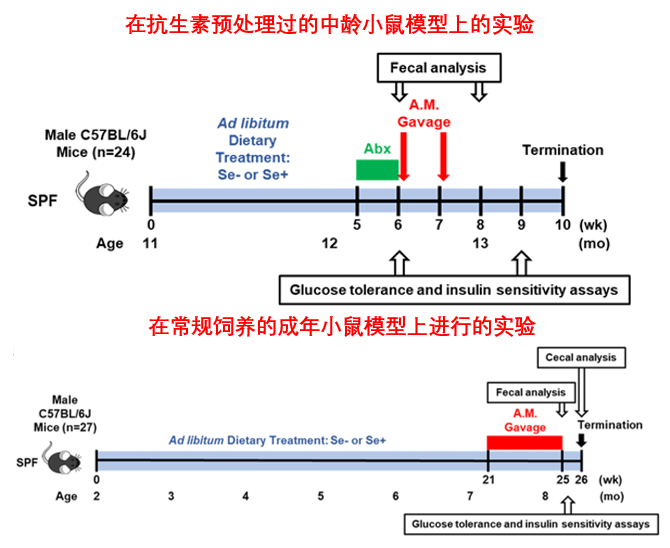
無論小鼠是否經過抗生素預處理,補充 Akk 菌都能一致性地改善其葡萄糖耐量(處理葡萄糖的能力)和胰島素敏感性,並且降低缺硒小鼠在空腹狀態下的血糖和胰島素水平,使其趨近健康水平。
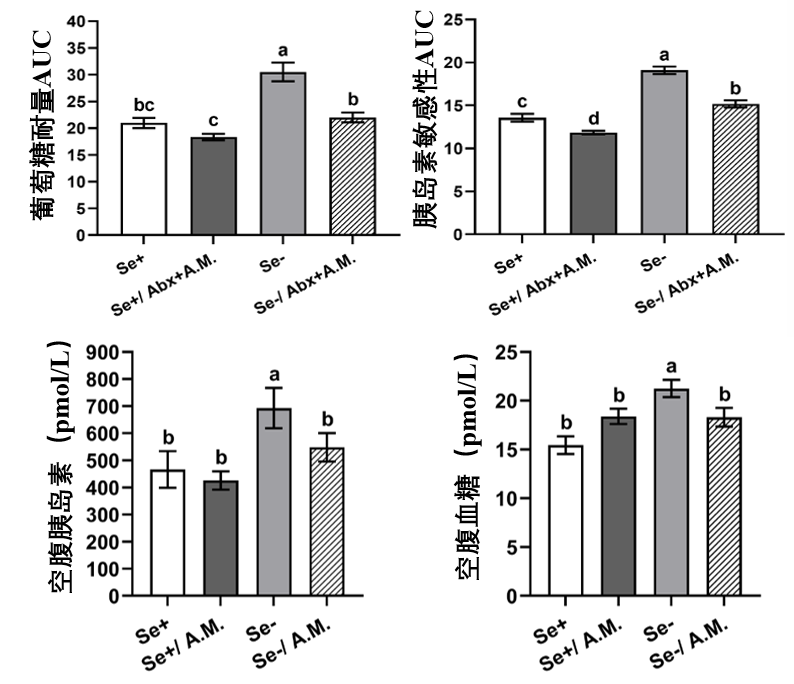
圖注:Se+、-代表是否缺硒,Abx為抗生素預處理,A.M.為餵食Akk(四個指標均為數值越低越好)
幫助修復受損腸道屏障、平息炎症
腸道屏障是我們抵禦外界有害物質的第一道防線。缺硒會導致小鼠結腸的黏液層厚度變薄,補充Akk菌不僅能幫助恢復腸道屏障厚度,同時還能上調腸道上皮細胞間負責連接和密封的關鍵蛋白(如ZO-1, Ocln, Cldn3)的基因表達,從根本上改善腸漏現象。
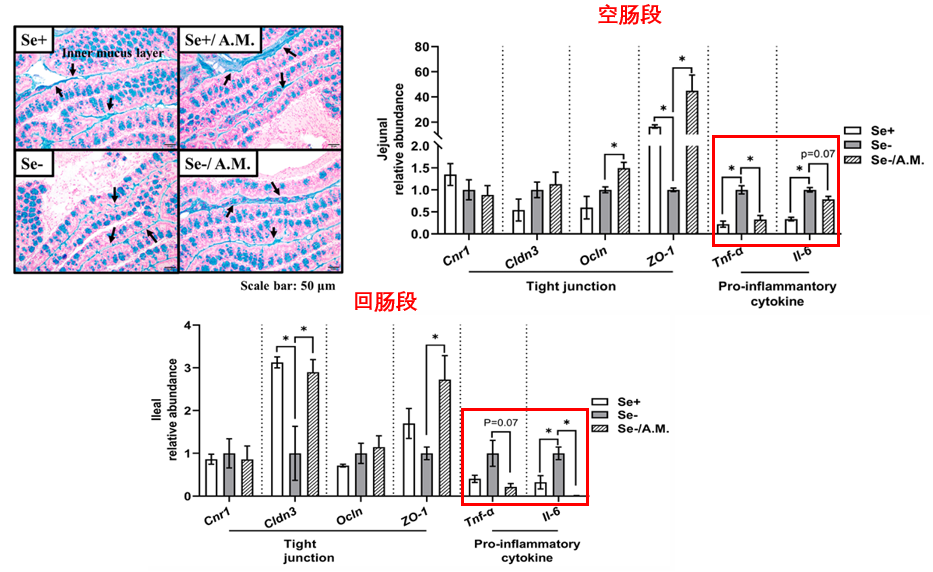
圖注:Se+、-代表是否缺硒,A.M.為餵食Akk,箭頭所指位置為腸道內黏液層
隨着腸道屏障功能的完備,腸道內毒素的泄漏問題也得到改善:缺硒小鼠血液中脂多糖(LPS,引發全身性低度炎症的罪魁禍首)的濃度出現降低,源頭得到控制,下游腸道局部的炎症反應也就跟着緩解,促炎因子Tnf-α,Il-6的表達降低(見上圖紅框處)。
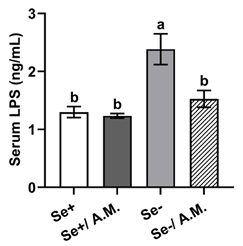
圖注:Akk處理後LPS濃度降低
重塑腸道菌羣微生態
最後,Akk菌還展現了其重塑整個腸道菌羣微生態的強大能力。Akk菌的干預使得腸道內一些潛在的致病菌(如大腸桿菌)的增長得到抑制。與此同時,其他重要的有益菌,如乳桿菌(Lactobacillus)和被譽為抗炎明星的普拉梭菌(F. prausnitzii)的丰度則有增長趨勢。
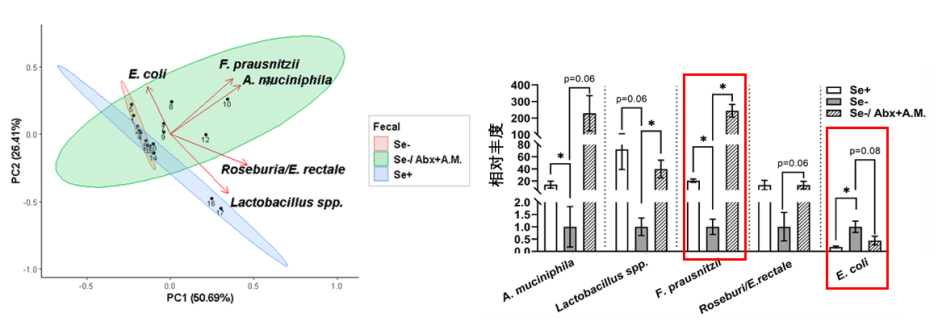
圖注:Se+、-代表是否缺硒,Abx為抗生素預處理,A.M.為餵食Akk
綜上,結論清晰明瞭:在衰老與缺硒的雙重壓力下,Akk菌的富集,並非病理性的副作用,恰恰相反,它是一種具有明確生理功能的,積極的“自救”反應。

從被動自救到主動共生
不過,在相對年輕、健康的野生型小鼠中,缺硒這個單一因素,並不能有效的召喚Akk菌……這種“自救”機制,似乎是有條件的——只有機體衰老時才發生。
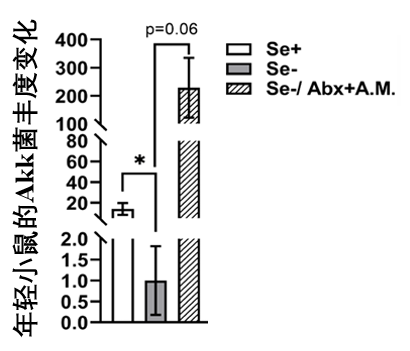
圖注:Se+、-代表是否缺硒,Abx為抗生素預處理,A.M.為餵食Akk
這也表明了衰老的一個重要特徵:它是系統韌性(resilience)的逐漸喪失,年輕的身體就像一艘牢固的的船,能輕鬆應對各種突發狀況(類似營養缺乏等等危險),而衰老的身體在遭遇同樣強度的“風浪”時,還可能會有翻船危險。

正是在這種常規調節失靈,系統即將崩盤的危急時刻,身體才會被逼無奈,啓動更為極端的補償機制,比如主動改變腸道微環境,為Akk菌創造生存優勢,以此來挽救健康危局。
然而,理解身體這種略帶悲壯的自救模式,絕不是為了讓我們去模仿**(再次強調:缺硒的健康損害非常大!)**。恰恰相反,與其等到系統瀕臨崩潰時才做出行動,我們不如主動“未雨綢繆”,去壯大我們體內的那些小小好菌!
既然Akk菌愛吃腸道黏液,那我們就主動投餵?補充一些能促進黏液分泌和有益菌生長的食物,比如富含膳食纖維的菊粉,或者是富含植物多酚的藍莓、綠茶、黑巧克力等等,幫助身體維持穩態,防止它在危急時刻啓動補償機制。

聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Huang, Y. C., Lu, H. Y., Zhang, L., Olivier, A., Wu, T. L., Hsu, C. Y., LeGrand, C., Zeng, H., Curran, S., Wang, Q., Nannapaneni, R., Zhang, X., Ticó, M., Mariotti, M., Wu, R. T. Y., Combs, G. F., Jr, & Cheng, W. H. (2025). Dietary Selenium Deficiency Accelerates the Onset of Aging-Related Gut Microbial Changes in Aged Telomere-Humanized Mice, With Akkermansia muciniphila Being the Most Prominent and Alleviating Selenium Deficiency-Induced Type 2 Diabetes. Aging cell, e70130. Advance online publication. https://doi.org/10.1111/acel.70130
[2] Wu, R. T., Cao, L., Chen, B. P., & Cheng, W. H. (2014). Selenoprotein H suppresses cellular senescence through genome maintenance and redox regulation. The Journal of biological chemistry, 289(49), 34378–34388. https://doi.org/10.1074/jbc.M114.611970
[3] Wu, R. T., Cao, L., Mattson, E., T. Y., & Cheng, W.H. (2017). Opposing impacts on healthspan and longevity by limiting dietary selenium in telomere dysfunctional mice. Aging Cell, 16(1), 125–135. https://doi.org/10.1111/acel.12529
[4] Yim, S. H., Clish, C. B., & Gladyshev, V. N. (2019). Selenium Deficiency Is Associated with Pro-longevity Mechanisms. Cell reports, 27(9), 2785–2797.e3. https://doi.org/10.1016/j.celrep.2019.05.001
[5] van Passel, M. W., Kant, R., Zoetendal, E. G., Plugge, C. M., Derrien, M., Malfatti, S. A., Chain, P. S., Woyke, T., Palva, A., de Vos, W. M., & Smidt, H. (2011). The genome of Akkermansia muciniphila, a dedicated intestinal mucin degrader, and its use in exploring intestinal metagenomes. PloS one, 6(3), e16876. https://doi.org/10.1371/journal.pone.0016876