最新,日本研究生孩子,不需要男人了?_風聞
环行星球-环行星球官方账号-59分钟前
近日,日本大阪大學發育遺傳學家林克彥教授宣佈,他的團隊正在快速推進一項人類體外配子生成技術,能將成人的皮膚或血細胞轉化為卵子與精子,精卵結合,誕育新生命。這一顛覆性技術,預計 7 年後就可實現。
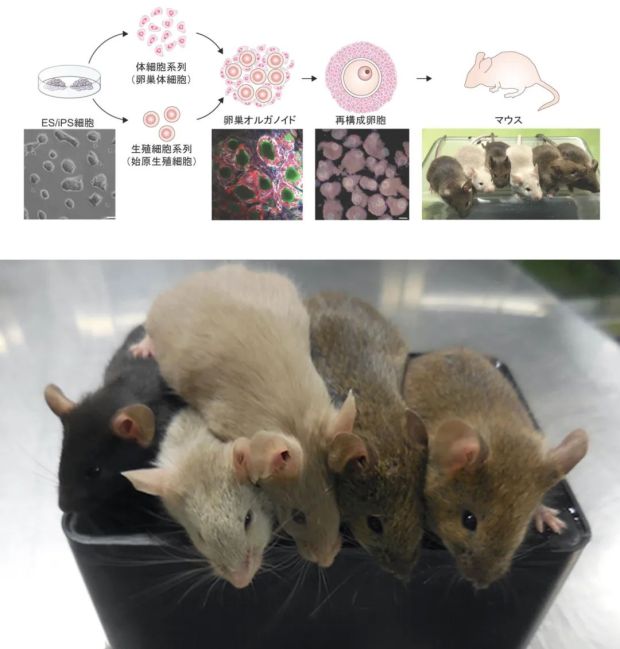
其團隊曾經僅使用雄性細胞就培育出了小鼠幼崽
圖:大阪大學
這很容易讓人聯想到我們熟悉的克隆技術。不過兩者有很大區別:克隆技術是把普通細胞的細胞核放進去掉細胞核的卵子裏,而這項新技術則是直接把普通細胞培養成精子和卵子。技術難度與克隆相比,不是一個量級的。

第一個從成年細胞克隆出來的哺乳動物多利
圖:壹圖網
林教授認為,這項技術未來或許能解決人口老齡化和生育率下降問題。
這項技術如果成功實現,將對人類社會帶來巨大的衝擊。一方面可能會徹底改變人類生殖醫學的格局,為不孕不育患者帶來新希望;另一方面,也會讓我們重新思考生命起源、倫理邊界等問題。
讓熟雞蛋變回生雞蛋
要理解這項技術,我們不妨先了解一下自然狀態下精子和卵子的形成過程。
眾所周知,精子生成於男性的睾丸——睾丸中的原始生殖細胞會不斷分裂,一部分保留為幹細胞,另一部分發育為初級精母細胞。
初級精母細胞再經過兩次分裂,最終形成4個精子細胞。此後,精子細胞會經歷“變形”,長出尾巴,最終成為成熟精子。成年男性每天能產生數千萬至上億個精子。

顯微鏡下的人類精子
而卵子是在女性在卵巢中產生的。早在女嬰出生前,卵巢裏就已經有了約100萬~200萬個初級卵母細胞,但它們會休眠到青春期。
女性進入青春期後,每個月一般會有1個卵母細胞被選中發育。卵母細胞也會完成兩次減數分裂,變為成熟的卵子。
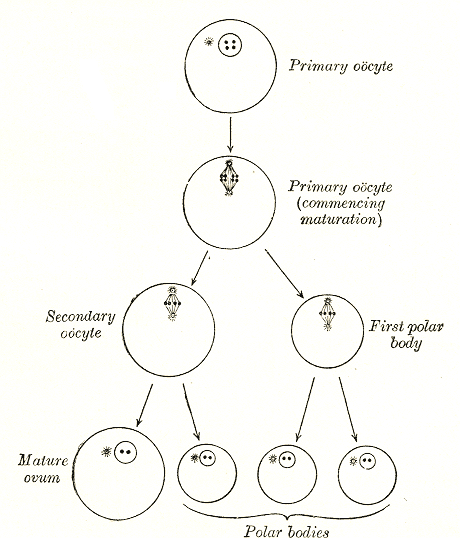
卵母細胞的減數分裂過程
圖:《人體解剖學
由此可見,精子和卵子都由特定的細胞形成。也就是説,人體這項精密的儀器早就設定好了程序,自然條件下不可能由其他細胞生成。
這項黑科技最神奇的地方在於:它能把我們身上普通的皮膚細胞“時光倒流”,變回可以製造生命的生殖細胞。這就好比,煮熟的雞蛋沒法變回生雞蛋,但這項技術就像給雞蛋施了魔法,讓它重新變回能孵出小雞的生雞蛋狀態。

讓“倒放”走進現實世界
圖:Youtube
目前,這項技術還處於實驗室研究階段,距離真正投入使用還有很長的路要走。即便未來能夠成功應用,它最主要的價值,可能還是幫助那些無法自然生育的特殊人羣。
如果現在就指望這項技術來解決人口危機,那未免太過樂觀了。畢竟除了技術難關外,還要面臨一系列棘手的倫理爭議——比如“人造生命”的道德邊界、基因編輯可能帶來的未知風險。這些絕不是短期內就能達成共識的簡單問題。

當“人類”可以被批量生產時
現有的人類社會關係,倫理,文明,法律…都將被顛覆
圖:《星球大戰前傳2:克隆人的進攻》
這項黑科技的背後,其實是日本在老齡化、低慾望、低生育社會處境下,全力發展“生育科技”的冰山一角。
焦慮的日本
日本的生育率下降經歷了三個關鍵階段:1970年代首次跌破代際更替水平(2.1),1990年代進入**“1.57衝擊"危機期**,2020年代滑向歷史最低谷。
到2022年,出生人口跌破80萬,2024年更是降至68.6萬的歷史冰點,總和生育率僅1.15,提前15年突破政府預測的"70萬警戒線”。
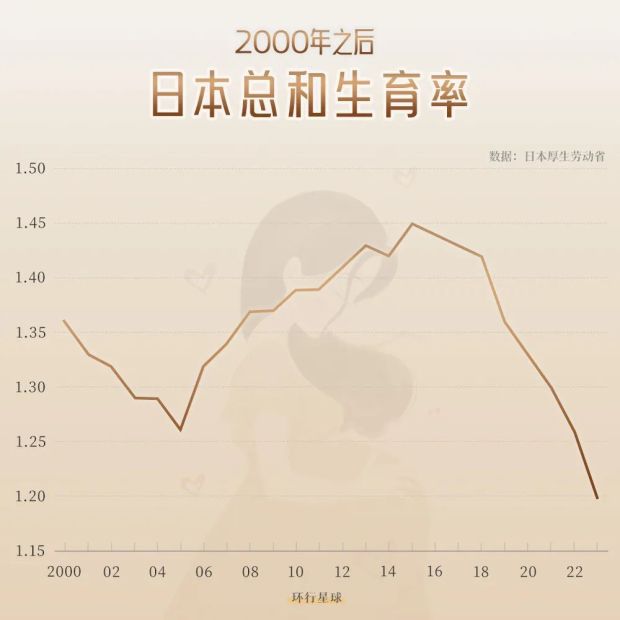
2024年,日本人口結構呈現三重危機:新生人口鋭減;老齡化加劇,65歲以上人口占比29.3%;育齡基數萎縮,15-49歲女性僅佔總人口23%。
年輕人都不生孩子,其原因大體可以總結為生活壓力太大,買房、養孩子(特別是教育和醫療)要花很多錢,上班又忙又累,怕生了娃顧不過來,也擔心工作受影響(尤其是女性)。
再加上現在年輕人想法變了,更看重個人發展,覺得結婚生孩子不是人生必選項了;而且現在的生活太豐富,不生也可以過得很好。
這幾十年來,日本政府也想了很多辦法,比如發錢鼓勵生孩子、延長產假、提供托兒服務等等,但這些措施效果都不太明顯,年輕人還是不太願意生小孩。
也因此,日本目前非常熱衷於研究前沿黑科技,希望科技發展能解決人口不足問題。
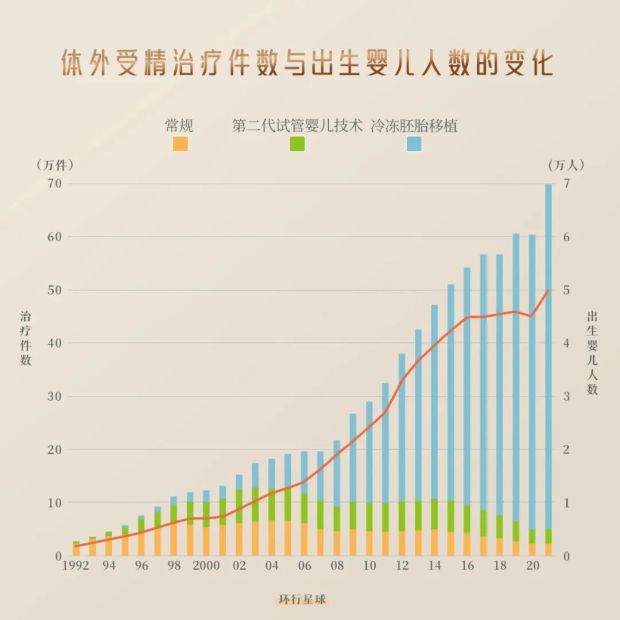
例如,自從1978年世界上首例試管嬰兒路易絲·布朗的誕生以來,這一技術使不孕不育治療成功率從最初的不足5%躍升至40-60%,為全球超過6500萬不孕不育患者帶來了生育的希望。

體外受精後再移入母親體內生長發育直至出生
圖:壹圖網
日本2021年生殖醫學統計數據顯示,通過體外受精技術誕生的新生兒數量較上年激增9416例,達到創紀錄的69797例。這一數字佔當年全國新生兒總數(811622人)的8.6%,意味着每11.6個新生兒中就有1個是藉助輔助生殖技術來到這個世界。
作為全球輔助生殖技術的領先國家,日本在該領域的研究主要集中在以下幾個前沿方向:
l 幹細胞技術:日本京都大學的研究人員利用人類誘導多能幹細胞,大量培養出前精原細胞和卵原細胞。
l 薄膜法SEET和二階段胚胎移植:由日本英醫院院長鹽谷雅英發明,可以極大地提高了胚胎着牀的成功率和妊娠成功率。
l 選擇性單胚胎移植:可顯著減少多胎妊娠帶來的併發症。
而在日本民間,人們已經普遍接受通過新技術來孕育下一代。
就比如在輔助生殖技術應用強度方面,日本的表現尤為突出。統計顯示,日本每萬名20-44歲育齡婦女接受的輔助生殖治療週期數超過270次,這一數據與以色列並列全球首位。
更為瘋狂的是,2023 年 10 月,日本沖繩一家企業利用“人造子宮”成功培育出鯊魚,可以説是完成美國和以色列未完成的人造子宮實驗。
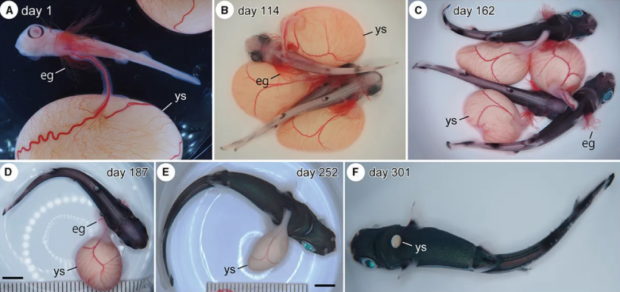
成功的實驗證明了中期胎生鯊魚胚胎可以在“人工子宮液”內生存
延長了圈養維持期,減少中期胚胎在孵化過程中的死亡率
圖:《Frontiers in Fish Science 2024》
人造子宮
人造子宮技術堪稱現代生殖醫學的巔峯之作,其核心在於通過精密的人工裝置,完美復刻母體子宮的生理環境、營養供給和生長條件,使胚胎能夠在體外完成從着牀到分娩的全過程發育。
這項技術一旦成熟,將徹底改寫人類繁衍的基本範式。
概念的提出可追溯至1923年,英國著名生理學家霍爾丹(John Burdon Sanderson Haldane,1892-1964)在其著作《代達羅斯,或科學與未來》中首次提出"體外發育"的設想。他設想在21世紀,人類生育將突破自然限制,預計70%的新生兒可能來自人工培育環境。
人造子宮技術的雛形可追溯至1954年,美國科學家格林伯格(Emanuel M. Greenberg)率先提出了這一概念的專利申請。該專利詳細描述了一種能夠模擬母體子宮生理環境的裝置,理論上可實現胚胎在體外環境的完整發育。
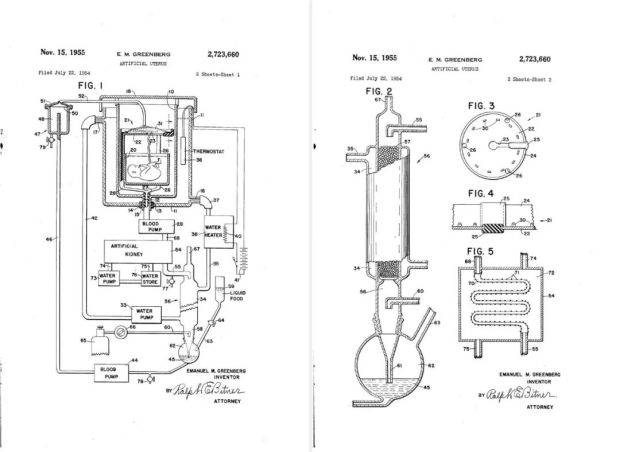
專利中的人造子宮設計圖
圖:GREENBERG EMANUEL M
經過近四十年的理論探索與技術積累,1996年,日本東京大學的研究團隊率先開展宮外胚胎培育實驗。
研究人員將14個山羊胚胎置於自主研發的人造子宮裝置中,這些胚胎在人造子宮環境中成功存活併發育了整整三週,期間各項生理指標均顯示正常發育態勢。
然而受限於當時的技術條件,所有胚胎在第三週末均未能繼續存活。儘管如此,該實驗仍為後續研究提供了寶貴的經驗。
此次突破性實驗後,全球範圍內掀起了人造子宮研究的新浪潮,各國科研機構紛紛加大投入。
但迄今為止,人造子宮技術仍主要停留在動物實驗階段。
雖然包括美國費城兒童醫院、日本東京大學以及鄭州大學第一附屬醫院的多個研究小組,已相繼宣佈多種生物在體外培育成功。但這些成果距離實現人類胚胎全程體外發育仍存在顯著差距。
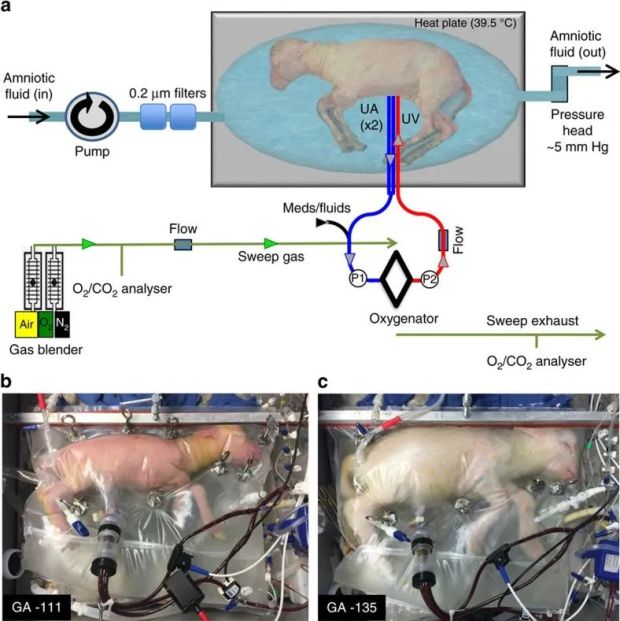
用於培育羔羊胎兒的宮外生命支持系統,又稱“生物袋”
圖:《Nature Communications》
當前,這項技術最具現實意義的應用方向,是作為“生命橋樑”,為極早產兒(22-28周)提供延續生命的體外支持系統。這種設備能夠模擬子宮環境,為早產兒爭取寶貴的發育時間。
而要實現從受精卵到足月胎兒的全程體外培育,仍面臨着生理維持、免疫調節、神經發育等多重技術瓶頸。
圖:《黑客帝國》
此外,人造子宮技術的實現,同樣會面臨着諸多倫理爭議。從生命倫理學的角度來看,首先是對“母親”的重新定義,體外培育是否會削弱親子情感紐帶?
其次是技術濫用風險,比如是否會導致“定製嬰兒”的商業化?或者恐怖分子是否會利用這一技術培養新一代恐怖分子?
再者是公平性問題,高昂的費用可能造成生育資源的兩極分化。
此外,還涉及到胚胎地位的哲學與法學爭論:在體外發育過程中,何時賦予胚胎“人”的權利?
全球範圍內的人口負增長,已成為21世紀最嚴峻的社會挑戰之一。而生殖醫學領域的突破性進展,正在為這一困局提供解決方案。
然而,技術飛躍也帶來的哲學拷問:當生育完全脱離人體,**人還是人嗎?**這些技術最終是造福人類還是毀滅人類?
當你凝視深淵的時候,深淵也在凝視着你。