線粒體產能提升近50%!破解mTORC1與AMPK拮抗難題,12周修復顱骨缺損_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯19分钟前

引言
美國賓夕法尼亞州立大學團隊和西湖大學共同開發的CitraBoneQMg材料,實現mTORC1與AMPK的協同激活助力骨再生。在細胞代謝調控中,兩條經典通路長期被視為拮抗關係[1]。該檸檬酸鹽材料究竟有什麼神奇之處,讓兩大常年“打架”的通路和解呢?


骨修復需要什麼,mTORC1和AMPK如何驅動修復?
CitraBoneQMg是一種骨修復材料,其核心設計理念是將三種天然代謝物質——檸檬酸、谷氨醯胺和鎂——整合成為“細胞能量工廠的燃料包”,通過特殊工藝將其植入可降解支架中。
該支架給骨細胞提供立足點和生存空間,並緩慢釋放活性物質促進骨生長,在後期會逐漸降解,被新骨頭替代。在大鼠顱骨缺損模型中植入CitraBoneQMg後,通過12周觀測,CT影像證實骨缺損區域已基本被新骨頭高效填充[2]。
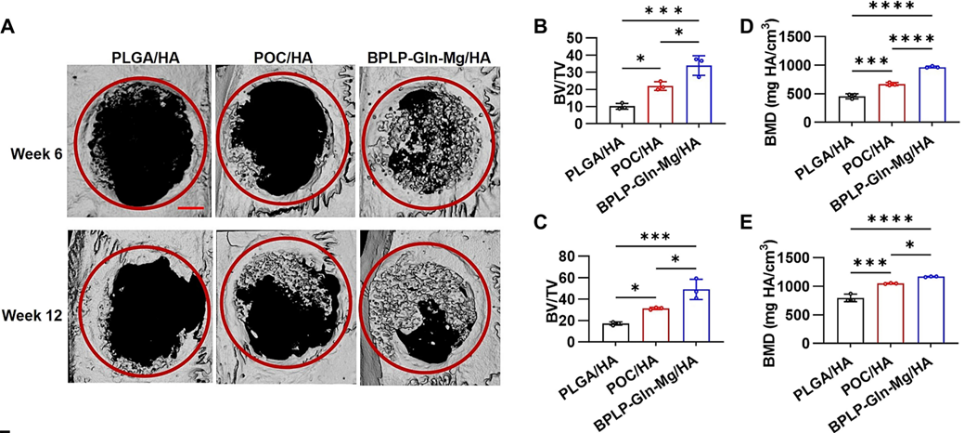
圖注:大鼠顱骨缺損實驗中,CitraBoneQMg材料促進骨再生
那麼在這類高新材料問世之前,當骨頭缺損時,我們身體的自我修復系統又是怎麼運作的呢?
在我們身體中當骨頭出現損傷時,身體裏有一羣叫“間充質幹細胞”的後備軍,這些幹細胞就會響應召喚,轉型為專門建造新骨頭的成骨細胞,開始填坑、修補,完成修復工作[2]。
這一修復過程需要大量合成和分解代謝支持。在細胞代謝調控中,主要有mTORC1和AMPK兩大代謝傳感器進行調節,也就是説骨骼修復時在理想狀態下是想要這兩個通道都激活。
mTORC1通路
營養充足時激活,促進蛋白質合成、細胞增殖(合成代謝)。
AMPK通路
能量匱乏時AMPK通路得到激活迎難而上,先後提高線粒體功能和分解代謝水平,增加ATP的合成(分解代謝)。除此之外,還抑制mTORC1,啓動分解代謝以維持生存。
熟悉派派的都知道,mTORC1和AMPK這兩個經典通道,在抗衰領域也有大作用呢。
舉個例子,經典的抗衰老藥物二甲雙胍[4]產生抗衰作用的通道主要就和這兩個有關。二甲雙胍通過抑制線粒體電子傳遞鏈複合物Ⅰ,從而激活AMPK,促進線粒體功能優化、抑制氧化應激;除此之外,AMPK的激活,也間接地抑制了mTORC1,減少蛋白質過度合成,延緩細胞衰老。

經典mTORC1和AMPK的激活途徑和二者之間的拮抗關係
傳統理論認為,這兩個通路的激活依賴於身體兩種不同的能量狀態,所以這兩條通路如同“開關”,無法同時激活。下面讓我們看看它們各自的激活途徑和經典的拮抗關係。
#能量匱乏時AMPK的激活途徑
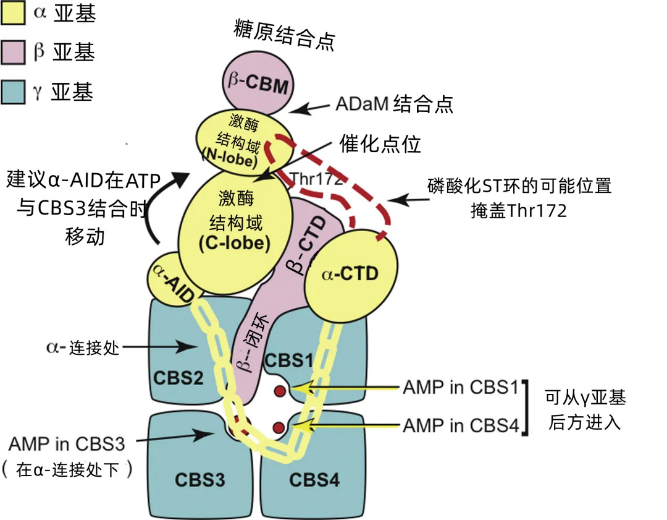
圖注:AMPK的激活途徑
在身體能量缺乏時,AMPK最常見的激活途徑在於Thr172(蘇氨酸)位點的磷酸化(激活開關)[1]。
圖注:AMPK激活的規範和非規範機制
#營養充足時mTORC1的激活途徑
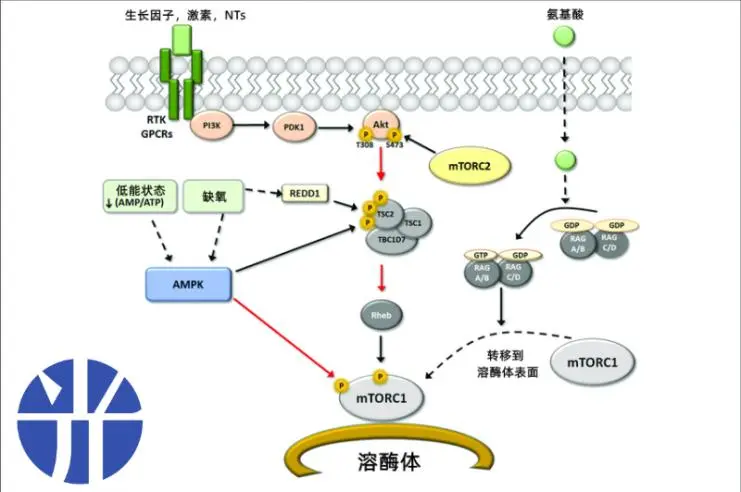
圖注:mTORC1的激活機制
mTORC1的激活途徑主要發生在溶酶體上,當身體營養充足時接受來自氨基酸和生長因子的調控[1]:
No.1
胰島素等生長因子結合細胞表面受體,溶酶體複合物中GTP(鳥苷三磷酸)的活性隨之提高,激活mTORC1通路。
No.2
亮氨酸、谷氨醯胺等關鍵氨基酸可使相關的胞質蛋白結合並在溶酶體表面相互作用,激活mTORC1。
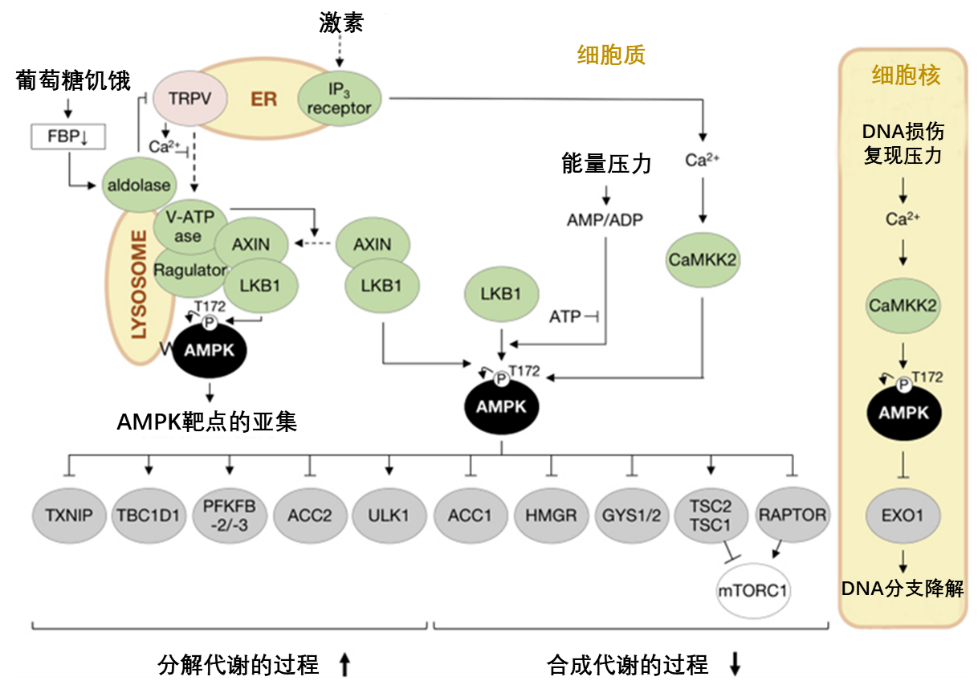
#mTORC1和AMPK之間的拮抗關係
下面我們一起看看兩條通路在身體不同能量狀態下工作時的拮抗關係。
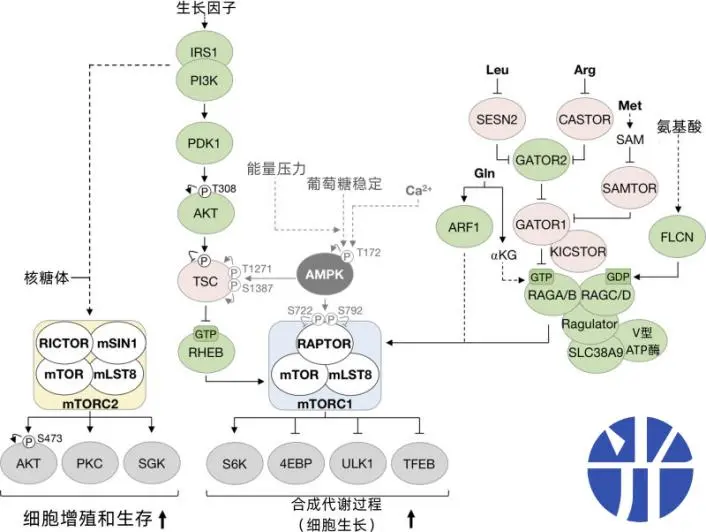
圖注:哺乳動物中mTORC1和AMPK信號通路之間的交叉作用
AMPK對mTORC1的多重抑制
當我們的機體能量匱乏時,AMPK迅速出警,通過雙重機制逮捕還在“作惡”的mTORC1[1]。
1. AMPK激活TSC2蛋白進而增強TSC1/2複合物(TSC1和TSC2蛋白複合物)活性來抑制mTORC1
2. AMPK磷酸化mTORC1的RAPTOR成分(mTORC1複合物的支架蛋白),來抑制RAPTOR的功能,進而抑制mTORC1
mTORC1或將抑制AMPK通路
當體內葡萄糖含量水平較高時,不需要AMPK再進行能量的產出,mTORC1會促進胰島素信號通路下調,從而抑制AMPK的Thr172位點處的磷酸化,進而抑制(但不完全消除)AMPK信號傳導[1]。

為什麼能夠協同激活
AMPK和mTORC1
CitraBoneQMg的神奇在於:它巧妙地讓身體裏一對原本“對着幹”的通路握手言和,聯手指揮骨細胞高效生產新骨頭!
#CitraBoneQMg同時激活AMPK和mTORC1
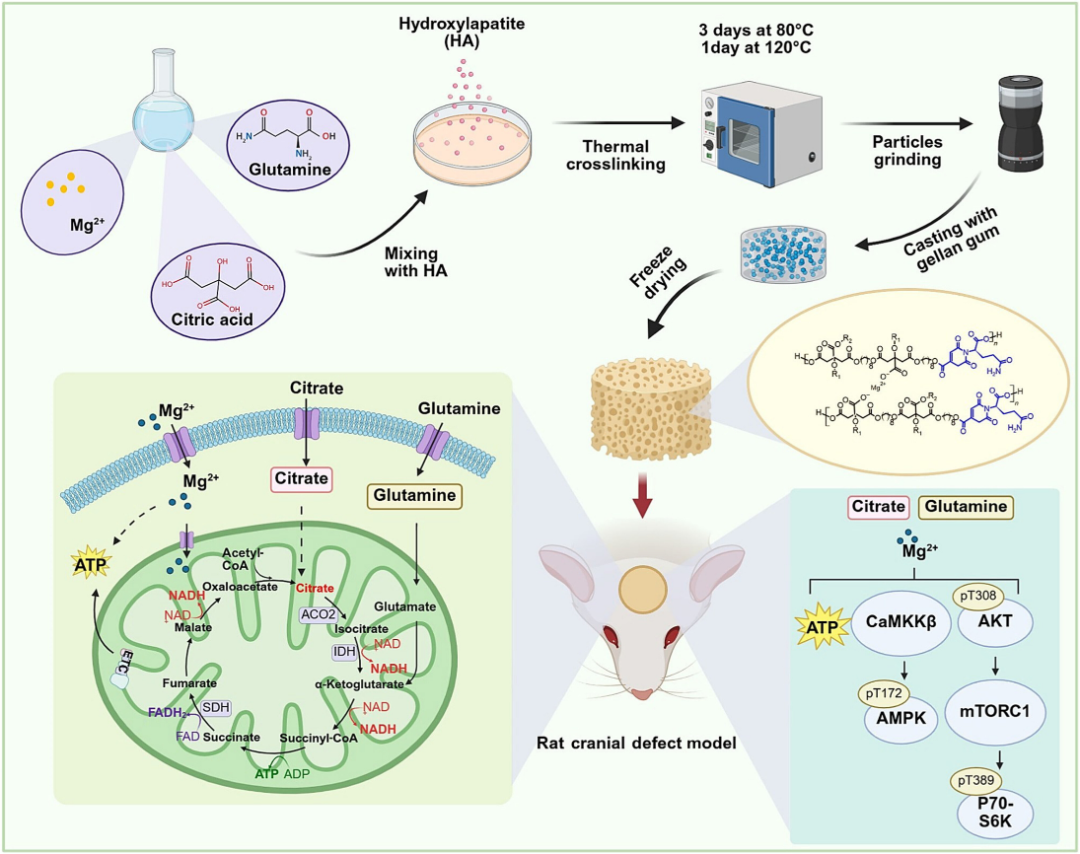
圖注:骨再生複合材料製備過程和相關的信號通路示意圖
CitraBoneQMg中的三種主要成分協同提升線粒體氧化磷酸化效率,提升細胞內ATP水平(相較於正常組提升約50%),增強總體能量的產生。
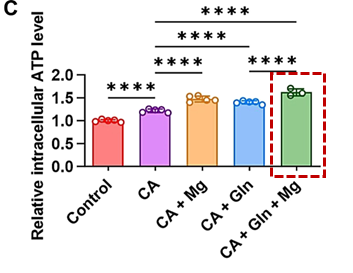
圖注:CitraBoneQMg顯著提升細胞內ATP水平
在經典理論中,當能量充盈狀態下,mTORC1會被激活,而AMPK是處於被抑制狀態。CitraBoneQMg的創新在於不僅能夠在能量充盈狀態下激活AMPK,還通過信號隔離解除二者之間的拮抗作用。
No.1
突破能量依賴:鈣信號激活AMPK
AMPK和mTORC1不能被同時激活,是因為二者在身體不同的能量狀態(主要和ATP的含量有關)下才能分別被激活。
先前我們説,AMPK需感知機體處於能量匱乏狀態才能激活,而研究人員發現,除了常見的依賴於低能量狀態的途徑外,上游激酶CaMKK2(Ca2+/鈣調蛋白依賴性激酶)同樣能激活AMPK通路,甚至在營養充足時也能被激活 [3]。
當細胞內接收到檸檬酸、谷氨醯胺和鎂離子這三種“信號分子”時,它們會共同作用,提高細胞內部的鈣離子濃度。緊接着,升高的鈣離子會激活CaMKK2,從而直接激活AMPK通路。
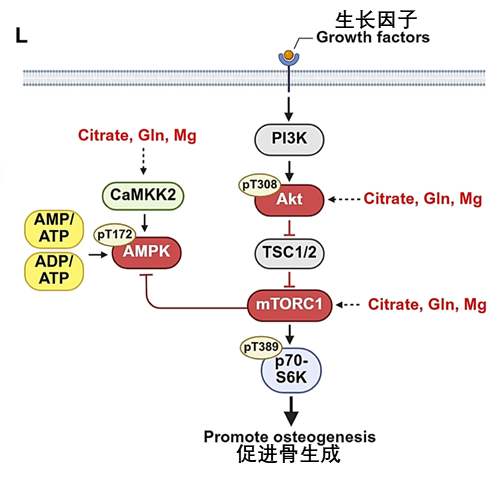
圖注:CitraBoneQMg協同激活AMPK和mTORC1機制圖
No.2
解除通路拮抗:AKT通路激活mTORC1
在身體處於能量充盈的狀態,mTORC1會被激活,但是此時AMPK通過鈣離子信號也被激活了,在傳統認知中AMPK會對mTORC1產生抑制作用,那麼mTORC1是怎麼掙脱AMPK的枷鎖呢?
傳統困局:AMPK在感知體內能量下降時,會激活TSC1/2蛋白複合物從而抑制mTORC1。
破局關鍵:材料釋放的檸檬酸與谷氨醯胺激活AKT通路→AKT抑制 TSC1/2蛋白複合物,直接對抗AMPK對其的激活作用→ 解除mTORC1的枷鎖,激活 mTORC1 → 保障合成代謝持續進行。
CitraBoneQMg通過鈣信號激活AMPK 和Akt信號隔離TSC1/2蛋白複合物的雙軌策略,突破了AMPK-mTORC1的傳統拮抗的關係,共助骨再生。

與傳統骨再生材料的區別
研究員還發現相較於含有POC/HA(是一種基於檸檬酸的複合材料)的骨再生材料,CitraBoneQMg裏面的三種活性成分還顯著提升巨噬細胞表達抗炎因子IL-10,促進神經再生標記物TUBB3表達,具有抗炎和促神經再生的作用[2]。
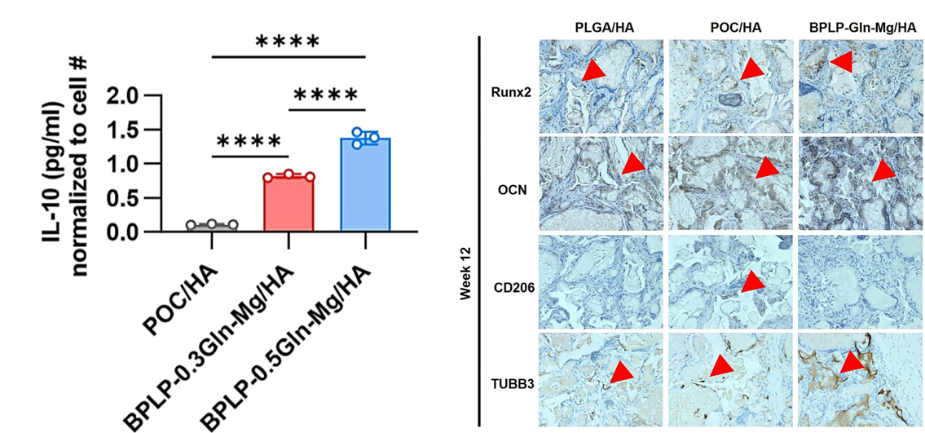
圖注:CitraBoneQMg顯著提高IL-10的表達;
右圖:紅色箭頭表示缺損部位第12周TUBB3的染色結果
傳統骨修復材料更像一個被動的“填充物”,主要靠物理支撐讓骨頭慢慢長進去。而 CitraBoneQMg 的創新性在於,它化身為一個主動的“細胞代謝指揮官”,同步驅動骨再生、免疫調節與神經重建。
其研發團隊核心成員楊健教授開發的新型檸檬酸可降解材料,是目前全球唯一獲得FDA批准應用於醫療植入器械的可降解熱固性聚酯高分子材料[5],這為CitraBoneQMg等新一代骨再生材料的臨牀轉化奠定了重要基礎。
研究者表示機制中AMPK的鈣離子調控等機制的細節仍需深究,但當生物材料學會與細胞“對話”,我們離智能再生醫學的願景便更近了一步。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] González, A., Hall, M. N., Lin, S. C., & Hardie, D. G. (2020). AMPK and TOR: The Yin and Yang of Cellular Nutrient Sensing and Growth Control. Cell metabolism, 31(3), 472–492. https://doi.org/10.1016/j.cmet.2020.01.015
[2] Xu, H., Tan, X., Gerhard, E., Zhang, H., Ray, R., Wang, Y., Kothapalli, S. R., Rizk, E. B., Armstrong, A. D., Yan, S., & Yang, J. (2025). Metabotissugenic citrate biomaterials orchestrate bone regeneration via citrate-mediated signaling pathways. Science advances, 11(30), eady2862. https://doi.org/10.1126/sciadv.ady2862
[3] Hawley, S. A., Pan, D. A., Mustard, K. J., Ross, L., Bain, J., Edelman, A. M., Frenguelli, B. G., & Hardie, D. G. (2005). Calmodulin-dependent protein kinase kinase-β is an alternative upstream kinase for AMP-activated protein kinase. Cell Metabolism, 2(1), 9–19. https://doi.org/10.1016/j.cmet.2005.05.009
[4] Zhang, T., Zhou, L., Makarczyk, M. J., Feng, P., & Zhang, J. (2025). The Anti-Aging Mechanism of Metformin: From Molecular Insights to Clinical Applications. Molecules (Basel, Switzerland), 30(4), 816. https://doi.org/10.3390/molecules30040816
[5] Xu, H., Yan, S., Gerhard, E., Xie, D., Liu, X., Zhang, B., Shi, D., Ameer, G. A., & Yang, J. (2024). Citric Acid: A Nexus Between Cellular Mechanisms and Biomaterial Innovations. Advanced materials (Deerfield Beach, Fla.), 36(32), e2402871. https://doi.org/10.1002/adma.202402871