衰老是程序?還是Bug?破解它,就能永生?100 個延壽未解之謎刷屏_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

編者按
**為什麼我們會變老?能否讓健康壽命更長久?**如何找到衰老研究的下一個突破口?
衰老領域的每一個問題背後,都藏着改變人類壽命曲線的可能。
近日,英國伯明翰大學Angelo Talay、João Pedro de Magalhães攜手****Altos Labs劍橋研究所Steve Horvath等近30家機構、30餘位學者,彙集全球科研力量,整理出一份重磅問題清單——《衰老與長壽科學的100個未解問題》[1]這份清單梳理了當前衰老研究中最核心、最具挑戰性的科學問號,並勾勒出未來探索的潛在方向。
更令人期待的是,這項工作的核心參與者Steve Horvath 教授,將於今年9月親臨時光派第六屆衰老幹預論壇,分享他對這些關鍵問題的獨到見解。Horvath教授不僅是“表觀遺傳時鐘之父”,更是Altos Labs劍橋科學研究所的首席研究員。屆時,誠邀各位共同參與這場探索未來衰老科學方向的討論!


一場全球科學家的“集體追問”
在梳理衰老與長壽科學現狀的過程中,研究團隊並沒有急於下結論,而是決定先做一件聽起來簡單、其實最難的事:列出那張“問題清單”。
第一步:
搭建平台,全球徵集問題
研究團隊首先搭建了一個在線平台,邀請世界各地的科學家提交衰老領域的未解問題。
同時在英國伯明翰舉辦了一場為期三天的研討會,24位頂尖學者齊聚一堂,碰撞出思想的火花。
最終,他們收集了290個問題,其中160個來自在線提交,130個源自研討會。經過初步篩選,剔除重複或不相關的問題,留下了204個候選。
第二步:
用NLP技術“篩選”問題
研究團隊進一步引入了自然語言處理(NLP)工具來篩選和精煉這些問題。他們對收集到的290個開放性問題進行系統篩選,然後將這些問題與PubMed數據庫中超過20萬篇衰老相關文獻進行語義匹配,並用相似度評分評估“問題–文章”的關聯程度。相似度≤0.2的組合被剔除,以排除無關內容;
之後再用邏輯分析進一步判斷問題與文獻是否真的相關。併為每個組合打上**“支持”、“矛盾”或“無關”**標籤。
最終,只保留概率值≥0.8且標籤為“支持”的組合,並據此統計每個問題所對應的文獻數量,以此量化該主題在科學文獻中的“出現頻率”。
第三步:
聚類和歸納
研究團隊利用NLP的嵌入向量和K均值聚類等方法,把高度相似的問題分組,並輔以人工審核,確保每個問題都歸在最合適的主題下。
最終,將問題分為11個主題,涵蓋分子機制、干預措施、比較生物學等,從中精選出100個最具代表性的問題。

為什麼是“列問題”而不是“給答案”?
“提出正確的問題,有時比找到答案更重要。”——這句話在衰老研究領域尤其真實。
只有釐清了“哪些問題最值得被解答”,研究才有方向。因此研究團隊對這些問題做了一個有趣的分析:哪些是研究“熱點”,哪些又幾乎無人問津?
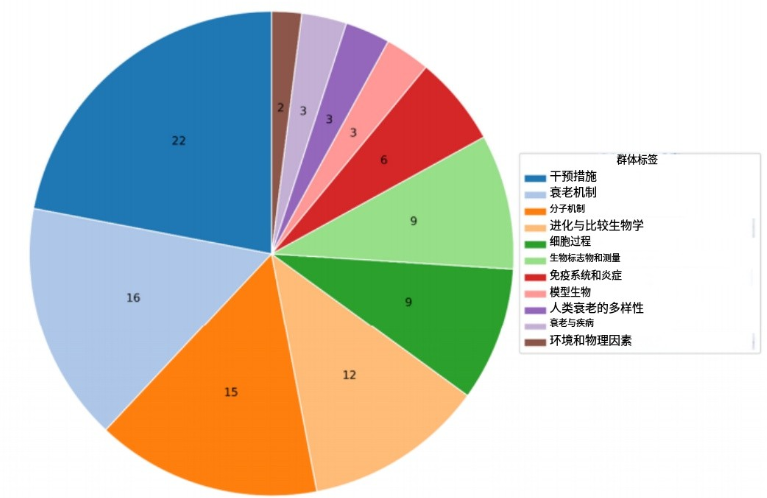
圖注:分佈在11個主題中未決問題總數的餅狀圖
將100個問題分類後,研究團隊發現其中佔比最大的是“衰老機制”、“分子機制”以及“干預措施”,這三類問題合計佔據了所選問題的一半以上。而“環境與物理因素”和“人類衰老多樣性”等主題則呈現較少分佈,反映出這些領域在學界尚未得到充分探索。
此外,研究團隊通過按相關文獻數量排序的前20個和後20個開放性問題進行統計分析,發現了它們在衰老研究文獻中的呈現比例存在顯著差異。
No.1
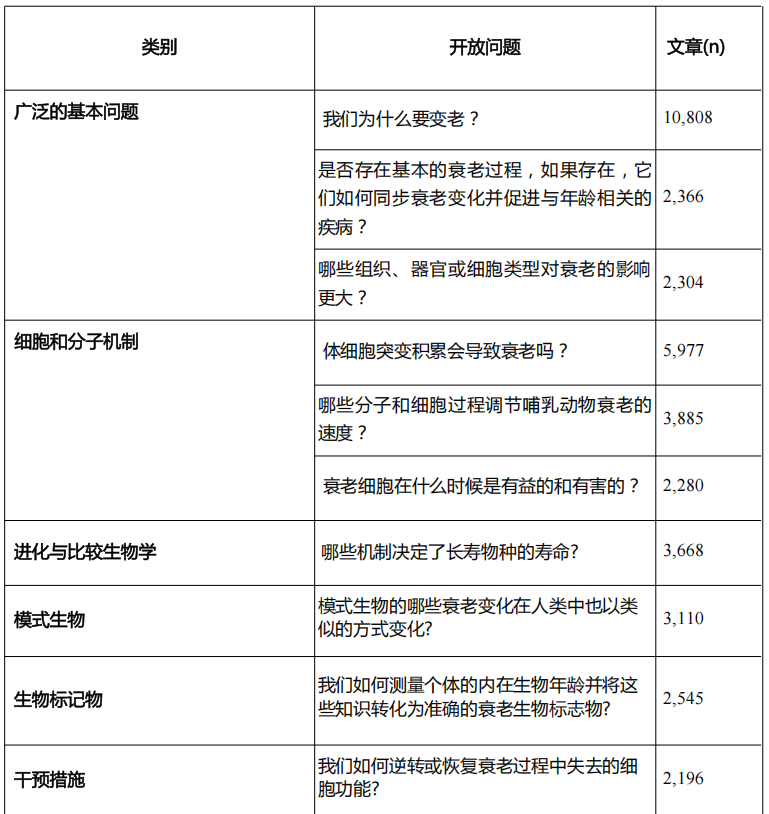
前20個未解問題共涉及69,322篇文獻,佔總數據集的40.3%,平均每項問題對應3,466.1篇文獻,其中科學家們研究最多的問題是“我們為什麼會衰老?”,相關文獻達到10808篇。
No.2
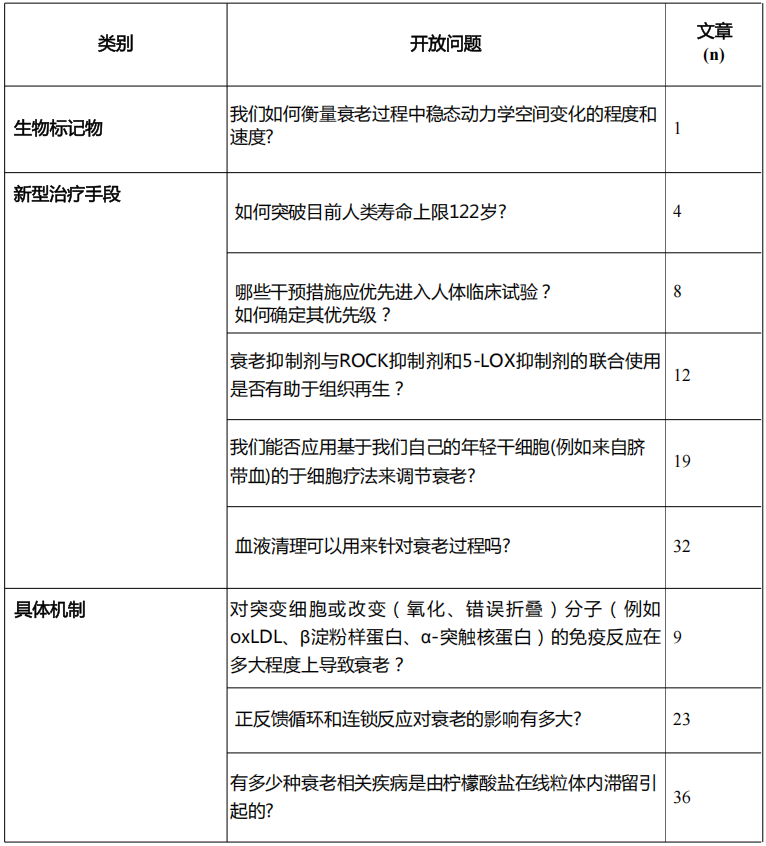
後20個問題僅涉及341篇文獻,僅佔數據集的0.2%,平均每項問題僅有17.05篇文獻。例如“我們如何衡量衰老過程中穩態動力學空間變化的程度和速度?”僅1篇學術研究。
這100問像是科學家的“好奇心清單”,也是未來研究的“任務表”。它們指向科學最深處的未知,也可能是未來幾十年裏誕生新療法、新技術,甚至改變人類壽命曲線的起點。

翻開這份清單——
100個衰老與長壽未解問題
研究團隊為我們展示了完整的“100個未解問題”[2]——它們不是冷冰冰的學術目錄,而是一百個真正困擾科學家的問號。
向上滑動閲覽
1)衰老與疾病
1.是否存在基本的衰老過程,如果存在,它們如何同步衰老變化並促進年齡相關疾病的發生?
2.衰老變化和過程如何影響對疾病的易感性(在某些情況下的抵抗力)?
3.與年齡相關的疾病有多少種常見誘因?
2)衰老機制
4.是細胞內在事件(DNA損傷、蛋白質毒性應激、線粒體功能障礙等)驅動衰老,還是由系統性因素(激素、免疫系統)和/或組織微環境(細胞外基質、細胞間通訊、幹細胞生態位)所驅動?
5.身體如何補償和適應任何與年齡相關的變化?
6.基因表達程序的失調,包括由表觀遺傳變化/漂變或轉錄因子異常,在多大程度上促進了衰老?
7.發育程序的持續進行對衰老有多大影響?
8.胸腺退化在多大程度上促進衰老?
9.激素(如雌激素、睾酮、甲狀腺激素、生長激素、IGF1)的變化在多大程度上促進衰老?
10.啓動子和調節區域的突變對衰老有多大影響?
11.正反饋循環和連鎖反應對衰老的影響有多大?
12.衰老是獨立發展的與年齡相關的疾病的集合,還是由共同的潛在過程介導的?
13.人類衰老的因果機制是什麼?
14.必須針對哪些基因和通路來延長壽命和健康壽命,我們如何識別它們?
15.不同的機制/特徵對不同的衰老表型和疾病有何貢獻?
16.各組織中自噬的最佳水平應如何設定以優化長壽?
17.哪些分子和細胞過程調節哺乳動物的衰老速度?
18.哪些恢復力/保護因素使我們能夠達到當前的壽命?
19.哪些組織、器官或細胞類型對衰老的影響更大?
3)生物標誌物和測量
20.衰老生物標誌物是在準確衡量衰老過程,還是在衡量健康?
21.我們能否建立可在人類樣本(不限於血液)中檢測、且能代表小鼠衰老變化的更好標誌物?
22.如何開發能在人體組織中量化氧化水平、衰老細胞、DNA損傷等不同衰老維度的方法?
23.如何在人類內部及跨物種間評估並比較表觀遺傳時鐘?
24.我們如何測量個體的內在生物年齡並將其轉化為準確的衰老生物標誌物?
25.我們如何衡量衰老過程中穩態動力學空間變化的程度和速度?
26.自然衰老速率差異的原因在多大程度上受環境和基因-環境互作調控?
27.我們研究衰老的不同方面/軌跡所需的最小數據集是什麼樣的?
28.當前(表觀遺傳)時鐘測量什麼,即它們反映了哪些細胞/分子過程?
4)細胞過程
29.我們能否將表觀遺傳細胞年輕化與細胞命運的逆轉區分開來?
30.整個生命週期中生物時間轉換的調節是如何發生的?
31.細胞耗竭對衰老有多大影響?
32.過度的細胞死亡和細胞週期停滯以及次優的細胞增殖和更新在多大程度上促進衰老?
33.SASP(衰老相關分泌表型)在多大程度上促進衰老和疾病?
34.旁分泌因子在多大程度上促進衰老?
35.幹細胞耗竭和功能障礙在多大程度上促進衰老?
36.衰老細胞在正常生理中的作用是什麼?
37哪些衰老細胞在何時是有益的,何時又是有害的?
****5)環境和物理因素
38.環境炎熱和寒冷對衰老的影響有多大?
39.衰老會在多大程度上增加對環境死亡原因的易感性?
6)進化與比較生物學
40.鳥類和哺乳動物是否存在共同的衰老生物學模式?
41.程序化理論的概念能否闡釋衰老相關疾病的起源及出現機制?
42.如何借鑑衰老的進化理論,將晚年疾病的多因素起源簡化為少數一般生物學原理?
43.拮抗多效性如何促成年齡相關疾病?
44.我們如何在生命之樹中找到衰老的主要共同點?
45.有多少個體動物在野外存活了足夠長的時間來經歷衰老?
46.資源的經濟性分配(例如分配給繁殖、戰鬥或逃跑、冬眠,而非修復)在多大程度上促進衰老?
47.衰老在多大程度上是進化適應?
48.衰老是否需要加速物種進化?
49.導致壽命發生重大變化的機制是什麼,尤其是在哺乳動物中,人類的壽命幾乎是黑猩猩的兩倍,衰老速度比小鼠或大鼠慢得多?
50.哪些機制決定了長壽物種的壽命?
51.哪些基因變異表現出拮抗多效性?我們能否找到在生命早期改善健康但在晚年有害(例如增加死亡率)的變體?
7)免疫系統與炎症
52.在老年階段靶向干預炎症能否延緩組織衰老進程?
53.對細胞內和細胞外病原體的免疫反應如何導致衰老?
54.免疫細胞克降擴增對衰老的貢獻有多大?
55.免疫衰老在多大程度上促進衰老?
56.免疫系統對突變細胞或改變(氧化、錯誤摺疊)分子(如oxLDL、β-澱粉樣蛋白、α-突觸核蛋白)的反應在多大程度上促進衰老?
57.炎症衰老與自身免疫在多大程度上促進機體衰老?
8)模式生物
58.模式生物的哪些衰老變化在人類中也以類似的方式變化?
59.哪些機制在多種模式生物中均為衰老所必需,哪些是各模式生物所特有?
60.為什麼飼養在相同環境中的基因相同的生物體(例如 C57BL/6小鼠)的壽命仍然具有大約2倍的變異性?
9)分子機制
61.是否存在已知與衰老相關的額外溶質載體(SLC)膜轉運蛋白?
62.突變積累是衰老的起因,還是對衰老應激的一種適應性反應?
63.有多少種衰老相關疾病是由檸檬酸鹽在線粒體內滯留引起的?
64.代謝物生化合成錯誤在多大程度上導致衰老?
65.DNA複製錯誤在多大程度上導致衰老?
66.DNA的累積損傷在多大程度上會導致衰老,哪些類型的 DNA損傷更重要?
67.鐵死亡對衰老有多大影響?
68.DNA修復系統的次優效率在多大程度上導致衰老?
69.端粒酶活性的次優水平在多大程度上促進衰老?
70.端粒縮短對衰老有多大影響?
71.細胞內和細胞外廢物的積累對衰老的貢獻有多大?
72.功能失調細胞的積累在多大程度上會導致衰老?
73.DNA損傷反應在多大程度上促進衰老?
74.衰老過程中細胞外基質的轉變在多大程度上影響各種組織的功能?
75.伴侶蛋白翻譯及其翻譯後修飾對衰老有何影響?伴侶功能隨年齡下降的程度如何?
10)人類老齡化的多樣性
76.導致自然衰老速率差異的遺傳原因(基因及DNA變異)是什麼??
77.性別二態性和種族差異如何影響衰老的不同方面?
78.為何衰老在人類身上的表現各不相同,哪怕是近親之間?
11)干預措施
79.衰老細胞清除劑與ROCK抑制劑及5-LOX抑制劑的組合在多大程度上促進組織再生?
80.藥物可以延緩人類衰老嗎,我們如何證明這一點?
81.長壽動物的器官移植能否延長短命物種的壽命?
82.清除衰老細胞後,補償性增殖是否會加速端粒縮短或增加複製錯誤?
83.我們能否應用基於我們自己的年輕幹細胞(例如來自臍帶血)開展幹細胞療法以干預衰老?
84.能否建立可在人(及小鼠)體內驗證抗衰老效能、卻無需等待 5–40 年的篩選體系?
85.我們能否利用胚胎發生過程來開發年輕化療法?
86.血液淨化能否用於靶向衰老過程?
87.部分重編程會延緩體內衰老嗎?
88.哪些干預措施應優先進入人體臨牀試驗?如何確定其優先級?
89.如何突破目前人類壽命上限122歲?
90.我們如何開發藥物和干預措施來靶向和逆轉不同細胞類型的表觀遺傳修飾,以解決與年齡相關的退化問題?
91.我們如何逆轉或恢復衰老過程中失去的細胞功能?
92.我們如何測試給小鼠服用長壽藥是否能讓它們更年輕(而不是改善健康)?
93.長壽干預措施的物種保守程度如何?
94.延壽的干預措施如何發揮作用,它們是針對相似還是不同的過程?
95.我們需要用年輕器官替換老年人的多少器官才能逆轉衰老?
96.對不同抗衰老幹預措施的性別和基因型特異性差異的依據是什麼?
97.各種抗衰老治療的最佳年齡、時間、持續時間和劑量是多少?
98.哪些衰老變化和病症可以通過細胞年輕化來逆轉,哪些不能逆轉?
99.哪些長壽干預措施可以延緩衰老,哪些能調節特定疾病(如癌症)?
100.基於年輕細胞的療法能否在衰老的微環境/系統環境中發揮作用?系統性環境對衰老的貢獻又是什麼?
寫在最後
派派覺得,100個問題,像100個沒拆的盲盒。
也許5年後,其中某個問題會被你、我、或正在看這篇文章的某個學生破解。
畢竟,1935年也沒人相信“少吃一點”能改寫壽命;2025年,我們已經敢問“122歲能不能再續10年”。
衰老研究最迷人的地方正在於此——答案永遠在更新,但好奇心不會老。
2025年9月20-21日,時光派第六屆衰老幹預論壇即將盛大開幕。Steve Horvath教授也將親臨現場發表精彩演講。屆時可與Steve Horvath教授面對面交流,還有機會聆聽來自全球各地數十位衰老生物學界頂尖學者分享的最新研究成果和前沿見解!
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1]Longelo Talay, Belikov, arXiv.orgYear: 2025URL: https://arxiv.org/abs/2507.18602
[2]Longevityknowledge.appYear:2025URL:https://www.longevityknowledge.app/categories