《Cell》系列突破:揭秘α-酮戊二酸驅動間充質幹細胞抗衰新機制_風聞
源井生物-让基因编辑更简单!1小时前
《Cell》系列突破:揭秘α-酮戊二酸驅動間充質幹細胞抗衰新機制

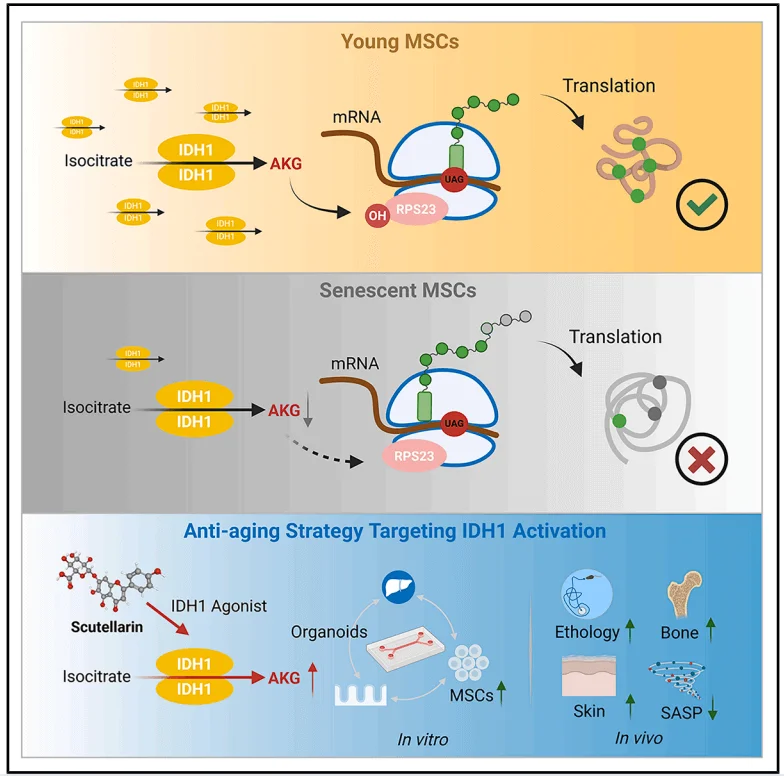
2025 年 7 月,中國中醫科學院等單位的研究人員在《Cell》系列子刊《Cell Reports》發表重要研究成果。在該研究中,源井生物為科研團隊提供了關鍵的人誘導多能幹細胞(iPS細胞)模型,成為支撐研究順利推進的重要力量。研究論文題為 “Identifying the target, mechanism, and agonist of α- ketoglutaric acid in delaying mesenchymal stem cell senescence” ,揭示了 α- 酮戊二酸(AKG)延緩間充質幹細胞(MSC)衰老的全新機制——AKG 通過促進核糖體蛋白 S23(RPS23)羥基化、增強翻譯保真度來延緩 MSC 衰老。研究指出,異檸檬酸脱氫酶 1(IDH1)驅動產生的 AKG 在這一過程中至關重要。此外,通過燈盞乙素(Scu)激活該過程,能夠減輕小鼠的衰老表型。這項關鍵性研究,為抗衰老策略提供了全新方向和啓發 。

亮點概述
AKG通過鐵依賴性氧化酶OGFOD1增強RPS23的羥基化作用來延緩MSC衰老。
IDH1活性下降會降低AKG水平,驅動MSC衰老;重新激活可逆轉這種衰老現象。
Scu激活IDH1,提高AKG水平,並減輕小鼠的年齡相關表型。
AKG可提高翻譯保真度,平衡蛋白質合成和準確性。
研究背景
AKG是一種在多種代謝和細胞途徑中的關鍵化合物。研究表明,AKG可以延緩衰老,被認為是一種無害的膳食補充劑,有助於延長健康壽命,並可能降低疾病發生率。IDH1是合成AKG的關鍵酶,且與人類年齡相關的疾病有關。儘管來自多項研究的間接證據提示了IDH1-AKG信號軸在衰老過程中的重要性,但該途徑的具體分子機制及其抗衰老靶點仍不明確。
幹細胞衰老被認為是機體衰老的重要標誌和驅動力。因此,探索增加體內幹細胞數量以延緩衰老的方法是一個活躍的研究領域。蛋白質穩態失衡在衰老過程中經常發生。機制缺陷或突變會損害翻譯的準確性,導致產生形狀異常的蛋白質。這反過來又會導致形成功能異常的蛋白質並積累有害的蛋白質聚集體。因此,識別既能提高蛋白質合成速率又能提高翻譯準確性的抗衰老分子或組合,是解決幹細胞衰老問題的一種可能途徑。在本研究中,研究人員旨在探究IDH1和AKG在MSC衰老過程中調節蛋白質穩態的潛在作用及分子機制。
研究結果
三羧酸(TCA)循環是衰老網絡中整合代謝與信號傳導的核心樞紐,而AKG是該循環的中間產物。研究人員使用穩定同位素13C6標記的葡萄糖來研究MSCs衰老過程中TCA循環相關代謝小分子生成的變化。結果表明,與低代次MSCs相比,高代次MSCs產生的檸檬酸、烏頭酸、AKG、延胡索酸、蘋果酸和乙酰輔酶A的生成顯著減少。細胞增殖實驗結果顯示,只有AKG及其衍生物二甲基α-酮戊二酸(DM-AKG)顯著增強了MSCs的增殖。隨後,研究人員分析了經歷生理性衰老的MSCs和經受D-半乳糖(D-Gal)誘導的病理性複製衰老的MSCs中的AKG水平。結果顯示,與正常MSCs相比,經歷病理性和生理性衰老的MSCs中AKG水平均顯著降低。接下來,研究人員探究了補充AKG及DM-AKG對MSCs衰老的影響,均導致細胞內AKG濃度升高,且DM-AKG在較低劑量下就顯示出顯著效果。總之,這些研究結果表明AKG可能作為MSCs衰老的代謝生物標誌物,而AKG產量的下降可能是導致MSC衰老的因素之一。
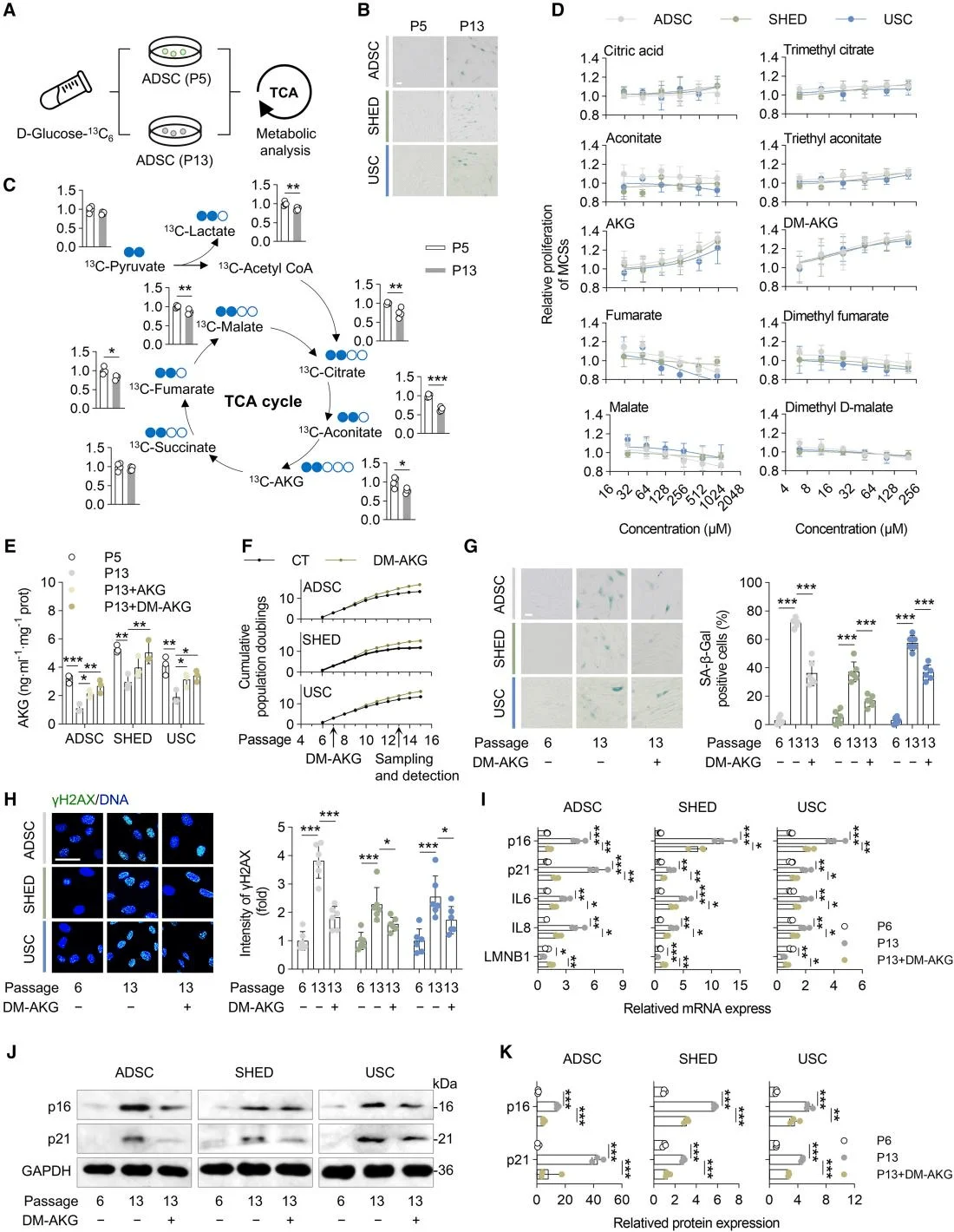
AKG是延緩MSCs衰老的關鍵代謝物質
為了探究AKG延緩MSC衰老的機制,研究人員採用了熱蛋白質組分析-細胞環境熱移位(TPP)實驗來確定AKG的蛋白質靶點。結果顯示AKG作用的靶點與核糖體功能密切相關,核糖體蛋白RPS23是受AKG影響變化最顯著的靶點。鑑於RPS23蛋白存在羥基化修飾,研究人員探究了AKG對RPS23羥基化的影響,發現AKG顯著增強了這一過程。先前的研究表明,OGFOD1在真核生物中催化RPS23的脯氨酸羥基化,AKG作為其關鍵輔因子。研究人員進一步明確了OGFOD1在RPS23羥基化過程中的關鍵作用,OGFOD1與AKG結合而非RPS23直接結合,並在MSC細胞實驗中對OGFOD1進行了功能驗證。這些結果表明,AKG通過RPS23的羥基化來延緩MSC衰老,OGFOD1成為AKG介導的RPS23羥基化的關鍵靶點。
研究人員通過免疫共沉澱實驗和雙分子熒光互補分析,發現DM-AKG增強了RPS23與OGFOD1蛋白之間的相互作用。進一步構建了RPS23-OGFOD1-AKG的分子對接模型,並構建RPS23-P62A突變體MSCs驗證了分子動力學模擬中發現的結果,上述實驗揭示了AKG通過穩定OGFOD1-RPS23複合物來抑制MSC衰老的分子機制,其中Pro62的羥基化狀態是這一過程中的關鍵調節節點。
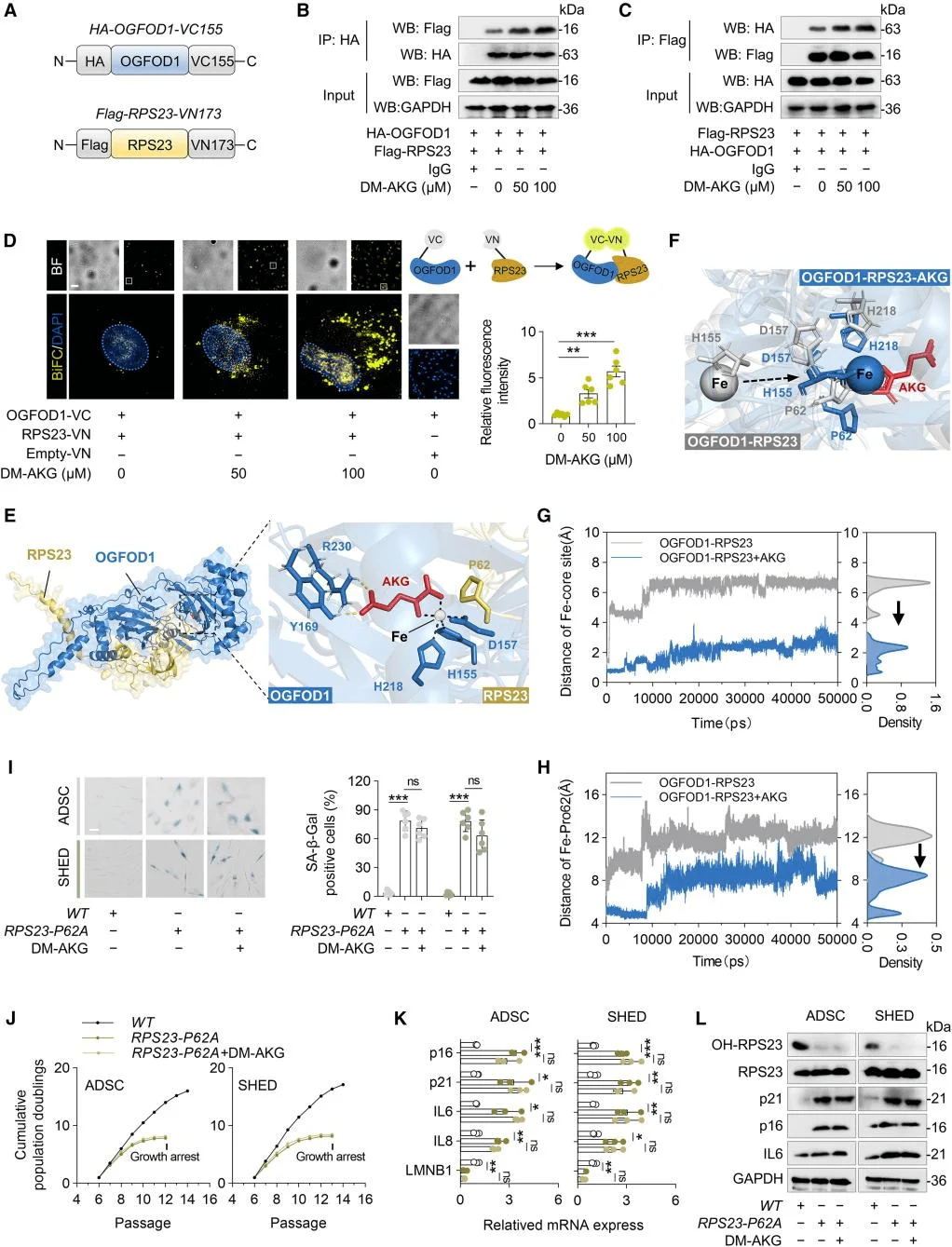
AKG通過促進OGFOD1-RPS23複合物的形成來提高RPS23-Pro62的羥基化水平
鑑於AKG能顯著增強MSCs的增殖活性,研究人員研究了TCA循環中能夠產生AKG的蛋白質。隨着MSC傳代次數的增加,衰老標誌物p16和p21的表達顯著上升。在TCA循環中參與AKG生成的蛋白質中,只有IDH1的表達量明顯下降。隨後,研究人員通過IDH1的表達探究了IDH1對AKG生成和MSC衰老的影響,並進一步觀察了作為IDH1的同工酶IDH2和IDH3的作用。研究結果證實了IDH1在MSCs中發揮衰老保護因子的作用,並表明由於IDH1表達下降導致的AKG水平降低是MSCs衰老的關鍵誘因。
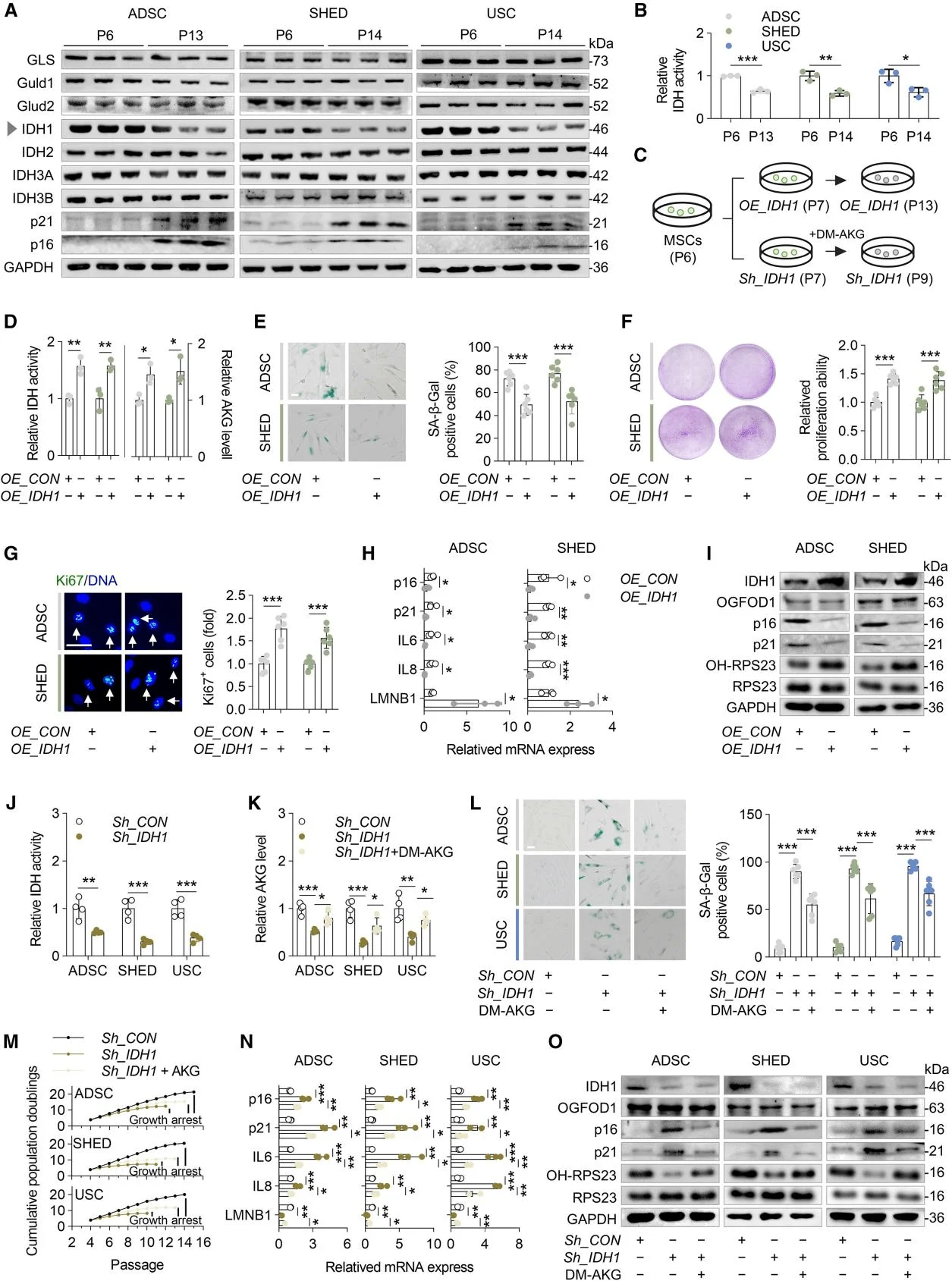
IDH1調節AKG的合成,影響MSC的衰老
細胞增殖的加速通常依賴於蛋白質合成速率的提升。特別是幹細胞,它們高度依賴高水平的蛋白質合成來維持自我更新和分化潛能。研究結果顯示,隨着傳代次數的增加,脂肪源性幹細胞(ADSCs)的蛋白質合成速率顯著下降,而AKG可以顯著提高合成速率。此外,蛋白質合成的翻譯保真度下降在衰老過程中扮演着關鍵角色,而不僅僅是減緩蛋白質合成的速度。衰老的MSCs中蛋白質聚集體的形成顯著增加,而AKG能夠有效緩解這一現象。有趣的是,儘管AKG可以逆轉IDH1敲低導致的蛋白質聚集體增加,但對於由OGFOD1敲低或PRS23-Pro62突變引起的蛋白質聚集體積累,AKG則沒有效果。為此,研究人員設計了一個雙熒光素酶報告系統,用於檢測MSCs中的常見翻譯錯誤和終止密碼子通讀,並使用誘導MSCs中翻譯錯誤的藥物巴龍黴素驗證該系統。結果表明,巴龍黴素引起的蛋白質穩態破壞和MSC衰老不受組蛋白甲基化的影響,且不能通過高濃度的AKG逆轉。這表明蛋白質穩態失衡是MSC衰老的一個獨立因素,而蛋白質穩態的調節在介導AKG延緩MSC衰老的能力中起着關鍵作用。
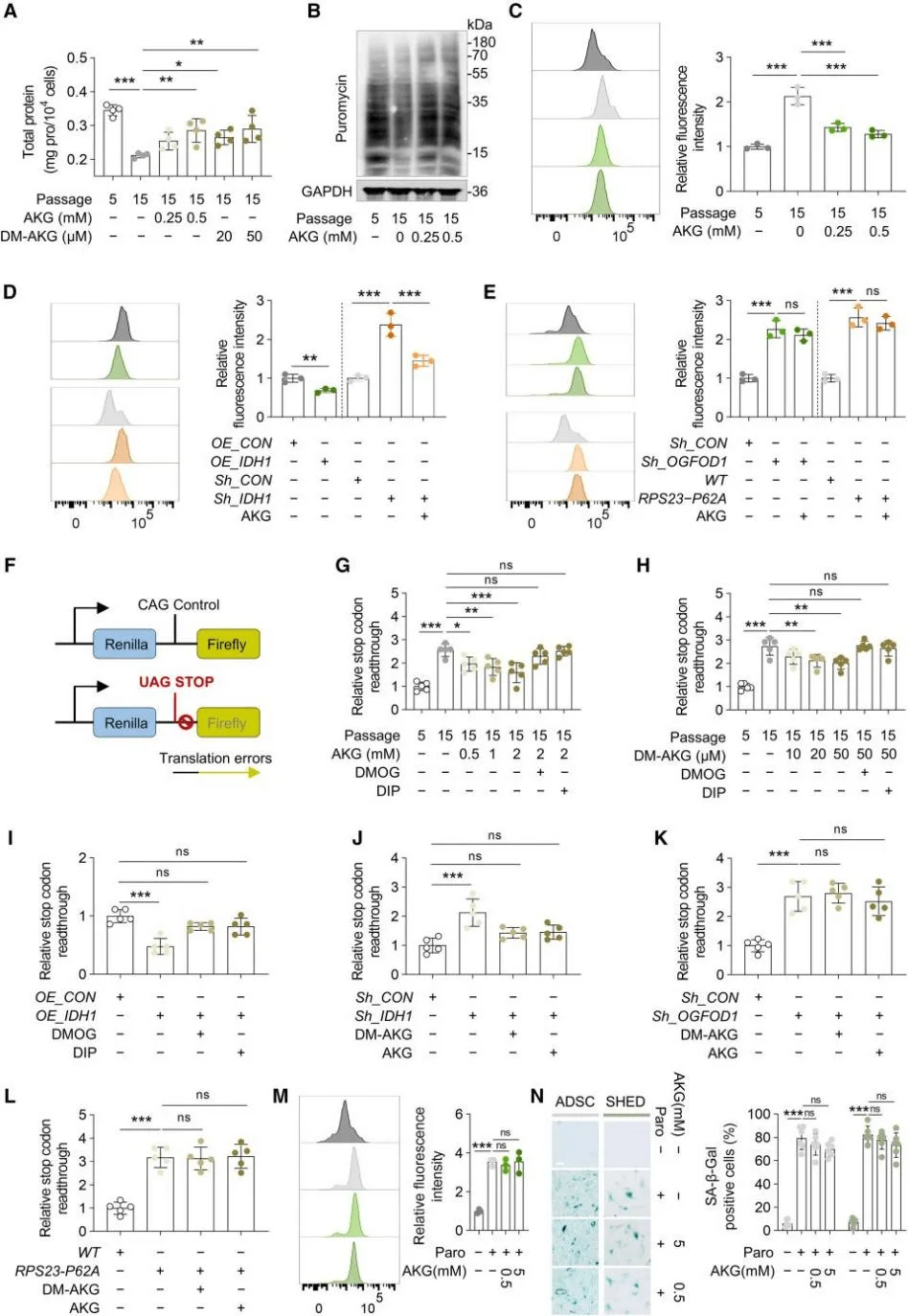
AKG通過OGFOD1-OH-RPS23提高了MSCs中蛋白質的翻譯準確性
由於IDH1的激活能夠促進AKG的生成,研究人員接下來聚焦於以IDH1激活為重點的抗衰老策略。研究人員使用先前發現的天然存在IDH1激動劑燈盞乙素(Scu),Scu能夠提高ADSCs中的IDH酶活性,並恢復衰老MSCs中的AKG水平。Scu通過激活IDH1-AKG-RPS23信號軸來促進MSC增殖和延緩衰老的潛力。為模擬體內代謝環境,研究人員開發了腸屏障-肝臟類器官微流控系統,證實Scu經腸道吸收和肝臟代謝後仍能有效抑制MSCs衰老。老年小鼠體內實驗進一步驗證Scu可提高AKG濃度、增強RPS23羥化修飾,並顯著改善衰老相關表型,表明IDH1小分子激動劑在干預衰老及相關疾病中具有潛在的應用價值。
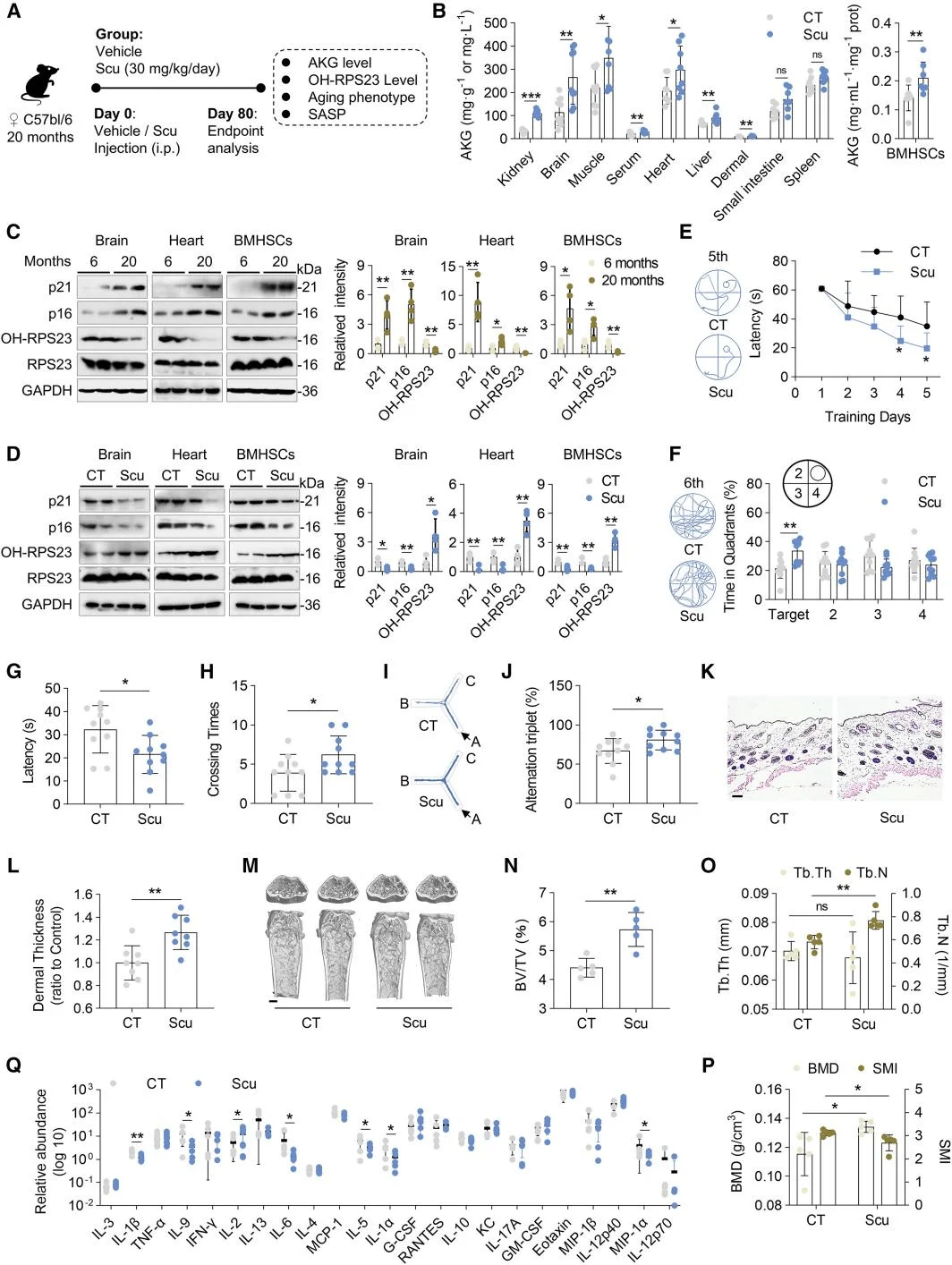
IDH1激動劑Scu改善了老年小鼠的衰老表型
綜上所述,該研究揭示了AKG通過靶向RPS23來維持蛋白質穩態,從而促進MSCs的自我更新並延緩細胞衰老。這些發現整合了衰老過程中的兩個關鍵因素——代謝失調和蛋白質穩態的喪失,為開發潛在的抗衰老治療方法提供了依據。
參考文獻
Cui Z, Li J, Li C, et al. Identifying the target, mechanism, and agonist of α-ketoglutaric acid in delaying mesenchymal stem cell senescence[J]. Cell Reports, 2025, 44(7).