女性噩夢更多?端粒縮短、早逝風險增加,研究實錘:這是你老的更快的夜間元兇_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯17分钟前
凌晨3:17,又一次從令人窒息的墜落感或無盡的追逐中驚醒。枕頭上冰冷的汗水和胸腔裏擂鼓般的心跳提醒着你:又是噩夢……

我們大多有過被噩夢嚇醒的經歷,或許只當它是壓力過大的暫時產物,或者乾脆就是以為睡迷糊了。但頻繁造訪的噩夢,可能正在悄無聲息地給身體按下加速衰老的按鈕。
科學研究正勾勒出噩夢與衰老之間令人不安的關聯:從細胞層面端粒的加速縮短,到預示早逝風險;從青春期的高發到老年期特定人羣的“回潮”;背後還牽涉着壓力激素的慢性轟炸、細胞修復的被迫中斷,以及炎症風暴的悄然醖釀……

下面跟着派派一起來扒一扒頻發噩夢與衰老之間,那些被忽視卻至關重要的科學聯繫。

噩夢中斷睡眠
要理解噩夢的威力,先得看看睡眠的組成。我們每晚的睡眠由非快速眼動睡(NREM,身體修復期)和快速眼動睡眠(REM,夢境活躍期)交替上演,大約90分鐘一個循環,一晚重複4-6次[1]。噩夢,正是REM期的不速之客。
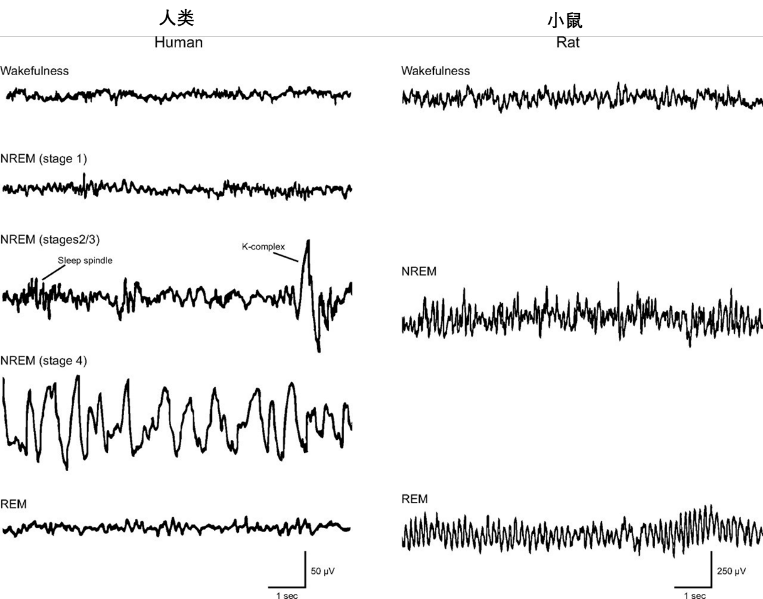
圖注:NREM和REM的腦電圖
為什麼噩夢總在REM期發生?因為在這個階段,大腦上演着情緒失控:負責恐懼、焦慮等原始情緒的情緒中心(如杏仁核)高度興奮;而負責理性思考、抑制衝動的控制中心(如前額葉皮層)卻處於離線狀態[1]。夢境中的情緒被放大,恐怖情節也容易層出不窮。
噩夢來臨時,我們常會心率飆升、呼吸急促、冷汗直冒;一旦被噩夢驚醒,很可能難以再沉入關鍵的NREM深度睡眠階段——那是身體修復DNA損傷、清除代謝廢物、鞏固記憶的黃金窗口[1],長期反覆的噩夢會導致身體的“自我保養計劃“被打亂。

噩夢頻發=身體在加速衰老?
科學實錘來了
強有力的科學證據正在揭示噩夢與衰老之間的聯繫。其中,倫敦帝國理工神經科學家Abidemi Otaiku團隊的研究尤為引人注目。
最近該團隊在歐洲神經病學學會上發佈的一項研究結果表明:頻繁做噩夢的人,其細胞端粒長度顯著短於很少做噩夢的人,表觀遺傳時鐘走得更快,這意味着,噩夢不僅影響睡眠,更在細胞層面直接加速了衰老進程[2]。
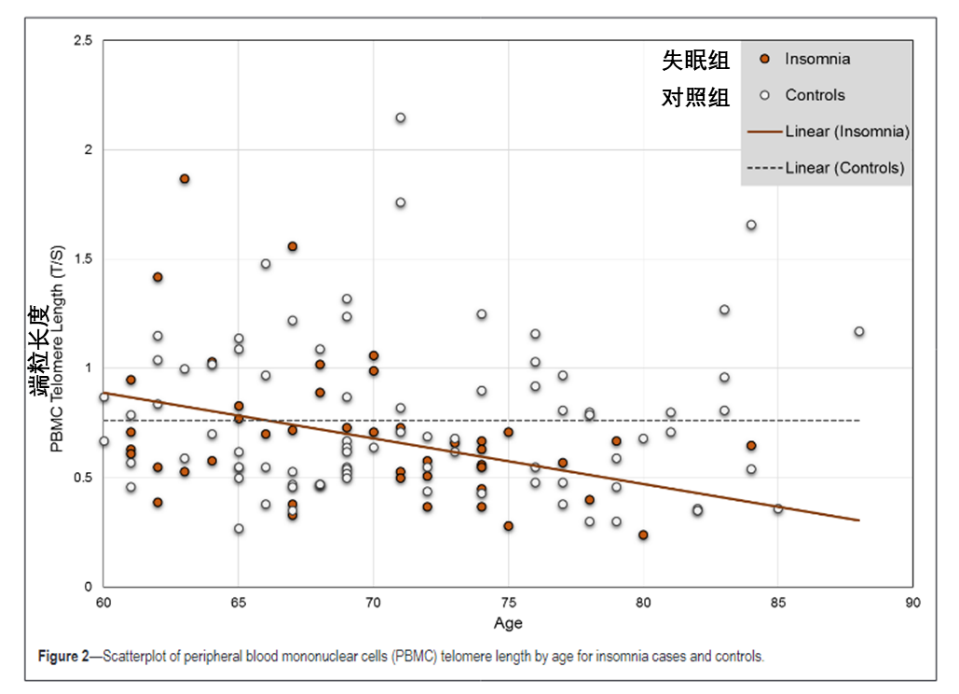
圖注:失眠的老人端粒長度隨年齡下降速度更快[3]
除此之外,每週做噩夢的成年人過早死亡( 70歲之前)的可能性相較於很少或從未做過噩夢的成年人要高出三倍以上。他的團隊還發現,與吸煙、肥胖、不良飲食或缺乏體育鍛煉相比,噩夢頻率更能預測過早死亡[2]。


誰更容易被噩夢纏上
噩夢雖煩人,但並非雨露均霑,它在人生不同階段和不同性別間頻率不盡相同[4]:
青春期與青年期是噩夢的“黃金時代”:主要原因是大腦情緒中樞(杏仁核等)的發育,學業、社交、未來規劃等多重壓力。到中年階段噩夢頻率呈現下降或穩定趨勢。 老年期噩夢頻率較低,但在特定人羣中(如患有痴呆症)可能再次攀升[11]。
除此之外,在青春期及中青年期,女性的噩夢頻率和困擾程度普遍顯著高於男性。這可能源於女性擁有更強的夢境回憶力、更高的情緒敏感度。此外,女性焦慮、抑鬱的患病率相對更高,是噩夢的強力推手。不過隨着年齡增長,這種差異會逐步縮小。

噩夢和衰老的因果關係?
噩夢如何催老?二者可能存在交織作用,形成惡性循環,下面讓我們看看噩夢和衰老之間剪不斷理還亂的糾葛。
噩夢是“促衰劑”
噩夢會導致無意識覺醒,導致應激激素如皮質醇升高, 高皮質醇會延遲入睡時間並縮短深度睡眠時長、抑制免疫、促進脂肪堆積[2,5]。噩夢還導致促炎細胞因子(如IL-6、TNF-α)的慢性升高, 而炎症是心血管疾病、糖尿病、神經退行性變等眾多衰老相關疾病的病理基礎和驅動因素[6]。
細胞修復被迫停工:如前所述,噩夢驚醒打斷深度睡眠,讓身體錯過關鍵的細胞修復(如DNA損傷修復)、廢物清理(如大腦清除β澱粉樣蛋白)窗口期[7]。
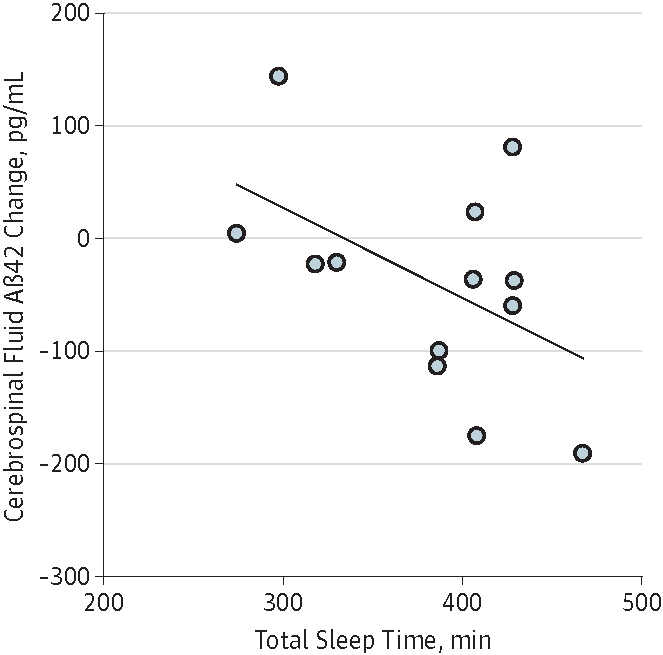
圖注:睡眠時間越長,腦內β澱粉樣蛋白含量越少[8]
代謝紊亂:碎片化睡眠嚴重擾亂晝夜節律,抑制AMPK活性,導致糖脂代謝紊亂[9]。同時,線粒體功能受損,產生大量破壞性的活性氧(ROS),進一步損傷DNA、加速端粒縮短[10]。
噩夢是早衰的警報
另一種觀點認為,與其説噩夢會促衰,不如説異常高頻的噩夢是身體內部已經開始衰退或病變的警報信號(正如太陽不是雞叫出來的)。
大腦神經系統的退行性變化[11]、心血管系統的功能失調(每天睡眠時長小於6小時和多夢均與40歲以上成年人冠心病風險增加相關)[12]、或呼吸系統障礙(如睡眠呼吸暫停)[13]都可能影響到快速眼動(REM)睡眠的穩定性。
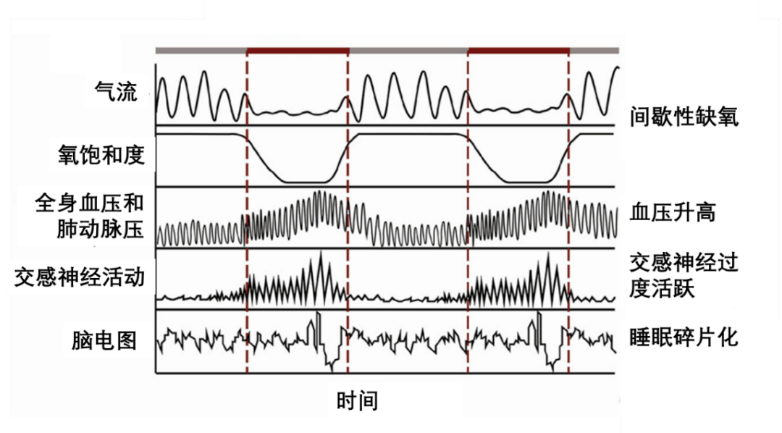
圖注:呼吸暫停發作(在紅線之間)導致氣流停止,通常伴隨着氧飽和度減少,全身血液和動脈肺部壓力增加。造成交感神經活動增加,最終以喚醒中樞神經系統、腦意識覺醒為結束,並以增加的腦電圖波頻率為標誌。睡眠時反覆發作的呼吸暫停引起的覺醒最終導致了睡眠的碎片化
更有研究表明,噩夢頻發是未來認知能力下降和痴呆症風險顯著增加的預測因子[11]。
除此之外,慢性心理壓力、童年創傷、不良生活方式、創傷後應激障礙等會同時促進噩夢和早衰[14-16],衰老帶來的生理功能失調又會進一步惡化睡眠質量,導致更多噩夢的發生。
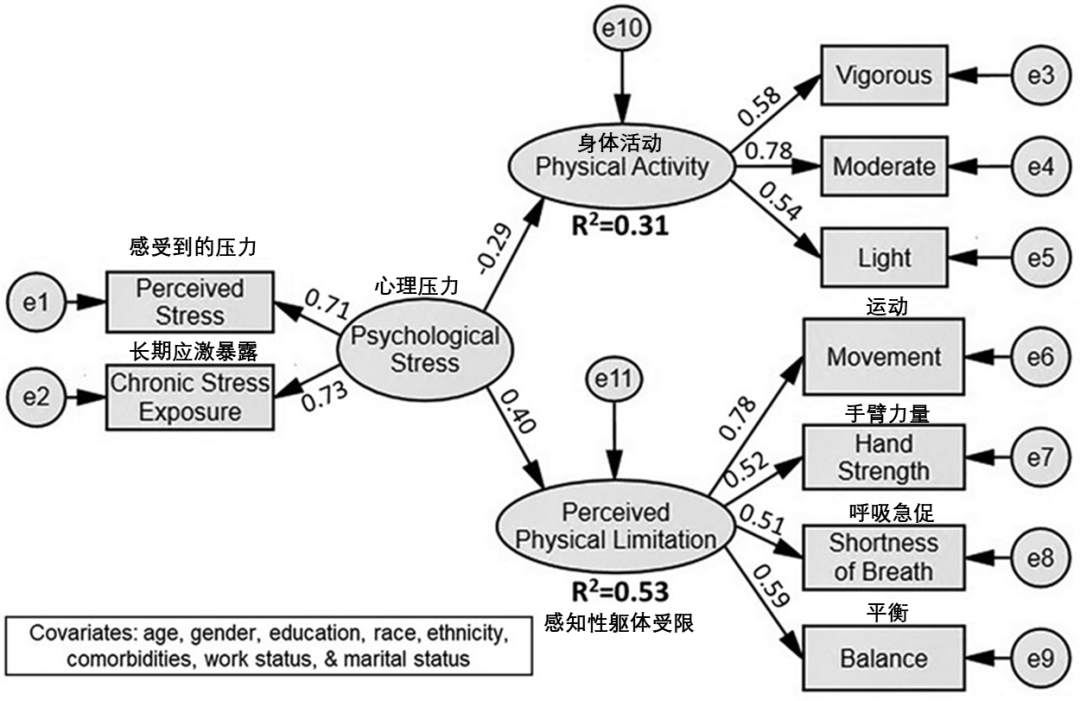
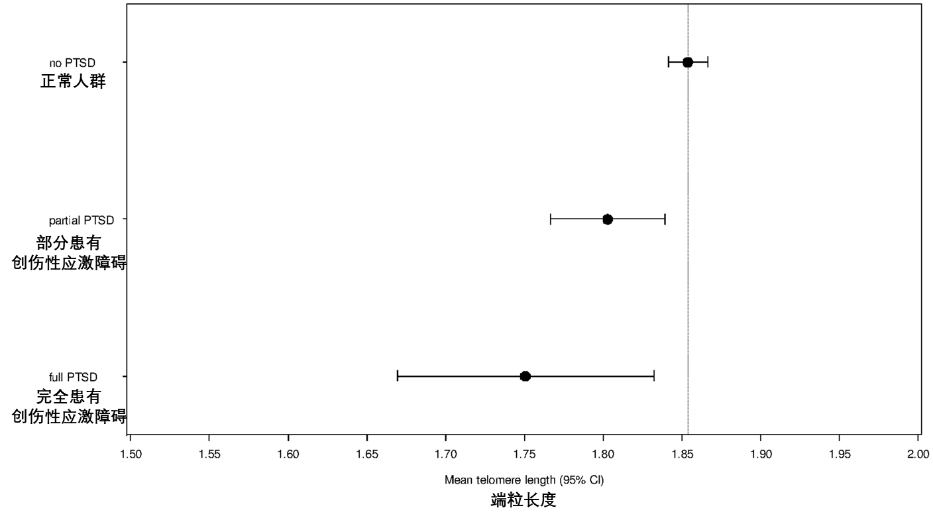
圖注:慢性心理壓力對身體活動和身體機能的負面影響(上圖);患有創傷後應激障礙的人羣噩夢頻率更高,端粒長度顯著小於正常人羣(下圖)

直面噩夢的小Tips
那麼面對噩夢時我們有什麼好的對策呢?
現代社會中的學業、社交、未來焦慮是主要壓力源,我們可以通過規律作息、運動、冥想、向朋友家人傾訴進行壓力管理。還可以優化睡眠環境來提高睡眠質量。
若因為做噩夢而導致睡眠被打斷,我們也可以通過適量的補劑進行干預,例如褪黑素、甘氨酸、茶氨酸等,感興趣的朋友可以閲讀派派推薦的相關推文。
推薦閲讀:親測分享|睡眠好壞決定壽命長短?這些助眠補劑,讓你輕鬆睡好覺
對於反覆出現的特定噩夢可以採用意象排練療法對噩夢結局進行改寫[17]。想象一個自己希望的夢境結局,在放鬆狀態下,在腦海裏主動反覆播放被改寫的新夢境,堅持幾周,大腦在REM期會更傾向於上演排練的新劇本,噩夢被替換。

如果每週多次噩夢且嚴重影響白天狀態(疲憊、焦慮、注意力不集中),建議尋求醫生專業的幫助,頻繁的噩夢可能是身體向我們發出的警報。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Brown, R. E., Basheer, R., McKenna, J. T., Strecker, R. E., & McCarley, R. W. (2012). Control of sleep and wakefulness. Physiological reviews, 92(3), 1087–1187. https://doi.org/10.1152/physrev.00032.2011
[2] Simms, C. (2025, June 22). Nightmares linked to faster biological ageing and early death. New Scientist. https://www.newscientist.com/article/2485267-nightmares-linked-to-faster-biological-ageing-and-early-death/
[3] Carroll, J. E., Esquivel, S., Goldberg, A., Seeman, T. E., Effros, R. B., Dock, J., Olmstead, R., Breen, E. C., & Irwin, M. R. (2016). Insomnia and Telomere Length in Older Adults. Sleep, 39(3), 559–564. https://doi.org/10.5665/sleep.5526
[4] Chamorro, E. (2015). Theories of Nightmares in Cognitive Neuroscience and Psychology. DIVA. https://www.diva-portal.org/smash/record.jsf?pid=diva2%3A852378&dswid=-4163
[5] Polsky, L. R., Rentscher, K. E., & Carroll, J. E. (2022). Stress-induced biological aging: A review and guide for research priorities. Brain, behavior, and immunity, 104, 97–109. https://doi.org/10.1016/j.bbi.2022.05.016
[6] Walker W. E. (2022). GOODNIGHT, SLEEP TIGHT, DON’T LET THE MICROBES BITE: A REVIEW OF SLEEP AND ITS EFFECTS ON SEPSIS AND INFLAMMATION. Shock (Augusta, Ga.), 58(3), 189–195. https://doi.org/10.1097/SHK.0000000000001976
[7] Lv, Y. N., Cui, Y., Zhang, B., & Huang, S. M. (2022). Sleep deficiency promotes Alzheimer’s disease development and progression. Frontiers in neurology, 13, 1053942. https://doi.org/10.3389/fneur.2022.1053942
[8] Ooms, S., Overeem, S., Besse, K., Rikkert, M. O., Verbeek, M., & Claassen, J. A. (2014). Effect of 1 night of total sleep deprivation on cerebrospinal fluid β-amyloid 42 in healthy middle-aged men: a randomized clinical trial. JAMA neurology, 71(8), 971–977. https://doi.org/10.1001/jamaneurol.2014.1173
[9] Nagy, S., Maurer, G. W., Hentze, J. L., Rose, M., Werge, T. M., & Rewitz, K. (2018). AMPK signaling linked to the schizophrenia-associated 1q21.1 deletion is required for neuronal and sleep maintenance. PLoS genetics, 14(12), e1007623. https://doi.org/10.1371/journal.pgen.1007623
[10] Hartmann, C., & Kempf, A. (2023). Mitochondrial control of sleep. Current opinion in neurobiology, 81, 102733. https://doi.org/10.1016/j.conb.2023.102733
[11] Otaiku A. I. (2022). Distressing dreams, cognitive decline, and risk of dementia: A prospective study of three population-based cohorts. EClinicalMedicine, 52, 101640. https://doi.org/10.1016/j.eclinm.2022.101640
[12] Lao, X. Q., Liu, X., Deng, H. B., Chan, T. C., Ho, K. F., Wang, F., Vermeulen, R., Tam, T., Wong, M. C. S., Tse, L. A., Chang, L. Y., & Yeoh, E. K. (2018). Sleep Quality, Sleep Duration, and the Risk of Coronary Heart Disease: A Prospective Cohort Study With 60,586 Adults. Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine, 14(1), 109–117. https://doi.org/10.5664/jcsm.6894
[13] Bonsignore, M. R., Mazzuca, E., Baiamonte, P., Bouckaert, B., Verbeke, W., & Pevernagie, D. A. (2024). REM sleep obstructive sleep apnoea. European respiratory review : an official journal of the European Respiratory Society, 33(171), 230166. https://doi.org/10.1183/16000617.0166-2023
[14] Kuehl, L. K., de Punder, K., Deuter, C. E., Martens, D. S., Heim, C., Otte, C., Wingenfeld, K., & Entringer, S. (2022). Telomere length in individuals with and without major depression and adverse childhood experiences. Psychoneuroendocrinology, 142, 105762. https://doi.org/10.1016/j.psyneuen.2022.105762
[15] Kuo, W. C., Hummel, K. P., Brown, R. L., Mead, K., & Liebzeit, D. J. (2025). Behavioral and Functional Adaptation to Chronic Stress in Older Adults. Nursing research, 74(4), 250–257. https://doi.org/10.1097/NNR.0000000000000823
[16] Ladwig, K. H., Brockhaus, A. C., Baumert, J., Lukaschek, K., Emeny, R. T., Kruse, J., Codd, V., Häfner, S., Albrecht, E., Illig, T., Samani, N. J., Wichmann, H. E., Gieger, C., & Peters, A. (2013). Posttraumatic stress disorder and not depression is associated with shorter leukocyte telomere length: findings from 3,000 participants in the population-based KORA F4 study. PloS one, 8(7), e64762. https://doi.org/10.1371/journal.pone.0064762
[17] Albanese, M., Liotti, M., Cornacchia, L., & Mancini, F. (2022). Nightmare Rescripting: Using Imagery Techniques to Treat Sleep Disturbances in Post-traumatic Stress Disorder. Frontiers in psychiatry, 13, 866144. https://doi.org/10.3389/fpsyt.2022.866144