生娃多怕老得快?關閉生育系統這一衰老“開關”,生完照樣延壽33%!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

在進化生物學裏,有個著名的一次性體細胞假説[1]。
該假説認為,生物體的能量資源有限,需要在維護體細胞(如修復損傷)和生育後代之間精打細算。一般,進化只要求體細胞的能量能維持到順利生完娃就行,等基因順利交接完,留給體細胞的“保養預算”就會被削減,體細胞損傷因此慢慢累積,衰老也隨之發生。

圖注:田鼠天敵多,大多活不過1歲,進化將大量資源用於其生命早期繁殖,幾乎懷着一胎哺着一胎
這解釋了一些研究中認為的,年輕時在生育上投入得越多,留給身體維護的資源就越少,越容易變老的説法。一些動物和人類研究顯示,生育投入減少確實可以活得更久一點[2,3]。
所以,必須要在生育和長壽之間糾結嗎?倒也不用。近期,哈佛大學醫學院的Vadim Gladyshev教授和一眾學者在《Nature Communications》上發表研究,道出了一個新的延壽辦法:即使年輕時耗費了生育資源,只要在成年甚至中年時,關閉生殖系中的一個分子“開關”,也能延長33%的壽命[4]!

時光派第六屆衰老幹預論壇將於今年9月開幕,我們有幸邀請到了本文作者之一、哈佛醫學院教授Vadim N. Gladyshev,為我們講述他所取得的學術研究成果。歡迎感興趣的朋友前來圍觀!接下來,先來一起看看在這篇研究中又發現了哪些延壽新見解。
想了解更多時光派第六屆衰老幹預論壇的相關信息?點擊下方卡片,後台回覆 第六屆 即可一鍵解鎖,更有參會、參展、合作等途徑等着你~

DIMT-1:新衰老調控“開關”?
所以,這個分子“開關”到底是誰呢?不賣關子,它就是——18S rRNA甲基轉移酶DIMT-1。
顧名思義,DIMT-1主要負責對核糖體(蛋白質的合成工廠)上的18S rRNA進行甲基化修飾(指N6,N6-二甲基化修飾,即m6,2A修飾),確保核糖體能正常、高效地翻譯mRNA攜帶的遺傳信息,從而製造出身體所需的蛋白質。
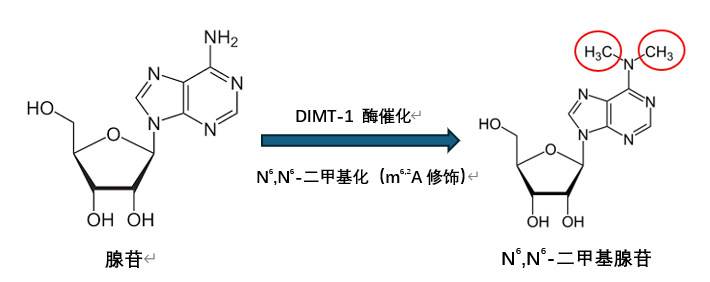
圖注:DIMT-1酶催化18S rRNA中特定位置的腺苷在N6位發生雙甲基化反應
研究發現,DIMT-1酶基因會隨着年齡增長而增加。當敲低秀麗隱杆線蟲體內的DIMT-1基因時,其壽命延長了約22%-33%,同時對紫外線和熱應激的抵抗能力也增強了。
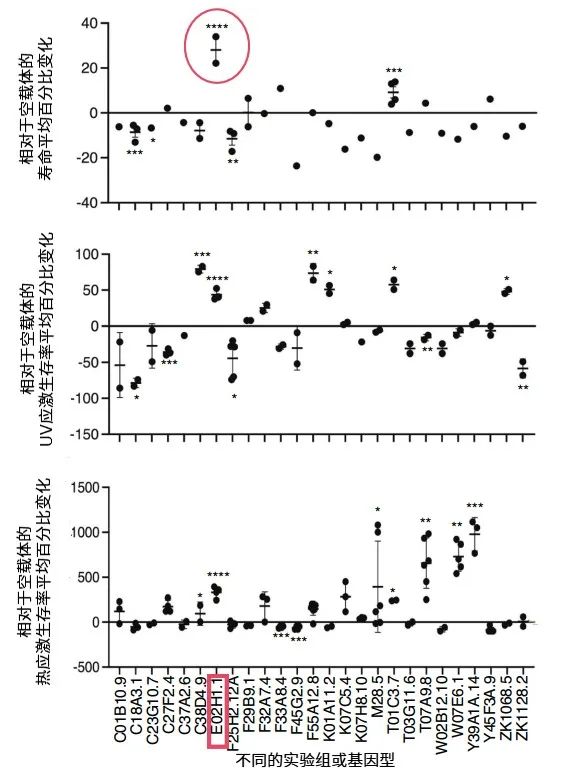
圖注:敲低不同核糖體RNA甲基轉移酶基因對線蟲壽命,及其對抗紫外線和熱應激的影響(PS:E02H1.1是DIMT-1基因在線蟲中的基因名稱)
準確來説,這種延壽好處具有一定的“地點”和“時間”特異性:
No.1
作用地點——生殖系
以往研究顯示,線蟲生殖系的缺失或功能障礙和它們的壽命變長有關[5]。研究人員想看看敲低DIMT-1帶來的長壽,是不是也和線蟲的生殖繫有關係?有沒有可能這種延壽效果就是因為影響了生殖系才帶來的?
於是,他們嘗試在glp-1(生殖系缺失長壽模型)和pgl-1(生殖系功能障礙模型)線蟲中敲低DIMT-1。有趣的是,這些線蟲要麼壓根沒延壽,要麼效果非常有限,比如glp-1線蟲的壽命甚至減少了5.23%。看來,線蟲的生殖系是參與了上述的延壽過程的。
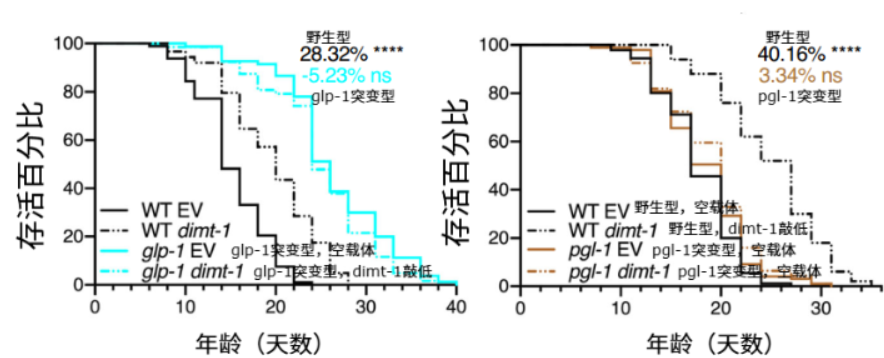
圖注:生殖系缺失或功能被破壞的突變型線蟲在DIMT-1敲低後延壽效果並不顯著
不僅參與,研究還發現,只有在生殖系中敲低DIMT-1時才有延壽的效果,在肌肉、腸道、神經元中同樣操作則沒有用。因此合理推測:敲低線蟲生殖系中的DIMT-1,能讓壽命變長。
No.2
作用時間——發育後期
另一個重要的發現是:敲低DIMT-1延壽的黃金干預期,在線蟲發育後期,甚至是中年階段,且與有沒有減少線蟲的生育成本沒有關係。
具體來説,如果只在線蟲出生到成年早期這段時間短暫地敲低DIMT-1,之後再恢復它的表達,線蟲的壽命並不會延長。但如果在線蟲成年、產卵結束(生完孩子後)甚至中年階段敲低DIMT-1,卻能延長約19%-25%的壽命。
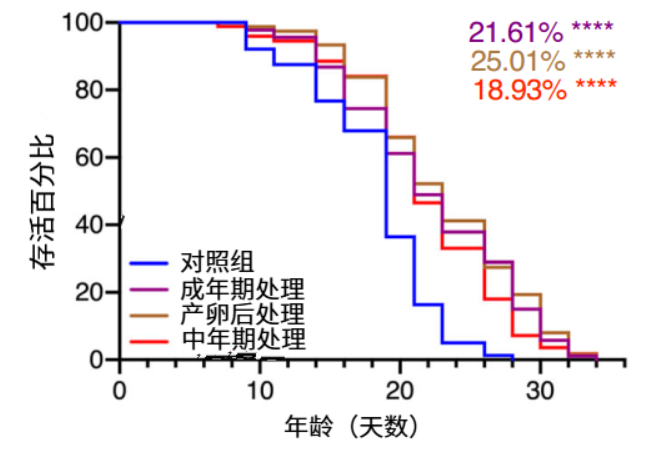
圖注:敲低DIMT-1的延壽效果
主要在發育後起作用
換句話説,DIMT-1是一個在發育後期、在生殖系中發揮關鍵作用的“衰老開關”。和早期節約生育成本的延壽思路有所不同,DIMT-1可能代表了一種干預衰老的新路徑!

深扒,DIMT-1的延壽路徑
那麼,敲低生殖系中的DIMT-1,是怎麼來延長壽命的呢?這裏面的機制總結起來就十二個字:改寫核糖體翻譯信息的指令。

前面提到,DIMT-1主要負責催化18S rRNA上的m6,2A甲基化修飾。它的修飾能幫助核糖體來翻譯mRNA攜帶的基因信息,從而維持對應蛋白質的生產。
現在把生殖系中的DIMT-1敲低了,能預見的是,核糖體翻譯蛋白質的“口味”多多少少得跟着變。不過,這變化未嘗不是件好事。
研究顯示,在線蟲生殖系中敲低DIMT-1後,核糖體與那些和壽命調節、應激反應、蛋白降解途徑等相關的mRNA的結合變多了,而與mTOR信號通路、核糖體生物發生等相關基因的結合減少了。
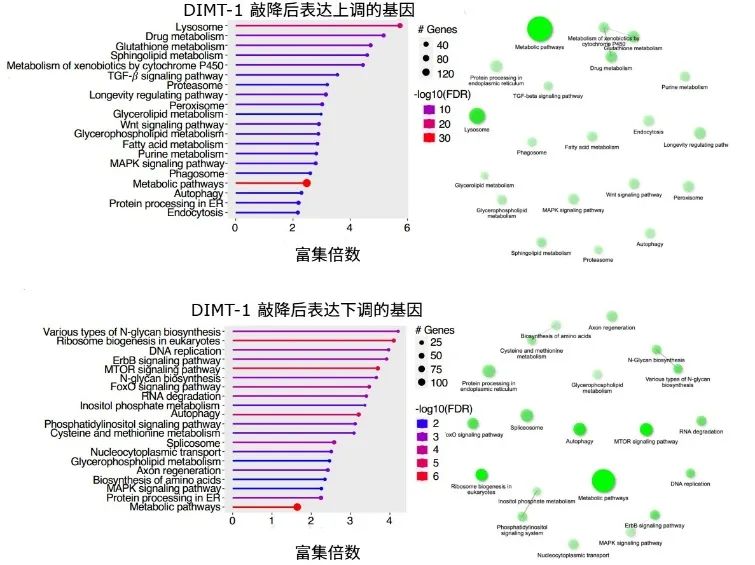
圖注:與對照相比,DIMT-1被敲低的線蟲中,相關通路的變化
在這些變化中,DAF-9基因尤為關鍵。在線蟲體內,生殖系表達的DAF-9通過合成類固醇激素dafachronic acid來激活全身性的核受體DAF-12,將來自生殖系的信號傳遞至機體,從而抑制線蟲進入dauer階段(一種耐逆境、長壽的休眠態),以維持其正常發育和壽命。
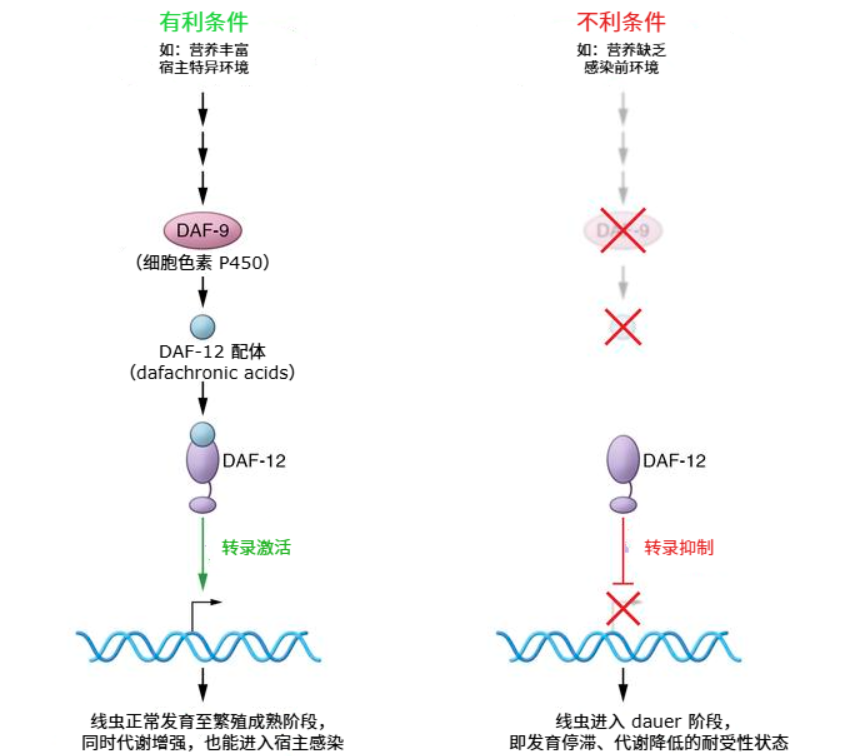
圖注:線蟲dauer階段本身是一種長壽狀態,研究其調控網絡(部分重現或借用這種狀態)有助於找到延緩衰老的分子開關[6]
在線蟲生殖系敲低DIMT-1後,攜帶DAF-9基因信息的mRNA數量雖然沒有變,但其與核糖體的結合卻明顯變少了,由此導致的DAF-9蛋白的減少可能進一步促使其下游受體DAF-12的激活被抑制,從而讓線蟲更容易地表現出了與dauer狀態時類似的抗逆和延壽特徵。
除了DAF-9/DAF-12通路,延壽效果還同時依賴DAF-16/FOXO和TOR通路的參與。如果DAF-16缺失,或把TOR通路上游的RAGA-1這個“營養感應器”破壞掉,再去敲低DIMT-1,線蟲壽命也不會延長,説明DIMT-1原來調節壽命相關的作用也離不開這兩條通路。(PS:DAF-16是一個FOXO轉錄因子,在很多長壽通路的最下游發揮作用)
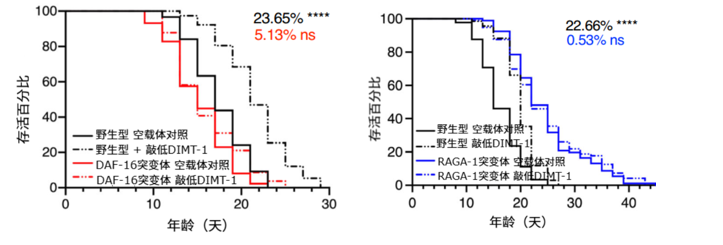
圖注:在DAF-16和RAGA-1突變線蟲中敲低DIMT-1後延壽效果也會減弱或者消失
可以推測,生殖系中的DIMT-1在個體年輕時用來維持高效翻譯、促進生長繁殖的模式可能在個體老年(此時更需要維護和修復)時變為一種負擔。敲低DIMT-1,通過改變核糖體翻譯mRNA的偏好,進一步改變生殖系-體細胞的信號轉導,從而調控整個生物體的衰老進程。

翻譯選擇性,衰老調控新維度
以往,談起蛋白質穩態失調,我們總會將其與衰老的關係定位於隨年齡增長出現的蛋白質合成變差(翻譯得太多、太少或錯了,如錯誤摺疊、聚集)、降解效率下降(垃圾蛋白清理不及時)等方面,如老年痴呆中β-澱粉樣蛋白和tau蛋白的異常聚集。
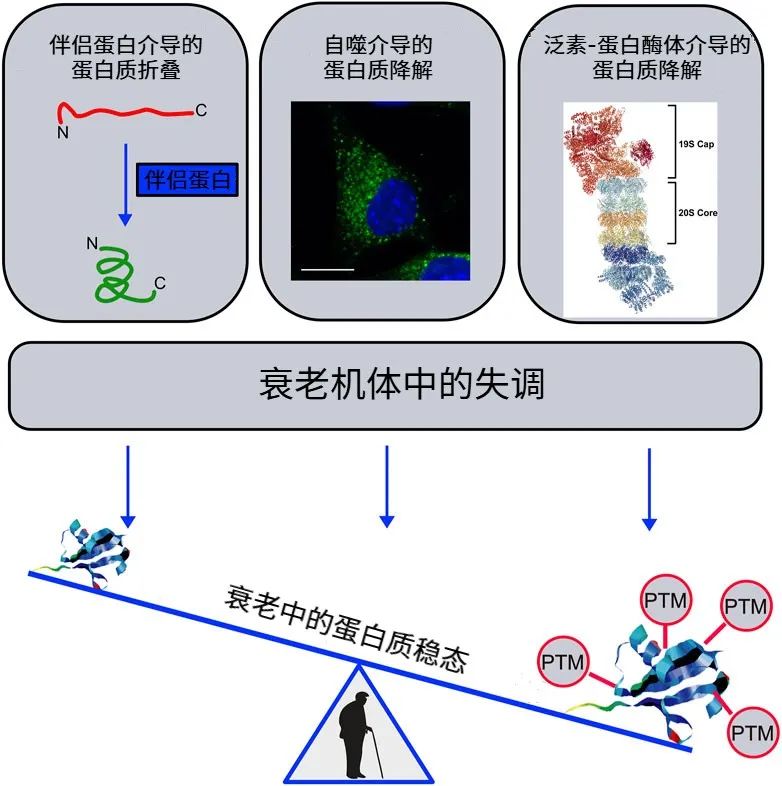
圖注:衰老生物體中蛋白質穩態失調[7]
目前來看,衰老不僅是蛋白質“造不好”,或垃圾蛋白“清理不掉”的問題,還有可能是細胞在最初選擇“翻譯哪些mRNA、製造哪些蛋白質”上出了問題。
在線蟲生命中後期,位於其生殖系中的DIMT-1可能就代表了這麼一種促衰機制。它隨着線蟲年齡的增長而增加,意味着它可能利用自己的甲基化修飾作用,引導生殖細胞的核糖體優先製造出了更多的DAF-9酶。
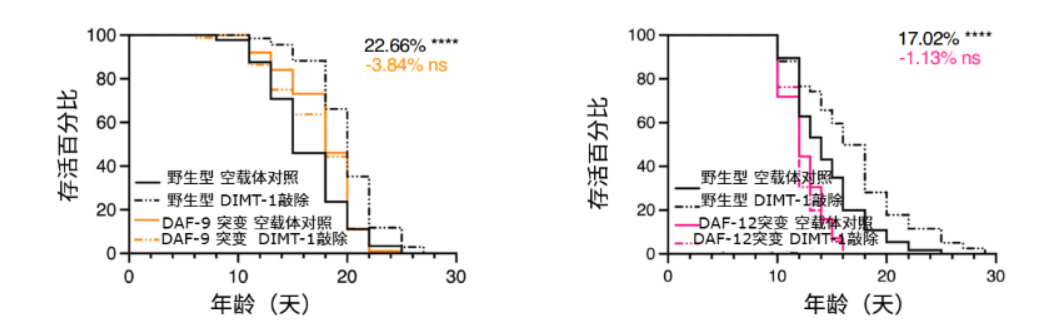
圖注:在DAF-9和DAF-12突變線蟲中敲低DIMT-1後延壽效果消失,説明DIMT-1原來調節壽命相關的作用依賴DAF-9/DAF-12通路
在生物體內,這將會是一個資源分配的關鍵決策點。DAF-9的大量生成會通過激活DAF-9/DAF-12通路,向全身持續下達“生長與繁殖”的指令。然而,對於已完成生育任務或中年的線蟲來説,這個指令的B面——“節能長壽”指令才是它們此刻真正需要的。
因此,當我們在線蟲生命中後期敲低DIMT-1時,相當於人為地關閉了它們體內一種“不合時宜”的指令,而間接觸發了另一種“節能長壽”的程序。效果自然是令人欣喜的:線蟲不僅活得更長了,抗壓能力也變得更強了。
那既然,衰老會在分子層面被“發育優先”的指令持續誘發。是不是意味着在未來,我們可能在關注蛋白質錯誤摺疊、壞蛋白清理不掉的問題之外,還能通過找到更多像DIMT-1這樣的核糖體修飾開關,幫助細胞從源頭上規避衰老誘因,規劃更加精準的生產策略?
參考文獻
[1] Kirkwood, T. Evolution of ageing. Nature 270, 301–304 (1977).
[2] Descamps, S., Boutin, S., Berteaux, D., & Gaillard, J. M. (2006). Best squirrels trade a long life for an early reproduction. Proceedings. Biological sciences, 273(1599), 2369–2374.
[3] Westendorp, R. G., & Kirkwood, T. B. (1998). Human longevity at the cost of reproductive success. Nature, 396(6713), 743–746.
[4] Rothi, M. H., Haddad, J. A., Sarkar, G. C., Mitchell, W., Ying, K., Pohl, N., Sotomayor, R., Natale, J., Dellacono, S., Gladyshev, V. N., & Greer, E. L. (2024). The 18S rRNA Methyltransferase DIMT-1 Regulates Lifespan in the Germline Later in Life. Research square, rs.3.rs-4421268.
[5] Khodakarami, A., Saez, I., Mels, J., & Vilchez, D. (2015). Mediation of organismal aging and somatic proteostasis by the germline. Frontiers in molecular biosciences, 2, 3.
[6]https://www.jci.org/articles/view/88890/figure/1.
[7] Pfirrmann, T., Chondrogianni, N., Olzscha, H., & Vasilaki, A. (2021). Editorial: Dysregulated Protein Homeostasis in the Aging Organism. Frontiers in molecular biosciences, 8, 788118.