Ⅰ型糖尿病治癒迎來 “破局”時刻_風聞
返朴-返朴官方账号-科普中国子品牌,倡导“溯源守拙,问学求新”。39分钟前
“前臂開一小口+若干精密編輯細胞植入”即可安全穩定地奏效。
編譯 | 希區客
 在瑞典的烏普薩拉大學醫院裏,一名有着37年Ⅰ型糖尿病史的42歲男性接受了經過基因編輯的異體胰島細胞注射。4個月後,這些胰島細胞依然正常運作,病人無需任何抗排異藥物即可持續自產胰島素——成為全球首例通過移植基因工程細胞成功治療Ⅰ型糖尿病的案例。
在瑞典的烏普薩拉大學醫院裏,一名有着37年Ⅰ型糖尿病史的42歲男性接受了經過基因編輯的異體胰島細胞注射。4個月後,這些胰島細胞依然正常運作,病人無需任何抗排異藥物即可持續自產胰島素——成為全球首例通過移植基因工程細胞成功治療Ⅰ型糖尿病的案例。
《新英格蘭醫學雜誌》(NEJM) 於2025年8月初報道了上述工作。項目團隊介紹稱,Ⅰ型糖尿病的發病機制是免疫系統錯誤攻擊胰腺內分泌胰島素的β細胞。參與此次治療的患者早已喪失自主生成胰島素的能力。
他們從O型血器官捐獻者 (已故) 的胰腺分離出胰島β細胞,並用CRISPR-Cas12b等技術改造、處理細胞,然後在全麻狀態下,分17個注射通道將7960萬個改造細胞植入患者的左側肱橈肌。
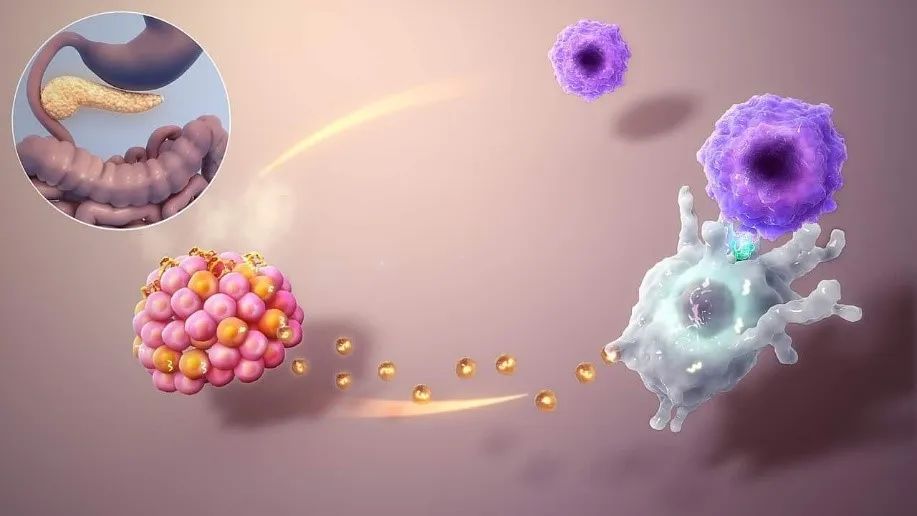 如上圖所示:Ⅰ型糖尿病患者體內,胰腺(左上)中負責分泌胰島素的胰島β細胞(左下粉紅色部分)會釋放外泌體(黃色圓點)。名為樹突狀細胞的免疫哨兵(右下)捕獲這些信號後,會激活T細胞(右上)對β細胞發起攻擊,從而導致胰島素分泌功能受損
如上圖所示:Ⅰ型糖尿病患者體內,胰腺(左上)中負責分泌胰島素的胰島β細胞(左下粉紅色部分)會釋放外泌體(黃色圓點)。名為樹突狀細胞的免疫哨兵(右下)捕獲這些信號後,會激活T細胞(右上)對β細胞發起攻擊,從而導致胰島素分泌功能受損
這裏要重點介紹對異體胰島的改造過程。
研究人員憑藉CRISPR-Cas12b工具敲除了β細胞的兩個關鍵基因,即B2M和CIITA,此二者編碼的蛋白質會向免疫系統發出“外來侵入”警報;接着,他們又增強了CD47蛋白,這是一種廣泛表達的跨膜蛋白,通過傳遞“別吃我”信號抑制巨噬細胞的吞噬作用。
如此操作下來,原本的異體細胞就變得“低免疫原性”,進入患者體內,既能躲過適應性免疫系統的識別,又能規避先天免疫攻擊,其引發排異的風險大大降低,可安心重建胰島素分泌功能。
我們知道,學界長期以來一直嘗試用供體胰島移植替換病人體內被破壞的細胞。此類治療模式雖有效,其代價卻是患者必須終身服用免疫抑制劑,這會顯著增加感染和癌症等嚴重疾病的風險。
因此烏普薩拉大學醫院團隊的策略始終是“不削弱免疫系統而讓移植細胞避開免疫監視”。試驗全過程未使用類固醇、抗炎藥物或免疫抑制劑。
治療結束後的12周裏,醫療團隊對參試者進行了嚴密監測。移植細胞中有一部分未經編輯或只作了一定程度的改造,它們很快被破壞,引起強烈的T細胞和抗體反應;而完全改造過的低免疫原性細胞則完全未被察覺。
研究作者在論文裏寫道:“在整個研究過程中,我們未檢測到任何針對低免疫原性胰島細胞的免疫反應。”
存活的細胞成功分泌胰島素——這體現在餐後穩定升高的C肽水平,標誌着一切如預期那樣正常運轉。糖化血紅蛋白(HbA1c)檢測顯示,患者的平均血糖水平下降約42%。(當然,每日注射胰島素仍為必要操作,因為移植細胞僅提供了完全替代所需胰島素量的7%左右。)
C肽全稱為連接肽(Connecting Peptide),是胰島素生物合成過程的副產物,也是β細胞功能標誌物,可用於鑑別糖尿病類型。
糖化血紅蛋白是臨牀上評估長期血糖控制的核心指標,其本質是紅細胞內血紅蛋白與葡萄糖結合的產物。
影像掃描顯示移植細胞存活良好,未見炎症反應。期間出現了四次輕微副作用,均與移植細胞無關。
 或許在不久的未來,胰島素注射會淡出大家視線
或許在不久的未來,胰島素注射會淡出大家視線
此次單病例概念驗證研究旨在評估療法的安全性與可行性,並非以治癒為目標。
項目團隊表示,下一步工作將提高細胞劑量並延長隨訪期,以探索患者能否完全擺脱胰島素注射依賴。
儘管研究尚處早期階段,但已有多年動物實驗打下的基礎,研究人員已充分了解低免疫原性細胞能在小鼠和猴類體內實現無需免疫抑制的長期存活,也看到了此技術預示的更廣闊應用前景——從理論上説,相同的基因編輯策略可保護其他移植組織或器官免遭排異反應。
對廣大Ⅰ型糖尿病患者而言,“無需服用危險藥物的治癒性胰島移植”曾是遙不可及的夢想。如今,隨着“前臂開一小口+若干精密編輯細胞植入”即可安全穩定地奏效,可以説夢想已跨出通向現實的一大步。
資料來源
A Man With Type 1 Diabetes Produces His Own Insulin After Receiving Millions of Gene Edited Pancreatic Cells,https://www.zmescience.com/medicine/a-man-with-type-1-diabetes-produces-his-own-insulin-after-receiving-millions-of-gene-edited-pancreatic-cells/
本文經授權轉載自微信公眾號“世界科學”。
 特 別 提 示
特 別 提 示
1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。