揭TRIM32在NSCLC轉移中的作用機制_風聞
葆力医学观察-专注生物科研领域,趣味科普与行业干货齐飞40分钟前
轉移顯著導致非小細胞肺癌(NSCLC)高死亡率,失巢凋亡抵抗在此過程中發揮關鍵作用。然而,TRIM32 在失巢凋亡抵抗及轉移中的作用尚未明確。2025年8月18日,蘇州大學張光波、Huang Xue共同通訊在cell death & differentiation上在線發表題為“TRIM32 promotes anoikis resistance and metastasis in NSCLC by degrading CHEK2 to enhance IL-6 secretion”的研究論文。該研究證實,TRIM32可增強非小細胞肺癌的失巢凋亡抵抗能力與轉移能力。研究驗證了TRIM32與CHEK2之間存在相互作用,並發現TRIM32通過K48連接的多聚泛素化介導CHEK2的降解。體外與體內實驗結果均表明,CHEK2可抑制非小細胞肺癌的失巢凋亡抵抗與轉移。此外,研究發現TRIM32能上調IL-6的表達,而CHEK2的過表達可逆轉該效應。進一步分析證實,IL-6在TRIM32介導的失巢凋亡抵抗與轉移中發揮關鍵作用。值得注意的是,在伴有淋巴結轉移的非小細胞肺癌組織中,TRIM32陽性(TRIM32+)、CHEK2陰性(CHEK2-)、IL-6陽性(IL-6+)的腫瘤細胞更為常見。綜上,該研究結果提示,通過CHEK2/IL-6軸靶向TRIM32以抑制失巢凋亡抵抗與轉移,或可為轉移性非小細胞肺癌的治療提供一種新型策略。

肺癌是最常見的癌症和癌症死亡的主要原因,其發病率和死亡率在全球範圍內均呈上升趨勢。根據組織病理學特徵,非小細胞肺癌(NSCLC)和小細胞肺癌(SCLC)是肺癌的兩大類,NSCLC佔所有肺癌病例的80-85%。NSCLC患者更容易發生轉移,即使I期NSCLC患者接受積極治療,復發和轉移率也可達21.7%,NSCLC轉移是目前臨牀上NSCLC患者治療失敗的主要原因,造成這種狀況的根本原因是對NSCLC轉移過程缺乏明確的認識,因此,研究非小細胞肺癌的轉移過程和尋找有希望的治療靶點可能會為非小細胞肺癌的臨牀治療帶來新的前景。腫瘤轉移是一個複雜的多步驟過程,包括癌細胞從原發部位分離,通過基底膜、細胞外基質和血管壁轉運,隨後通過淋巴和血液循環定植於遠處器官,該過程涉及EMT、血管和淋巴管的生成,以及腫瘤微環境和腫瘤幹細胞。失巢凋亡是由於細胞粘附或粘附介導的信號丟失而導致的一種凋亡形式。在正常細胞分化過程中,這種凋亡機制消除了失去適當組織錨定的移位細胞。然而,惡性腫瘤細胞產生了失巢凋亡抗性,使其能夠在脱離原發腫瘤部位後存活。這些彈性細胞隨後可以通過淋巴和循環系統擴散,最終在遠處器官中建立轉移性集落。鑑於失巢凋亡抵抗在腫瘤轉移中的重要作用,闡明其在非小細胞肺癌(NSCLC)中的分子機制對於理解轉移級聯反應至關重要,本研究可能為抑制NSCLC進展提供新的治療靶點。TRIM32是蛋白質的三聯體基序(TRIM)家族的成員,其由催化活性結構域(RING)、B-box結構域(B-box)、捲曲螺旋結構域和可變C-末端結構域(B30.2)。TRIM家族參與的泛素-蛋白酶體途徑,參與癌基因和抑癌基因的翻譯後修飾的調節,並與癌症進展密切相關。TRIM32已被證明與肌肉穩態、葡萄糖代謝、炎症自噬和癌症發展。在與癌症相關的研究中,已發現TRIM32與癌症遷移、侵襲和凋亡相關。然而,沒有研究將TRIM32與癌症的失巢凋亡抗性和轉移聯繫起來。該研究旨在探討TRIM32對NSCLC失巢凋亡抵抗和轉移的影響。研究表明,失巢凋亡抵抗的NSCLC細胞中存在TRIM32的高表達,並且TRIM32促進了NSCLC細胞的失巢凋亡抵抗、遷移、侵襲。進一步的機制研究已經證明,TRIM32直接與CHEK2相互作用,並通過K48介導的K48介導的CHEK2降解。該研究發現IL-6也參與了TRIM32介導的NSCLC失巢凋亡抵抗和轉移過程,揭示了TRIM32在NSCLC轉移中的作用機制,為臨牀治療NSCLC提供了新的候選策略。
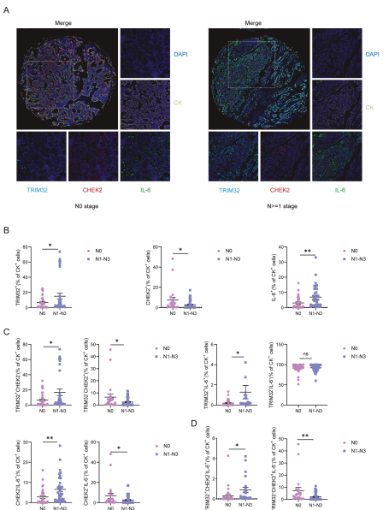
圖1 TRIM 32+ CHEK2 IL-6+ NSCLC細胞亞羣與NSCLC轉移呈正相關(摘自cell death & differentiation)參考消息:https://doi.org/10.1038/s41418-025-01559-8