夏天去海邊浪一次,衰老細胞暴增4.8倍?揭秘衰老細胞為何老而不死_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯13分钟前

我們的身體是一座龐大的生命工廠,細胞在流水線上勤勉工作,維持運轉。但工作達到分裂極限或嚴重損傷時,它們便啓動光榮退休,進入的退休狀態。
這些退休細胞選擇退居二線,依然保持着代謝活性,在組織里安度晚年。別急着罵它們偷懶,也別喊人家“殭屍”啦,科學家都搖頭了,讓細胞退休可是身體的保命符,能及時剎車癌變細胞、積極參與創傷修復。

但隨着年紀增長,這些衰老細胞躲避免疫細胞的清除,在關節、大腦等長期滯留,它們啃噬關節、擾亂大腦、加速器官衰退,甚至為癌症“添油加柴”!
下面跟着派派一起來追蹤這些細胞是如何一步步走向退休的,它們對身體有什麼影響,又如何躲避免疫細胞的清除從而引發骨關節炎、阿爾茨海默病等相關疾病……

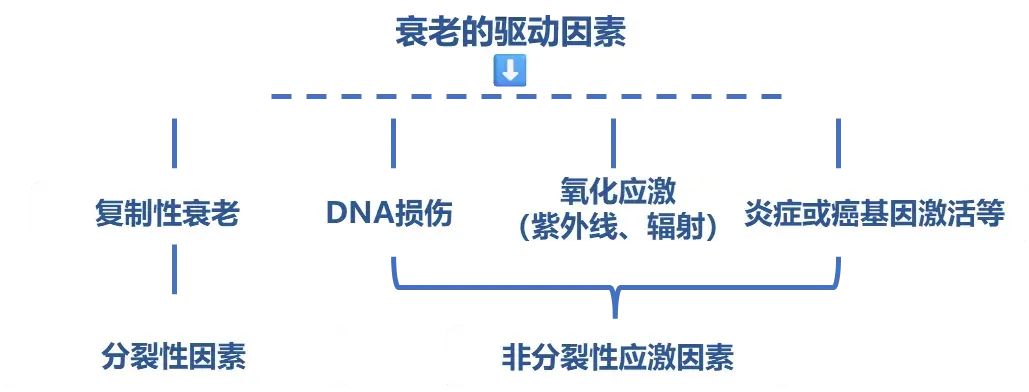
細胞衰老的因素
在我們漫長的生命長河中,細胞週而復始進行更新,在細胞衰老的過程中驅動細胞衰老的因素主要包括複製性衰老、DNA損傷、氧化應激(紫外線、輻射)、炎症或癌基因激活等。
複製性衰老
複製性衰老是由 “分裂疲勞期”引起的,每次細胞分裂,它的端粒就被磨損磨短一截。等端粒短到警戒線,它就在G0/G1期(細胞分裂前期)安心躺平,失去了增殖能力[1]。複製性衰老就是通過永久性增殖停滯,阻止受損細胞繼續分裂,從而抑制腫瘤發生[2]。
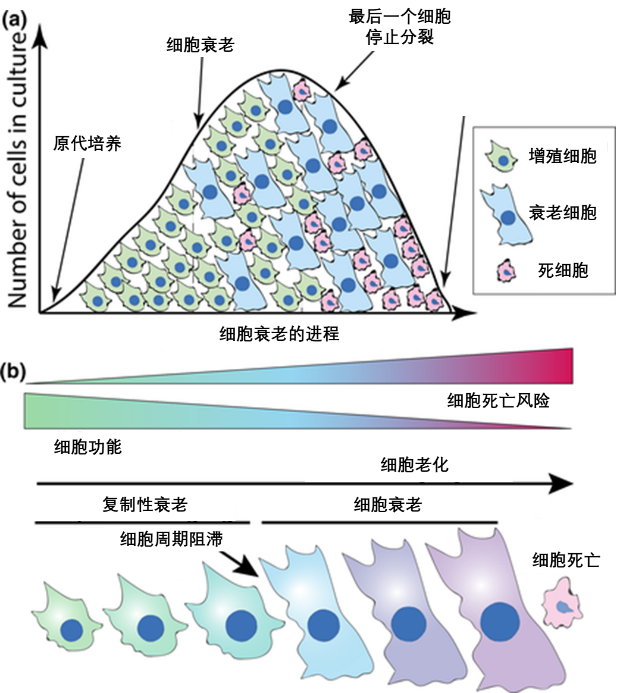
圖注:(a) 體外培養中細胞的生命週期曲線。細胞先會大量增殖;緊接着,衰老過程啓動,細胞增殖速率開始下降。最終階段是衰老後時期,細胞衰老持續進行,細胞羣體逐漸衰亡。(b) 細胞衰老是一個漸進的過程,它會逐漸降低細胞的功能並隨着時間推移增加細胞死亡的風險。
複製性衰老主要發生在細胞更新頻率高的細胞中,比如皮膚、腸道等組織中。那麼在我們身體內不同類型的細胞的分裂能力如何呢?
初始端粒長度和身體裏自帶的端粒酶(一種能修復、延長端粒的酶)活躍度,是決定分裂能力的根本原因。
No.1
普通體細胞:打工人註定“退休”
皮膚(表皮角質細胞)、結締組織(成纖維細胞)、血管內壁(內皮細胞),甚至T淋巴細胞等這些構成我們身體的“一線工作者”細胞,絕大部分都會經歷複製性衰老。
體細胞增殖能力是隨年齡增長下降,在胎兒中成纖維細胞的複製次數60-80次,成人20-40次,老年10-20次[3]。
圖注:成纖維細胞
No.2
替補員:幹細胞
幹細胞分裂能力強於體細胞,它們雖然能自我更新並分化為各種功能細胞,但是它們分裂的次數也是有限的,肌肉等組織里的幹細胞在體內能反覆分裂超過1000次[4]。
圖注:幹細胞的自我更新並分化為各種功能細胞
No.3
長生族:生殖細胞(精子和卵子)
生殖細胞天生自帶活躍的端粒酶,這使得它們可以不斷分裂更新。然而生殖功能衰退通常不是因為端粒耗盡的複製性衰老,更多是DNA損傷積累、環境壓力等原因造成的。
除此之外,在海弗裏克極限理論中提到,不同物種的細胞分裂次數和壽命的長短相關。人類成纖維細胞的體外分裂次數約為40-60次,因此理論壽命上限為100~150年。而加拉帕戈斯象龜的細胞體外可分裂約110次,壽命可達175年[5];小鼠細胞僅分裂約15次,壽命僅2~3年[6]。

看來這或許就是我們活不過烏龜,但能秒殺老鼠的原因。
非分裂性應激因素
相較於複製性衰老,更普遍的“催老”元兇是持續積累的DNA損傷和氧化應激(紫外線、輻射)等非分裂性應激因素的傷害。它們貫穿生命全程,影響着全身細胞,包括像腦細胞、心肌細胞這類幾乎不再分裂的細胞以及更新慢的組織細胞[7]。
然而,現有檢測技術存在關鍵侷限:我們缺乏明確的指標來辨別衰老細胞是源於複製性衰老還是由多種應激因子誘導的衰老。無論是測定β-半乳糖苷酶(SA-β-gal)活性,還是檢測P16或P21等核心衰老通路的標誌物,都無法追溯這些衰老細胞的“出身”[7]。

細胞的衰老狀態可能是數十年間輕微氧化損傷、間歇性炎症、零星DNA損傷等多種因素共同作用、累積疊加的結果,而非單一事件所致。
研究表明,一次或數次急性紫外線照射(模擬強日曬,誘導DNA損傷)即可在短時間內將88.7%的成纖維細胞轉化為衰老細胞(未照射組衰老細胞僅為18.2%)[8]。輻射誘導的衰老(非分裂性應激因素)是細胞對急性DNA損傷的一種快速應激反應,而複製性衰老則需要數十次分裂、歷時數週至數月的漸進積累。
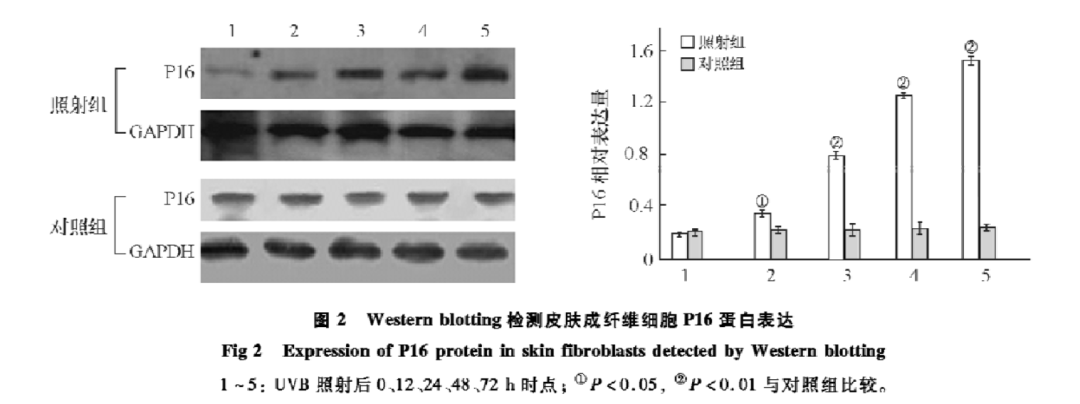
圖注:經過紫外照射後,照射組的P16表達顯著高於對照組(未照射紫外),在衰老
細胞中P16的表達更高

細胞在衰老後
功能主要發生了什麼改變?
無論是複製性衰老還是由DNA損傷、氧化應激等引起的細胞衰老,細胞在衰老後會發生哪些主要的變化呢,又對身體產生什麼樣的影響?下面一睹為快。
SASP的正面影響
別小看退休細胞,它們弄了一張複雜的衰老信號網(SASP)。SASP主要由數百個具有生物活性的小分子蛋白質(細胞因子)構成[9]。SASP在初期是有益的作用,比如在急性組織損傷後,SASP會促進組織修復[10];SASP還可以募集免疫細胞清除異常腫瘤細胞。
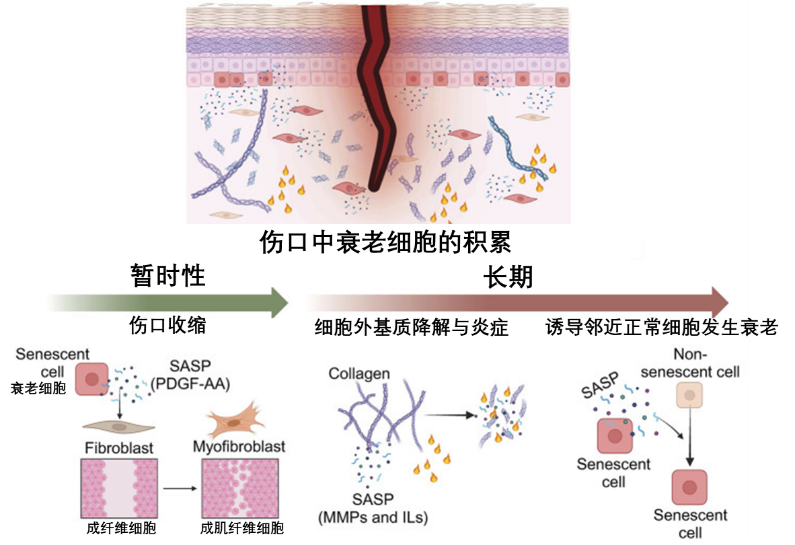
圖注:短暫和長期暴露於 SASP 的示意圖。短暫暴露於 SASP可誘導傷口再生;長期暴露於 SASP會阻滯再生並誘導鄰近正常細胞發生衰老。
但是當衰老細胞的清除機制失靈,導致它們在組織中長期存在並不斷積累時,其負面效應便會凸顯出來。
SASP的負面影響
SASP中含有大量的促炎因子,其長期、低度的釋放會在組織中造成一種慢性炎症狀態,這是許多年齡相關疾病(如動脈粥樣硬化、骨關節炎、神經退行性疾病等)的共同病理基礎[11]。
SASP還會抑制周圍幹細胞的增殖和分化潛能,從而損害組織的再生和修復能力,加速器官功能的衰退[12]。有研究表明年輕幹細胞和衰老幹細胞隔膜共培養(無法直接接觸,只能通過隔膜上的小孔交換彼此分泌的“信號分子”)時,衰老幹細胞分泌SASP相關炎症因子使年輕幹細胞的克隆數從11降低到了2,顯著降低了年輕幹細胞的增殖能力[13]。
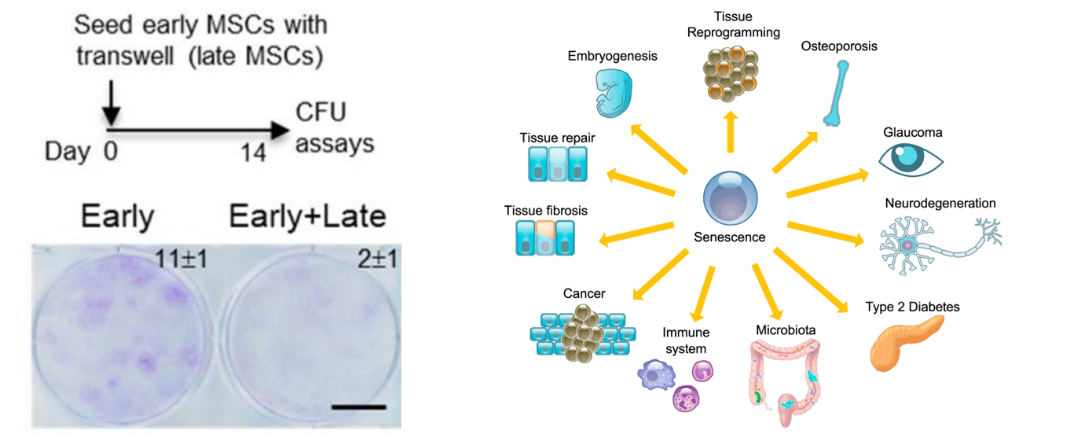
左圖:衰老幹細胞分泌的SASP顯著降低年輕幹細胞的克隆能力;右圖:SASP加速器官功能的衰退
儘管衰老本身能抑制腫瘤起始,但已形成的衰老細胞微環境,尤其是其SASP,反而可能為已存在的腫瘤細胞提供生長因子和血管生成的信號,促進腫瘤的惡性進展和轉移[14]。
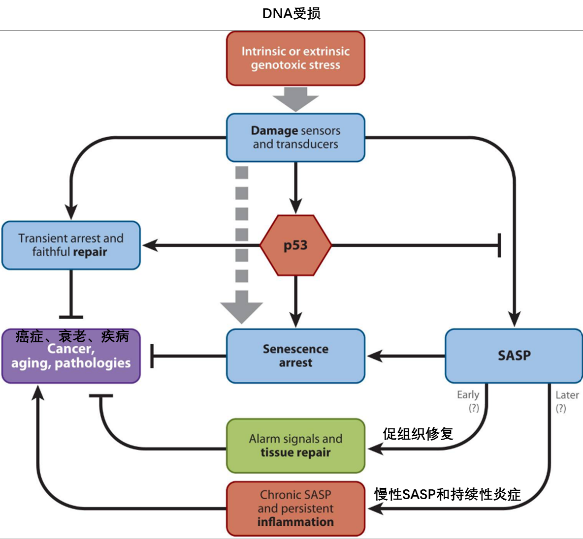
圖注:短期來看,SASP促進組織修復;但長期而言,SASP引發慢性炎症,進而驅動
癌症發生與機體衰老。

我們人體組織
哪些部位的衰老細胞難以清除?
衰老細胞的長期堆積SASP帶來負面的影響,那麼衰老細胞在我們身體哪些部位容易堆積,長期的堆積會導致什麼疾病呢?
根據目前的研究,身體裏有幾個地方衰老細胞喜歡賴着不走,這主要是因為它們獨特的生理環境。雖然科學家們目前還不能精確地量化和比較各個地方清理這些細胞的效率高低,但從背後的發生機制和衰老的較明顯的情況(或者病變最多)來看,這些“熱點區域”是存在的。
關節軟骨:免疫豁免與物理屏障
關節軟骨就像骨頭間的“緩衝墊”,裏面沒有血管,且它自身由非常緻密的細胞外基質(主要是膠原蛋白和蛋白聚糖)構成,這意味着血液裏的免疫細胞(如T細胞、NK細胞)幾乎無法進入。這導致局部免疫反應遲鈍,細胞更新換代的速度也極其緩慢。
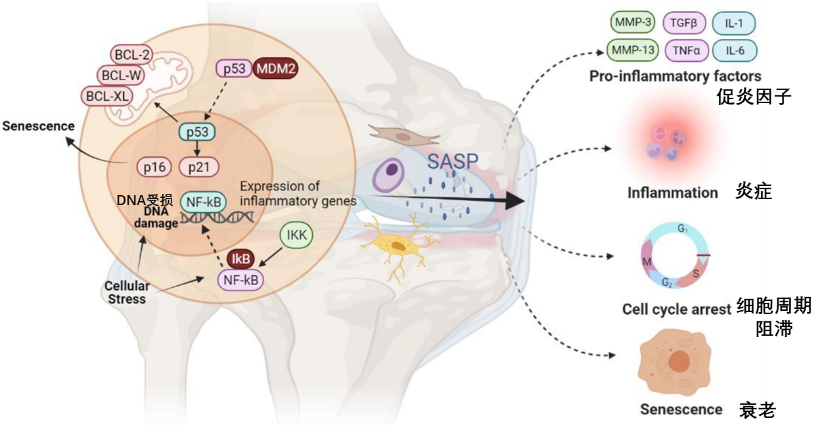
圖注:當細胞遭受DNA損傷的應激刺激時,p53、p21等衰老相關蛋白表達上調,導致細胞週期阻滯及衰老發生。此外上調SASP因子,另一方面增強BCL蛋白家族等抗凋亡因子的表達(賴着不走)。這些SASP因子可從軟骨細胞、骨細胞等關節組織中向外擴散,進而形成"炎症-衰老-組織降解"的惡性循環。
在骨關節炎等退行性疾病中,這些“賴着不走”的衰老軟骨細胞會大量堆積。它們並非無害,而是持續釋放SASP(如基質金屬蛋白酶MMPs),不斷溶解破壞周圍的健康軟骨基質,加速關節磨損[15]。
大腦:血腦屏障與特殊的免疫微環境
大腦是神經退行性疾病(如阿爾茨海默病)中衰老細胞極易積聚的關鍵部位,其核心原因在於大腦擁有獨特的生理屏障——血腦屏障,其會限制免疫細胞向大腦的浸潤,削弱了腦內衰老細胞的監視與清除能力[16,17]。
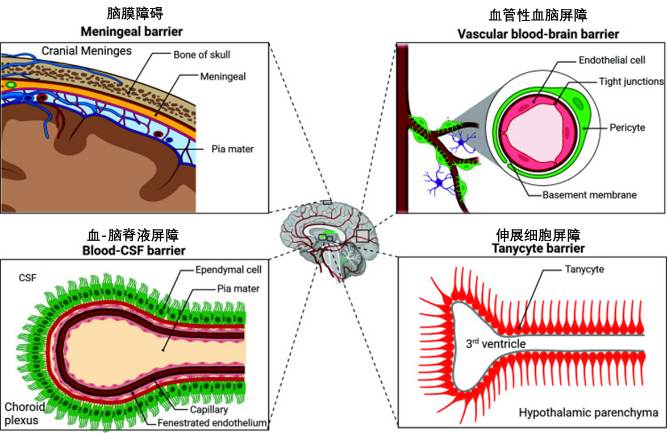
圖注:血腦屏障的四種類型
除此之外,衰老的神經膠質細胞,尤其星形膠質細胞,會表達PD-L1,PD-L1 通過與免疫細胞(如小膠質細胞)表面的 PD-1 受體結合,抑制其清除活性,助力衰老細胞逃避被清除[18]。
纖維化組織:緻密基質的阻礙
在肝硬化或肺纖維化等纖維化組織中,細胞外基質(ECM,細胞生存的環境),形成堅硬緻密的物理屏障。
更關鍵的是,在肝臟纖維化中,衰老的肝星狀細胞(HSCs)扮演了驅動角色,它們不僅自身難以清除,其分泌SASP因子更能持續激活鄰近的HSCs,導致更多ECM沉積,最後這道物理屏障越砌越厚[19]。肺纖維化中,衰老的成纖維細胞等細胞也具有類似作用[20]。
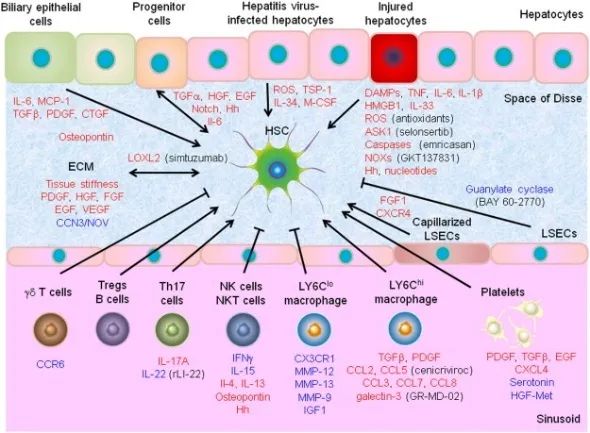
圖注:肝星狀細胞由肝實質細胞(肝臟中主力細胞,將藥物、酒精、毒素等有害物轉化成無毒物質)、ECM成分及循環免疫細胞進行調控
從派派總結的情況,不難看出關節軟骨、大腦、纖維化組織因其獨特物理屏障(如無血管、血腦屏障、緻密基質)成為衰老細胞較難清除的 “避難所”。這些細胞的頑固積聚是難治性老年病的關鍵病理基礎。

如何清除衰老的細胞
既然衰老細胞的過度積累是衰老和多種疾病的驅動力,那麼靶向清除它們,無疑為延緩衰老和治療相關疾病提供了一個極具前景的策略。基於此,Senolytic療法應運而生(“Seno”意為衰老,“lytic”意為摧毀)。
由於Senolytic藥物是一次性清除衰老細胞,所以一般是每隔一段時間,等衰老細胞積累起來再給藥,這樣效果更好[21]。目前已有多種Senolytics藥物進入了針對特定年齡相關疾病的臨牀試驗,初步結果顯示了良好的安全性。感興趣的可以閲讀派派以前總結的Senolytic療法推文。
我們有理由相信,隨着對衰老細胞理解的不斷深入,這些謎題終將被逐個攻破。一個更健康、更有活力的老齡化未來等着我們。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1]Fujita, K., Horikawa, I., Mondal, A. M., Jenkins, L. M., Appella, E., Vojtesek, B., Bourdon, J. C., Lane, D. P., & Harris, C. C. (2010). Positive feedback between p53 and TRF2 during telomere-damage signalling and cellular senescence. Nature cell biology, 12(12), 1205–1212. https://doi.org/10.1038/ncb2123
[2] Lansdorp P. (2022). Telomere Length Regulation. Frontiers in oncology, 12, 943622. https://doi.org/10.3389/fonc.2022.943622
[3] Campisi, J. (1996). Replicative Senescence: An Old Lives’ Tale? Cell, 84(4), 497–500. https://doi.org/10.1016/S00928674(00)810235
[4] Rubin, H. (2002). The disparity between human cell senescence in vitro and lifelong replication in vivo. Nature Biotechnology, 20(7), 675–681. https://doi.org/10.1038/nbt0702675
[5] 印大中,劉希彬. 衰老及相關基因羣[J]. 生命科學研究,2002,6(1):20-30. DOI:10.3969/j.issn.1007-7847.2002.01.002.
[6] EarthSky Voices. (2013, June 19). Breaking the 120-year barrier in human aging | Human World | EarthSky. EarthSky | Updates on Your Cosmos and World. https://earthsky.org/human-world/lust-for-life-breaking-the-120-year-barrier-in-human-aging/
[7] Noren Hooten, N., Evans, M. K. Techniques to Induce and Quantify Cellular Senescence. J. Vis. Exp. (123), e55533, doi:10.3791/55533 (2017).
[8] 胡孝輝, 高豐厚, 方 勇, & Yong. (2010). 中波紫外線誘導人皮膚成纖維細胞衰老及機制研究. 上海交通大學學報(醫學版), 30(7), 807. https://xuebao.shsmu.edu.cn/CN/abstract/abstract8758.shtml
[9] Gorgoulis, V., Adams, P. D., Alimonti, A., Bennett, D. C., Bischof, O., & Bishop, C., et al. (2019). Cellular senescence: defining a path forward. Cell, 179(4), 813-827. https://doi.org/10.1016/j.cell.2019.10.005
[10] Chin, T., Lee, X. E., Ng, P. Y., Lee, Y., & Dreesen, O. (2023). The role of cellular senescence in skin aging and age-related skin pathologies. Frontiers in physiology, 14, 1297637. https://doi.org/10.3389/fphys.2023.1297637
[11] Covarrubias, A. J., Perrone, R., Grozio, A., & Verdin, E. (2021). NAD+ metabolism and its roles in cellular processes during ageing. Nature reviews. Molecular cell biology, 22(2), 119–141. https://doi.org/10.1038/s41580-020-00313-x
[12] Calcinotto, A., Kohli, J., Zagato, E., Pellegrini, L., Demaria, M., & Alimonti, A. (2019). Cellular Senescence: Aging, Cancer, and Injury. Physiological reviews, 99(2), 1047–1078. https://doi.org/10.1152/physrev.00020.2018
[13] Chou, L. Y., Ho, C. T., & Hung, S. C. (2022). Paracrine Senescence of Mesenchymal Stromal Cells Involves Inflammatory Cytokines and the NF-κB Pathway. Cells, 11(20), 3324. https://doi.org/10.3390/cells11203324
[14] Coppé, J. P., Desprez, P. Y., Krtolica, A., & Campisi, J. (2010). The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual review of pathology, 5, 99–118. https://doi.org/10.1146/annurev-pathol-121808-102144
[15] Astrike-Davis, E. M., Coryell, P., & Loeser, R. F. (2022). Targeting cellular senescence as a novel treatment for osteoarthritis. Current opinion in pharmacology, 64, 102213. https://doi.org/10.1016/j.coph.2022.102213
[16] Qosa, H., Abuasal, B. S., Romero, I. A., Weksler, B., Couraud, P. O., Keller, J. N., & Kaddoumi, A. (2014). Differences in amyloid-β clearance across mouse and human blood-brain barrier models: kinetic analysis and mechanistic modeling. Neuropharmacology, 79, 668–678. https://doi.org/10.1016/j.neuropharm.2014.01.023
[17] Zhang, S., Meng, R., Jiang, M., Qing, H., & Ni, J. (2024). Emerging Roles of Microglia in Blood-Brain Barrier Integrity in Aging and Neurodegeneration. Current neuropharmacology, 22(7), 1189–1204. https://doi.org/10.2174/1570159X21666230203103910
[18] Zhang, A., Liang, J., Lao, X., Xia, X., Li, S., & Liu, S. (2025). Single-Cell Sequencing Reveals PD-L1-Mediated Immune Escape Signaling in Lung Adenocarcinoma. Journal of Cancer, 16(5), 1438–1450. https://doi.org/10.7150/jca.103656
[19] Higashi, T., Friedman, S. L., & Hoshida, Y. (2017). Hepatic stellate cells as key target in liver fibrosis. Advanced drug delivery reviews, 121, 27–42. https://doi.org/10.1016/j.addr.2017.05.007
[20] Lehmann, M., Korfei, M., Mutze, K., Klee, S., Skronska-Wasek, W., Alsafadi, H. N., Ota, C., Costa, R., Schiller, H. B., Lindner, M., Wagner, D. E., Günther, A., & Königshoff, M. (2017). Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo. The European respiratory journal, 50(2), 1602367. https://doi.org/10.1183/13993003.02367-2016
[21] Hernandez-Segura, A., Brandenburg, S., & Demaria, M. (2018). Induction and validation of cellular senescence in primary human cells. Journal of visualized experiments: JoVE, (136). https://doi.org/10.3791/57782