40歲後大腦“斷電”?兩種日常成分16小時讓GTP“滿血復活”_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯08-29 07:51

在阿爾茨海默病(AD)患者的大腦中,β-澱粉樣蛋白(Aβ)像垃圾一樣堆積成山。在過去三十年中,澱粉樣蛋白級聯假説[1]幾乎統治了整個AD研究領域,它的核心理論是,Aβ的產生和過度積累是AD病理過程的始動環節。一批又一批的專家學者針對Aβ清除嘗試了多種方案卻屢屢受挫[2],引起了更多的反思和探索。
直到2022年,一篇重磅文章[3]在《Nature》橫空出世,揭示了Aβ的堆積可能並非病因,而是細胞內垃圾處理系統失靈的結果。這解釋了為何單純靶向清除Aβ的療法效果不佳——因為干預太晚,且未觸及病理的根源。
如今,一篇發表於《GeroScience》的研究[4]進一步揭示,衰老導致的GTP能量短缺,可能是細胞內自噬系統罷工的元兇。未來的AD治療,或許該從“清理垃圾”轉向“修理垃圾車”。


DIMT-1:新衰老調控“開關”?
設想我們的大腦系統是一座高度完善的城市,這座城市需要足夠的電量來維持運轉。能量貨幣包括兩種,為人熟知的ATP(三磷酸腺苷)主要負責供電,本文的主角GTP(三磷酸鳥苷)則主要負責物流和環衞系統:囊泡運輸和驅動自噬。

圖注:杭州智慧環衞系統
GTP如果能夠正常工作,流程大概是這樣的:線粒體通過三羧酸循環(TCA)合成GTP,GTP通過Rab5、Rab7等GTP酶驅動內吞,並通過Arl8b等關鍵因子驅動自噬。這一大堆陌生的數字字母組合並不重要,重要的是我們想知道這兩個問題:
衰老是不是真的會降低GTP?降低GTP是不是真的會影響自噬?
研究人員分別從年輕(2-6個月)、中年(8-11個月)和老年(17-28個月)的普通小鼠和具有AD基因的小鼠模型中分離出了大腦神經元細胞,通過熒光傳感器測量細胞中的GTP水平。不出所料,衰老會導致大腦神經元GTP的水平下降,在AD模型中更是在中年時期就顯著下降了(大約僅相當於人的四十多歲)。
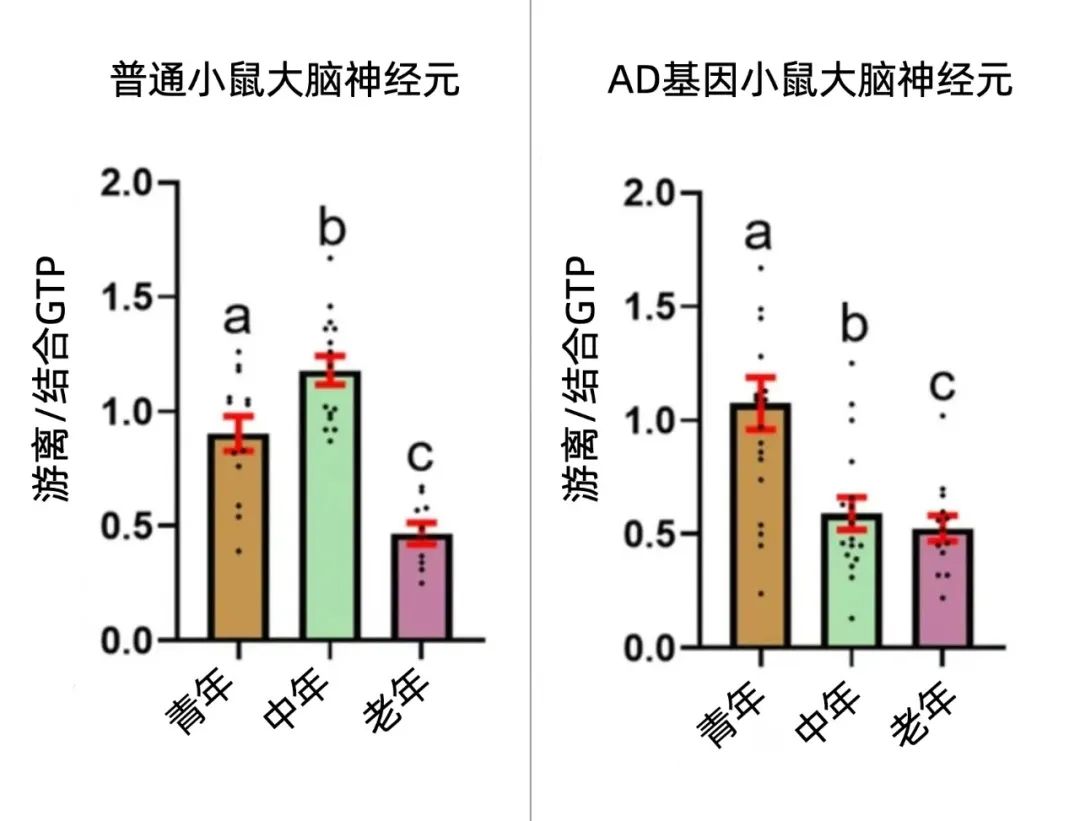
圖注:GTP不斷從TCA循環和細胞質ATP中動員起來,以滿足各種細胞功能對遊離GTP的需要,可以理解為,遊離GTP的比率越高,就有越多的GTP參與細胞活動
關於自噬我們更有的是方法和手段:研究人員使用巴弗洛黴素抑制自噬,發現大量減少工作量後,兩邊的遊離GTP都顯著地上升了,説明這些GTP本來負責自噬的工作,現在由於自噬被抑制而進入了“待業”狀態。然後又用雷帕黴素誘導自噬,結果發現,正常小鼠的神經元中GTP確實隨着自噬誘導大幅地消耗了,而AD神經元中,GTP則失去了對自噬變化作出反應的能力。
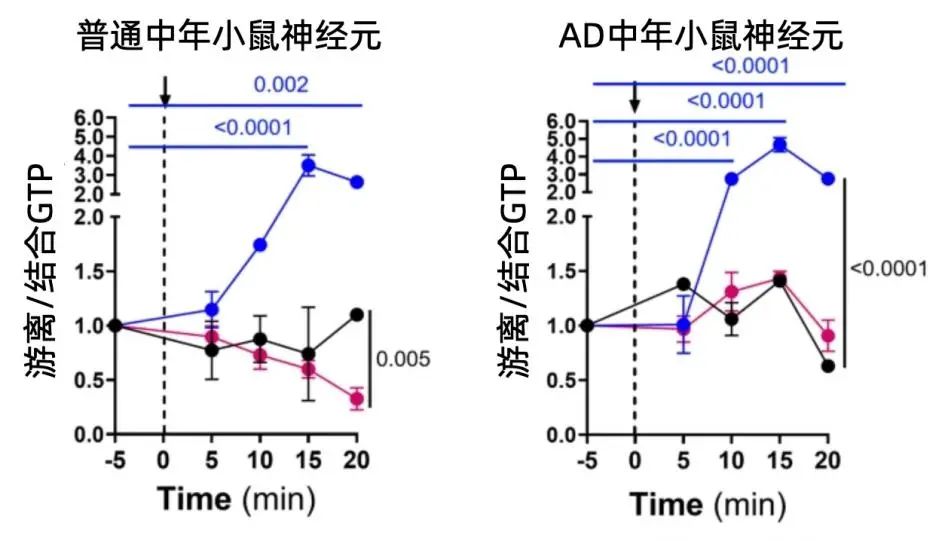
圖注:黑色為未經處理時的遊離/結合GTP曲線,藍色為巴弗洛黴素處理後,紅色為雷帕黴素處理後。縱座標的數值越大,表明更多的遊離GTP失去了工作
這兩項結果顯示,在AD的大腦中,GTP不管是從數量還是質量上,運作起來都非常勉強。

修復方案:開源+節流雙管齊下
既然發現了問題的根源是GTP的缺陷,那麼接下來的修復思路就很明確了:我們要增加GTP的生產,並且保證有足夠的GTP走到自噬的崗位上。
前面我們説,線粒體的TCA循環能夠合成GTP,而煙酰胺就是這個過程中的98號汽油:它是一種常用的NAD+前體,能夠有效激活TCA循環,直接促進GTP的生成。
不過,TCA的促進也會增加氧自由基的產生,可是清理ROS對衰老的大腦本身就是不小的負擔。因此科學家在干預方案中添加了綠茶提取物EGCG(表沒食子兒茶素沒食子酸酯),它具有強大的抗氧化能力[5],能夠為GTP的生成保駕護航。

設計好了修復方案,我們要考察的效果同樣包含兩個部分:GTP有沒有真的增加?增加的GTP有沒有好好工作?

充電16小時,運行……?
結果是樂觀的。16小時的孵育後,老年神經元的遊離GTP水平顯著上升了,而且煙酰胺+EGCG的聯合用藥得到了最為顯著的效應。在AD小鼠的神經元中效果更好:甚至能夠恢復到年輕時候的狀態。
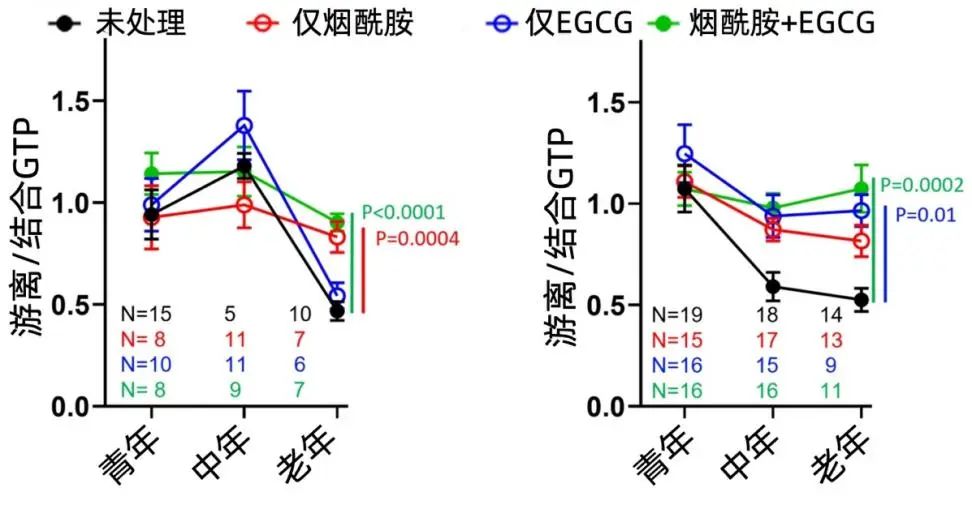
圖注:縱座標為遊離/結合GTP。遊離GTP的比率上升,表明有更多的GTP被生產出來,可以用於自噬的工作
功能方面,GTP酶就是很好的衡量GTP是否正常工作的指標,科學家檢測了Rab7和Arl8b的積累情況。結果發現,老年小鼠神經元中Rab7和Arl8b大量積聚,而煙酰胺+EGCG干預後,隨着更多GTP加入工作,GTP酶也都去到了自己的崗位,而不是無所事事地堆積在一起。
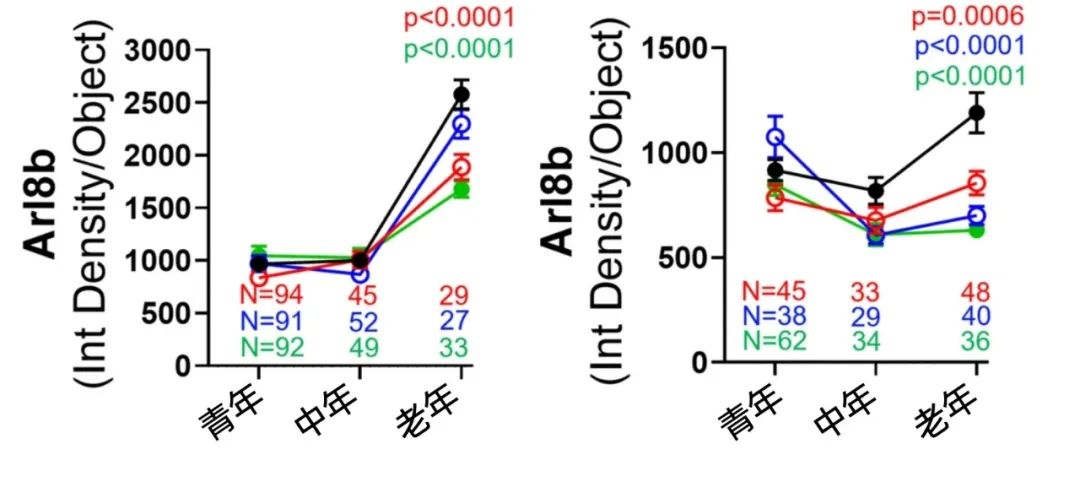
圖注:縱座標為GTP酶Arl8b。黑色為未進行任何干預,紅色為僅煙酰胺干預,藍色為僅EGCG干預,綠色為煙酰胺+EGCG干預。左圖為普通基因型的小鼠神經元,右圖為AD小鼠神經元
在機制裏走了一大圈,也不能忘了AD大腦中大量堆積的Aβ,如果Aβ也能得到清理,才能説明這項針對GTP的修復方案真正產生了效果。研究結果顯示,16小時的煙酰胺+EGCG聯合治療後,老年AD小鼠神經元的Aβ沉積降低到了接近普通老年小鼠的程度。
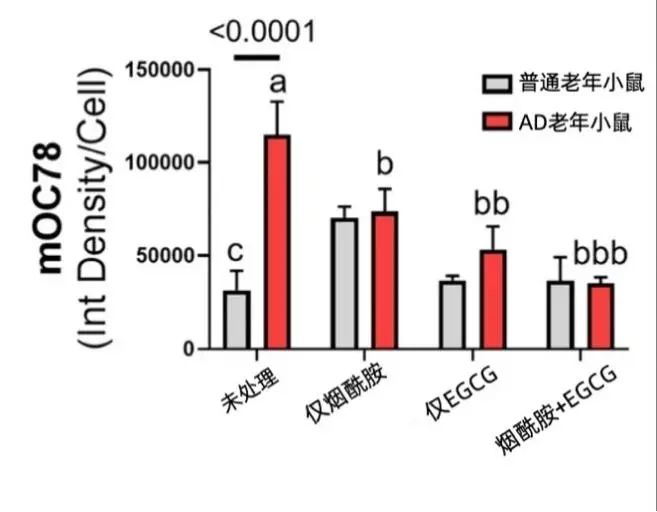
圖注:縱座標mOC78為Aβ的定量指標,數值越大,表明神經元中Aβ蓄積越多
這些結果令人振奮:這項聯合治療可以恢復GTP的生產,促進其內吞和自噬功能,清理Aβ,在細胞實驗中表現出了非常優秀的修復能力!

站在細胞實驗的窗口
到這裏為止,這項研究為AD的治療給出了一個全新的策略,從“清掃垃圾”到“修理垃圾車”,或許未來的AD治療將走向“多管齊下”的模式:補充能量燃料,維護細胞抗氧化功能,優化垃圾處理系統的整體效率。

然而細胞實驗僅僅是一個開始,一個研究就能折射出很多很多問題:我們是否需要準確地定位到干預的最佳時間窗口?細胞內的結果推向動物再推向人羣會順利嗎?多項實驗反映出的AD的性別差異會對療效有影響嗎?……
好在,我們已從這個窗口窺見了一點小小的光亮,只要順着有光的地方走下去,總有一天會“復行數十步,豁然開朗”。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] HARDY J A, HIGGINS G A. Alzheimer’s disease: the amyloid cascade hypothesis [J]. Science, 1992, 256(5054): 184–5.
[2] DE OLIVEIRA J, KUCHARSKA E, GARCEZ M L, et al. Inflammatory Cascade in Alzheimer’s Disease Pathogenesis: A Review of Experimental Findings [J]. Cells, 2021, 10(10).
[3] LEE J H, YANG D S, GOULBOURNE C N, et al. Faulty autolysosome acidification in Alzheimer’s disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques [J]. Nat Neurosci, 2022, 25(6): 688–701.
[4] SANTANA R A, MCWHIRT J M, BREWER G J. Treatment of age-related decreases in GTP levels restores endocytosis and autophagy [J]. GeroScience, 2025.
[5] SHARIFZADEH M, RANJBAR A, HOSSEINI A, et al. The Effect of Green Tea Extract on Oxidative Stress and Spatial Learning in Streptozotocin-diabetic Rats [J]. Iran J Pharm Res, 2017, 16(1): 201–9.