給大腦補“鋰”後,丟失的記憶力奇蹟般恢復了_風聞
返朴-返朴官方账号-科普中国子品牌,倡导“溯源守拙,问学求新”。08-29 13:53
 哈佛醫學院8月在《自然》上發表了一項重磅研究,揭示了阿爾茨海默病患者大腦中普遍缺乏鋰。這種“缺鋰”狀態會加速病理惡化。更驚人的是,給小鼠補充一種特殊的鋰後,它們的記憶力竟得以恢復!這意味着,金屬鋰缺乏可能是阿爾茨海默病早期的關鍵驅動因素,為該病的早期防治提供了新的治療方向。
哈佛醫學院8月在《自然》上發表了一項重磅研究,揭示了阿爾茨海默病患者大腦中普遍缺乏鋰。這種“缺鋰”狀態會加速病理惡化。更驚人的是,給小鼠補充一種特殊的鋰後,它們的記憶力竟得以恢復!這意味着,金屬鋰缺乏可能是阿爾茨海默病早期的關鍵驅動因素,為該病的早期防治提供了新的治療方向。
撰文 | 李娟
認知能力下降是衰老的自然過程,通常始於65歲以後。隨着年齡增長,痴呆症的患病率也顯著上升。阿爾茨海默病(Alzheimer’s disease,AD)是一種導致嚴重認知障礙的神經退行性疾病,約佔痴呆症病例的60%-80%,其臨牀表現包括認知功能障礙、記憶力喪失以及人格改變。
儘管該病的具體發病機制尚未完全明確,其最典型的核心病理包括大腦中β-澱粉樣蛋白(Aβ)斑塊的沉積和tau蛋白的異常磷酸化,進而形成神經原纖維纏結,最終損害記憶和認知能力。目前此病尚無根治方法,因此尋找有效的預防和緩解策略尤為迫切。
 圖1 阿爾茨海默病的病因與風險因素。 左圖:APP、PSEN1和PSEN2的罕見突變為AD的強遺傳病因;APOE、TREM2、CD33等與脂質代謝、內吞及炎症相關的基因變異較常見,為中低AD風險;AD環境風險含衰老、心臟和代謝疾病(如糖尿病、高血壓)、教育水平、社會參與度降低及嚴重創傷性腦損傷。右圖:AD神經病理學特徵為腦內β-澱粉樣蛋白(Aβ)斑塊和神經原纖維纏結(NFTs)。Aβ因APP異常加工(被β-、γ-分泌酶而非α-分泌酶切割)產生,易錯誤摺疊聚集形成寡聚物和斑塊,引發小膠質細胞、星形膠質細胞促炎反應;Aβ還致tau蛋白過度磷酸化,使其與微管分離、微管不穩定,過度磷酸化的tau聚集形成NFTs,與神經元丟失及神經退行性變相關。圖源:參考文獻[1]
圖1 阿爾茨海默病的病因與風險因素。 左圖:APP、PSEN1和PSEN2的罕見突變為AD的強遺傳病因;APOE、TREM2、CD33等與脂質代謝、內吞及炎症相關的基因變異較常見,為中低AD風險;AD環境風險含衰老、心臟和代謝疾病(如糖尿病、高血壓)、教育水平、社會參與度降低及嚴重創傷性腦損傷。右圖:AD神經病理學特徵為腦內β-澱粉樣蛋白(Aβ)斑塊和神經原纖維纏結(NFTs)。Aβ因APP異常加工(被β-、γ-分泌酶而非α-分泌酶切割)產生,易錯誤摺疊聚集形成寡聚物和斑塊,引發小膠質細胞、星形膠質細胞促炎反應;Aβ還致tau蛋白過度磷酸化,使其與微管分離、微管不穩定,過度磷酸化的tau聚集形成NFTs,與神經元丟失及神經退行性變相關。圖源:參考文獻[1]
過去三十多年,相關治療研究多圍繞Aβ等病理蛋白,然而多項針對Aβ的治療試驗並未給患者帶來顯著的認知益處,有時甚至有害。有研究者認為,除了蛋白質病理,阿爾茨海默病患者的腦中還有其他神經化學異常值得關注,如鐵、銅、鋅、硒等金屬元素的變化。
幾十年來,科學界對金屬與阿爾茨海默病的關係早有探究。研究發現,在阿爾茨海默病患者大腦的海馬和皮質區域,常有鐵的異常積聚,這種過量的鐵會促進氧化應激反應,加速Aβ沉積。銅的異常分佈也與阿爾茨海默病相關,它既可能促進Aβ聚集,也可能改變tau蛋白的結構。鋅則更為複雜,適量的鋅有助於神經遞質釋放,但在Aβ斑塊中,鋅濃度過高會穩定澱粉樣纖維結構,使其更難被清除。這些發現形成了一個清晰的背景——金屬穩態失衡能夠推動神經退行性病理的發展。
然而,在這一金屬名單中,鋰(Li)的研究相對較少。作為一種輕金屬元素,鋰在地殼和飲用水中普遍存在,它最為人熟知的作用是用於電子產品的電池。在臨牀上,鋰的用途是作為情緒穩定劑,用於治療雙相情感障礙的情緒穩定治療(1970年獲FDA批准)。
有臨牀觀察發現,接受鋰治療的雙相情感障礙患者中,阿爾茨海默病及其他痴呆症的發病率較低。另有丹麥的一項人羣研究發現,當地飲用水中的鋰水平與痴呆症發病率之間存在顯著的負相關。然而,並沒有明確證據顯示鋰的缺乏是否直接導致阿爾茨海默病的病理變化,鋰在正常人類大腦中的生理作用幾乎沒有被系統揭示。
那麼,鋰在健康大腦中的角色是什麼?它的缺乏會不會像鐵、銅失衡那樣,成為神經退行性疾病的隱秘推手?
2025年8月,哈佛醫學院的研究團隊在《自然》上發表了一項研究論文,首次在人體樣本、動物模型與分子機制實驗的多重證據中,證實了鋰在阿爾茨海默病中的重要性。
這項研究發現,在阿爾茨海默病患者的大腦中,鋰含量有所降低,鋰的缺乏可使GSK3β激酶異常激活,促使Aβ沉積與tau蛋白磷酸化加劇,導致認知障礙。當給出現阿爾茨海默病症的小鼠模型餵食鋰後,小鼠的記憶力得到恢復,提示補充鋰或能在阿爾茨海默病的早期防治中發揮作用。
該研究找到了一種潛在的干預方法,同時拓寬了人們對金屬在神經疾病中角色的理解。
鋰的水平在大腦病程早期就有下降
研究的第一步,是直接走進人類大腦。研究者收集了來自三類過世人羣的腦組織樣本和血清——沒有認知問題的對照樣本、處於阿爾茨海默病早期的輕度認知障礙患者樣本,以及確診的阿爾茨海默病患者樣本。
研究者同時檢測以上大腦樣本中的27種金屬的含量。結果很出乎意料:在所有金屬裏,只有鋰在輕度認知障礙和阿爾茨海默病患者的前額葉皮質中明顯下降。更有意思的是,小腦——一個在阿爾茨海默病早期相對“倖免”的區域——並沒有這種變化。這説明,鋰的變化並不是全腦普遍發生的,而是有特定的區域特徵。
接下來,研究團隊把大腦組織樣本切片做成“金屬地圖”,結果發現,鋰並不是均勻分佈的,而是“擠”在澱粉樣蛋白斑塊裏。這些斑塊是阿爾茨海默病的典型病理標誌,而斑塊周圍的健康區域反而缺乏鋰。進一步分析發現,非斑塊區域鋰越少,患者的記憶和認知表現就越差。這提示,斑塊可能像“海綿”一樣吸附了鋰,讓大腦失去了這種本來可能有保護作用的元素。
飲食鋰缺乏會讓病理加速
光有相關性還不夠,科學家需要證明鋰缺乏真的會推動病理發展。於是,他們建立了“低鋰飲食”小鼠模型,把飼料裏的鋰含量降低到正常的不到十分之一,持續餵養幾個月。這樣,實驗鼠的大腦皮質鋰水平下降了大約一半。
在兩種不同的阿爾茨海默病模型小鼠裏,研究者看到了同樣的結果:缺鋰會讓澱粉樣蛋白斑塊更多,tau蛋白磷酸化水平更高,還伴隨着突觸減少、髓鞘受損,以及小膠質細胞(大腦的免疫細胞)處於持續的促炎狀態。這些變化都和阿爾茨海默病患者的大腦病理高度相似。甚至在沒有疾病的老齡普通小鼠中,缺鋰也會引發輕微的澱粉樣蛋白積累和認知下降,説明鋰對健康衰老的大腦也很重要。
找到分子開關
接下來,研究者想知道鋰缺乏是通過什麼分子通路引發這些病理的。分析結果指向了GSK3β——一種在神經元內調控多種信號的激酶,早已被認為和阿爾茨海默病密切相關。
在缺鋰的小鼠中,GSK3β呈現出明顯的“活化”狀態。這種分子活化可以直接促進tau蛋白異常磷酸化和澱粉樣蛋白沉積,也會讓神經膠質細胞更容易進入促炎狀態。為了驗證因果關係,研究者給缺鋰小鼠使用了GSK3β抑制劑,觀察病理變化是否可逆轉,結果澱粉樣蛋白斑塊減少了,tau病理緩解了,突觸和髓鞘也有恢復。
這意味着,鋰缺乏引發的病理,很大程度上是通過GSK3β這個“開關”來實現的。缺鋰顯著增加激活態的GSK3β,降低抑制性GSK3β比例,推進了疾病進程。
尋找最佳鋰補充劑
既然鋰有保護作用,那是不是補鋰就能防病或治病?
在之前的一些小型臨牀試驗中,補充鋰並未改善認知功能。研究者認為,這些臨牀試驗的侷限之一是使用了與澱粉樣蛋白結合能力強的鋰鹽。普通鋰鹽(比如精神科常用的碳酸鋰)很容易被澱粉樣蛋白斑塊“抓住”,無法進入真正需要的腦區。
為此,研究團隊測試了16種不同的鋰化合物,比較它們的電導率(反映電離程度)及與Aβ纖維/寡聚物的結合親和力,尋找不易被斑塊吸附的化合物。最終,研究團隊挑選出一種叫乳清酸鋰(LiO)的形式。這種化合物的特點是離子釋放較慢,不容易和澱粉樣蛋白結合,從而能繞開斑塊的“陷阱”。
在阿爾茨海默病小鼠中,低劑量的乳清酸鋰就能明顯減少斑塊(降低約70%)和tau病理,突觸結構和髓鞘狀態也有改善,小鼠的記憶測試成績恢復到接近正常水平。更重要的是,在健康老齡鼠中,乳清酸鋰可延緩年齡相關認知衰退,且未檢測到傳統鋰鹽常見的腎臟或甲狀腺副作用。
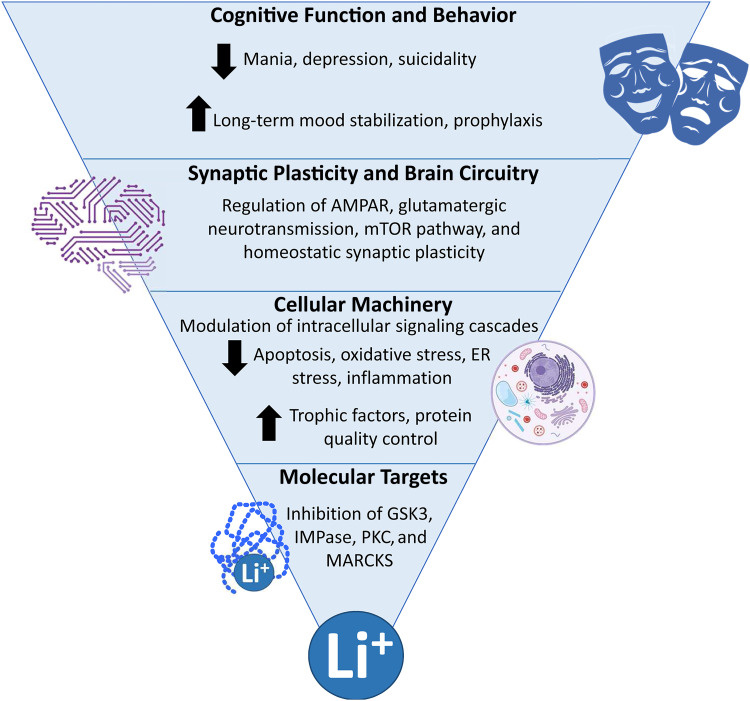 圖2. 鋰離子可調節大腦中多條與神經可塑性和神經保護相關的細胞通路,其中抑制糖原合酶激酶3(GSK3)顯然是其治療機制的核心。有研究揭示了鋰在神經營養反應、內質網應激(ER stress)、未摺疊蛋白反應(UPR)、自噬、氧化應激、炎症以及線粒體功能等方面的直接和間接作用,這些受鋰調控的機制有助於維持細胞存活。圖源:參考文獻[3]
圖2. 鋰離子可調節大腦中多條與神經可塑性和神經保護相關的細胞通路,其中抑制糖原合酶激酶3(GSK3)顯然是其治療機制的核心。有研究揭示了鋰在神經營養反應、內質網應激(ER stress)、未摺疊蛋白反應(UPR)、自噬、氧化應激、炎症以及線粒體功能等方面的直接和間接作用,這些受鋰調控的機制有助於維持細胞存活。圖源:參考文獻[3]
離人體應用尚遠,需更多研究
這項研究不僅明確了鋰對大腦健康的重要生理作用,系統揭示了內源性鋰缺乏可能是阿爾茨海默病早期的關鍵驅動因素,也為鋰在痴呆症的早期預防和治療領域打開了全新的窗口。
然而,研究者強調,低劑量乳清酸鋰是否可作為日常營養補充劑用於痴呆症預防或治療,仍需更多的人體臨牀試驗來探索,從而明確其效果和長期安全性。
對大多數人來説,鋰的主要來源是飲食。富含鋰的食物包括綠葉蔬菜、堅果、豆類以及一些香料,例如薑黃和孜然。一些礦泉水也是鋰的豐富來源。研究者認為,許多已被證明對健康有益並能降低患痴呆症風險的食物可能因為其含有鋰元素。
其他必需金屬
越來越多的研究表明,阿爾茨海默病與鐵、銅、鋅,以及與鐵代謝密切相關的硒有着密切關聯,這些金屬的分佈、濃度和化學狀態在疾病中發生了改變。
 圖3. 必需金屬對阿爾茨海默病的影響。左圖:健康大腦中,鐵、銅、鋅、錳等必需金屬維持穩態,通過複雜機制調控胞內/外濃度,其微量存在且受精細調控,對腦功能至關重要。右圖:AD腦內必需金屬穩態失衡與發病相關,胞外必需金屬穩態失衡誘導小膠質細胞和星形膠質細胞活化,導致IL-1β、TNF-α等促炎細胞因子過量產生。圖源:參考文獻[1]
圖3. 必需金屬對阿爾茨海默病的影響。左圖:健康大腦中,鐵、銅、鋅、錳等必需金屬維持穩態,通過複雜機制調控胞內/外濃度,其微量存在且受精細調控,對腦功能至關重要。右圖:AD腦內必需金屬穩態失衡與發病相關,胞外必需金屬穩態失衡誘導小膠質細胞和星形膠質細胞活化,導致IL-1β、TNF-α等促炎細胞因子過量產生。圖源:參考文獻[1]
鋅:在健康大腦中,鋅高度集中在突觸的小囊泡裏。每當神經元釋放信號時,囊泡會把鋅釋放到突觸間隙,參與調節神經信號的強弱和可塑性。然而,隨着年齡增長,突觸鋅的回收效率會下降,導致更多的遊離鋅停留在細胞外。
在阿爾茨海默病中,這些額外的鋅會與Aβ結合,形成鋅–Aβ複合物,促使Aβ迅速沉澱成斑塊。不同鋅濃度下,Aβ可能形成可逆的小寡聚體,也可能形成穩定的大團塊;兩種形態都可能對神經元有害。鋅還會通過影響多種激酶和磷酸酶的活性,促進tau蛋白的過度磷酸化,加速纏結形成。
動物實驗發現,減少突觸鋅儲存(如敲除ZnT3轉運蛋白)可以降低腦內的澱粉樣沉積。而使用“金屬離子載體”類藥物(例如PBT2)調整鋅和銅的分佈,可以在老年小鼠中快速改善學習和記憶。不過,人類臨牀試驗的結果並不一致,目前尚無充分證據表明補充鋅或限制鋅能直接改善阿爾茨海默病。
銅:銅是另一種必需的微量金屬,在神經元內參與能量代謝、神經遞質合成和抗氧化防禦。阿爾茨海默病患者的大腦整體銅含量常被報告為下降,但在Aβ斑塊及其周圍區域,銅卻顯著富集。這種“內部缺乏、外部堆積”的再分佈,可能導致細胞內銅依賴的關鍵反應受阻,同時讓細胞外銅參與不受控的化學反應。
銅能與Aβ結合形成可催化氧化反應的複合物,產生活性氧(ROS),引發膜損傷和炎症反應。在酸性或特定環境下,銅還會促進Aβ的氧化交聯,使其更難被降解清除。銅也能與tau結合,促進其聚集並引起氧化性損傷。
針對銅的研究提出了兩類策略:一種是使用去金屬化/螯合劑,試圖清除斑塊中過量的金屬,減少其促氧化作用;另一種是使用金屬離子載體(ionophore),將被Aβ困住的銅重新運回神經元內,以恢復銅依賴的生化反應。
在動物模型中,這兩種策略都改善了病理或認知,但在人類試驗中效果尚未被大規模驗證。單純補銅或單純螯合銅可能都有風險,因此未來更可能的發展方向是精確調節銅的空間分佈和化學形態。
鐵與硒:鐵是大腦中含量最多的過渡金屬,正常情況下參與氧運輸、能量生成和神經遞質合成。然而,阿爾茨海默病患者的海馬、額葉、顳葉等區域常檢測到鐵的異常積累。影像學(如MRI定量磁化率成像)和腦脊液鐵蛋白(ferritin)水平研究表明,鐵負荷越高,認知下降越快,而且這種趨勢在攜帶APOE-ε4基因型的人羣中更明顯。
鐵與阿爾茨海默病的病理蛋白也有直接聯繫:APP(澱粉樣前體蛋白)能調節神經元將鐵排出細胞的能力;tau蛋白的異常可能影響鐵在細胞內的分佈。突變或丟失這些蛋白功能時,神經元內鐵會滯留,增加細胞對鐵依賴性損傷的敏感性。
這裏的關鍵機制之一叫鐵死亡(ferroptosis)——一種由鐵驅動的脂質過氧化導致的細胞程序性死亡。正常情況下,硒依賴的酶GPx4會中和這種脂質過氧化反應,保護細胞。但在阿爾茨海默病大腦中,這一防禦系統可能失效,使神經元更容易在高鐵環境下受損。因此,補充硒、增強GPx4活性,或使用鐵螯合劑,都被認為是潛在的治療思路。
總之,鐵、銅、鋅、硒等在大腦中並非單純的“好”或“壞”金屬,它們的作用取決於位置、濃度和化學形態。在阿爾茨海默病中,這些金屬的分佈和代謝被重新塑造,既可能驅動病理過程,也可能是病理變化的副產物。理解並調節這種微妙的金屬平衡,或許能為預防和治療阿爾茨海默病開闢新的途徑。
參考文獻
[1] Huat TJ, Camats-Perna J, Newcombe EA, Valmas N, Kitazawa M, Medeiros R. Metal Toxicity Links to Alzheimer’s Disease and Neuroinflammation. J Mol Biol. 2019;431(9):1843-1868. doi:10.1016/j.jmb.2019.01.018
[2] Aron, L., Ngian, Z.K., Qiu, C. et al. Lithium deficiency and the onset of Alzheimer’s disease. Nature (2025). https://doi.org/10.1038/s41586-025-09335-x
[3] Lei P, Ayton S, Bush AI. The essential elements of Alzheimer’s disease. J Biol Chem. 2021;296:100105. doi:10.1074/jbc.REV120.008207
[4] Bortolozzi A, Fico G, Berk M, et al. New Advances in the Pharmacology and Toxicology of Lithium: A Neurobiologically Oriented Overview. Pharmacol Rev. 2024;76(3):323-357. Published 2024 May 2. doi:10.1124/pharmrev.120.000007
注:本文封面圖片來自版權圖庫,轉載使用可能引發版權糾紛。
 特 別 提 示
特 別 提 示
1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。