重新定義牛奶?這杯細菌產的牛奶,你會嘗試嗎?_風聞
返朴-返朴官方账号-科普中国子品牌,倡导“溯源守拙,问学求新”。09-04 10:54
 近日,幾位來自歐洲的科學家首次在大腸桿菌中成功合成了牛奶中重要的蛋白質成分——酪蛋白。並且,他們使用了兩種合成策略,這一成果為未來開發“無奶牛的牛奶”提供了重要技術基礎,給人類實現可持續乳製品的產業化打開了新的想象空間。
近日,幾位來自歐洲的科學家首次在大腸桿菌中成功合成了牛奶中重要的蛋白質成分——酪蛋白。並且,他們使用了兩種合成策略,這一成果為未來開發“無奶牛的牛奶”提供了重要技術基礎,給人類實現可持續乳製品的產業化打開了新的想象空間。
撰文 | MY
不知道大家是否像筆者一樣,每天早晨需要一杯醇香濃郁的拿鐵咖啡開啓高效的一天。拿鐵咖啡誘人的香氣,除了來自不同產地、不同烘焙方式的咖啡豆之外,牛奶的品質和配比也至關重要。牛奶是重要的營養來源,小時候的“每天一杯奶,強壯中國人”的廣告語至今還深深地印在筆者的腦海中。而奶製品,比如大家愛吃的芝士和酸奶等美食更是現代社會餐桌上的常客。這些美味背後,是全球奶業產量與人口和消費需求的同步增長。養殖奶牛需要大量的土地、水和飼料的同時,還會產生大量的甲烷進一步增加環境的壓力。
那麼,有沒有更環保、更可持續發展的,同時可以大量工業化生產的方式來生產我們所需的“牛奶”呢?首先我們需要明確,當我們想實現工業化“牛奶”生產的時候,我們到底要生產什麼?是成分色澤口感與牛奶一模一樣的“牛奶”嗎?還是生產牛奶中的某些關鍵營養物質?最重要的是,我們為什麼要工業化生產不需要奶牛的“牛奶”呢?
無奶牛的牛奶,我們要生產什麼?
牛奶主要是由蛋白質、脂肪、碳水化合物、礦物質和維生素構成的營養全面的乳製品。然而,牛奶中這些重要的成分,只有蛋白質不能通過現代工業快速大量生產。
牛奶中的蛋白質分為兩種:酪蛋白(casein),約佔總蛋白80%;剩下的20%則是乳清蛋白(whey protein)。本文主要介紹前者。
酪蛋白這個名字聽起來非常像一個無厘頭的蛋白棒品牌,但實際上它是營養的直接來源。在人體中酪蛋白會與鈣離子形成一個個微小的納米級蛋白質結構——酪蛋白膠束,它就像一輛“鈣離子運輸車”,將鈣送往全身各處。正因為酪蛋白膠束的存在,牛奶鈣的生物利用度相對較高(一般在 30–35% 左右,比許多植物來源更容易被吸收)。這也是為什麼牛奶被視為膳食鈣的優質來源。
從人體攝入營養的角度來説,直接喝牛奶並搭配其他飲食補充蛋白質就已足夠了,但對於許多特定功能的應用來説,需要巨量的牛奶來生產提純,酪蛋白的產量自然是越多越好。從食品工業角度來説,它具有乳化、增稠和保水,以及改善產品質地和口感等優良性質,是蛋白粉、能量棒、營養飲料、嬰兒配方奶粉等消費品的主要原料;被廣泛應用於酸奶、冰淇淋、奶酪製品、肉類製品和烘焙食品等。
酪蛋白的物理、化學特性對於化工、醫藥等領域也很有價值。酪蛋白是油漆的基料和高級紙張的塗層,可以提高紙張的光澤度、平滑度和印刷適應性;化妝品中粘合劑和保濕劑不乏它的身影。[插播一個彩蛋:在現代石油基塑料廣泛應用前,用酪蛋白製作的一種名為“加拉利斯”(Galalith)的塑料,因其光澤和堅硬度,被用於製作紐扣、鋼筆和首飾等。]
全球酪蛋白市場在2023年價值為27億美元,預計到2033年將以6.3%的複合年增長率增長到49億美元,這進一步凸顯了對可持續生產方式的需求 [1]。
因此,我們想要無奶牛的牛奶,本質上是需要酪蛋白。
為什麼酪蛋白難以化學合成?
雖然酪蛋白具有重要的產業意義,但很遺憾的是,目前除了對牛奶分離純化外,還無法通過純粹的化學方法實現酪蛋白的大規模生產。
 圖1 Alphafold解析出的酪蛋白結構。
圖1 Alphafold解析出的酪蛋白結構。
原因主要有兩點:1) 酪蛋白不是一個單一的蛋白質,而是一組複雜的蛋白質家族,包括αs1-酪蛋白(酪蛋白家族最主要的成分)、αs2-酪蛋白、β-酪蛋白和κ-酪蛋。每一種酪蛋白都由數百個氨基酸以特定的序列組成。純化學合成如此長且複雜的蛋白質鏈,成本極高且效率極低,目前根本無法應用於工業生產。
2)即使化學合成出這樣複雜的蛋白質鏈,也很難實現酪蛋白輸送營養的功能。酪蛋白分子上佈滿了大量的磷酸基團,這些磷酸基團必須在特定的氨基酸位點上精確地連接,即磷酸激酶將一個磷酸基團(負電荷)從ATP轉移到目標蛋白質內氨基酸殘基上。這正是形成酪蛋白膠束的關鍵,這些帶負電的磷酸基團就彷彿一個個小的“鈎子”,將帶正電的鈣離子牢牢地抓住,從而將鈣運送至全身各處。鈎子的數量和位置,決定了它的運輸鈣離子的能力和結構。而這種複雜的、位點特異性的修飾是由細胞內的生物酶完成的,用化學方法很難精確複製;其形成的膠束結構是生物體內的自組裝完成,目前也無法化學方法合成。
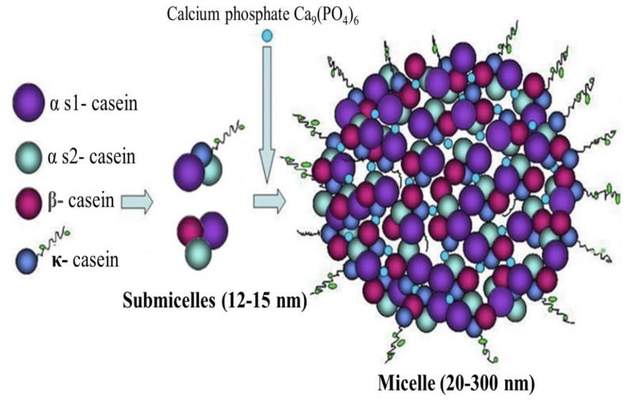

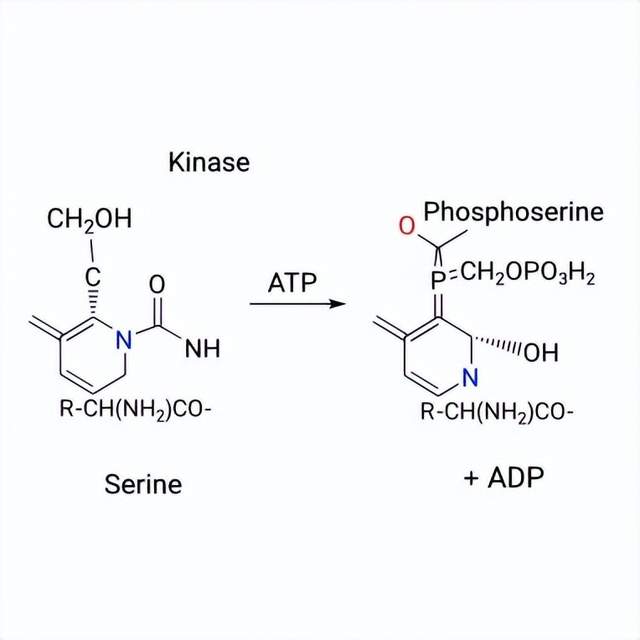 圖3 酪蛋白中的絲氨酸被磷酸化(加鈎子)的結構變化。
圖3 酪蛋白中的絲氨酸被磷酸化(加鈎子)的結構變化。
兩種合成策略
多個研究團隊都曾嘗試用合成生物學的方法,通過畢赤酵母(Pichia pastoris)或者釀酒酵母(Saccharomyces cerevisiae)來進行酪蛋白生產[3,4],然而卻因各種原因無法走到工業化的最後一步。但科學家們並沒有止步於此,仍在進行各種不同的嘗試。
近期,一個歐洲的科學家團隊,成功通過生物工程的方式,在實驗室水平用大腸桿菌“繞過”奶牛,實現αs1-酪蛋白的精準生產[5]。
食品工業中,大腸桿菌長期以來作為“生物工廠”用於工業酶、生物分子以及營養補劑的生產。大腸桿菌非常適合生產蛋白質,但是它們天生缺乏磷酸化,即沒有加鈎子的能力,因此也無法天然合成具有鈣運輸能力的酪蛋白。為此,研究人員主要採取了“激酶共表達”和“磷酸化模擬”兩種策略,實現了重組酪蛋白的磷酸化。
 圖4 在大腸桿菌中產生具有活性的重組酪蛋白的兩種策略[5]。
圖4 在大腸桿菌中產生具有活性的重組酪蛋白的兩種策略[5]。
“激酶共表達”,如字面意思所示,在用大腸桿菌表達酪蛋白的同時,還讓其同時表達磷酸激酶。這些外來的磷酸激酶可以精準地對酪蛋白磷酸化,從而使最終生產的酪蛋白是具有鈣離子結合活性的天然酪蛋白。
研究人員首先從一系列的激酶中選取了人類和牛的 Fam20C 激酶(一種在細胞外蛋白質磷酸化起關鍵作用的激酶),驗證這兩種激酶是否可以磷酸化牛的 αs1-酪蛋白。然而實驗發現,大腸桿菌並不能合成來自哺乳動物的複雜的Fam20C 激酶蛋白。因此他們轉向使用枯草芽孢桿菌的兩種Hanks型激酶——PrkD和YabT;這兩種激酶已經充分表徵(characterization),且在大腸桿菌中成功表達,因此有望對酪蛋白磷酸化。
事實上,上述這兩種激酶均可使蛋白質中的絲氨酸(Ser)或蘇氨酸(Thr)殘基發生磷酸化。研究人員將αs1-酪蛋白基因和“加鈎子”的工具激酶基因(PrkD 或 YabT)同時放在工具箱(pET15b 質粒)中,進而將pET15b 質粒送入大腸桿菌中表達。除此之外,研究人員還在其中加入了伴侶蛋白 GroES/EL 以保證αs1-酪蛋白可以正確摺疊和溶解。
在αs1-酪蛋白成功表達之後,研究人員接下來便來探究這些大腸桿菌表達的酪蛋白是否帶
 被這兩種激酶磷酸化了。為了進一步確定磷酸化發生的具體位點,他們通過液相色譜-質譜聯用(LC-MS)的方法發現PrkD 激酶磷酸化了酪蛋白中所有的9個天然位點,而 YabT 磷酸化了其中的8個。這表明兩種激酶PrkD 和YabT具有生物活性的同時,還能夠高度精確地複製天然酪蛋白的磷酸化模式。研究人員還通過二維凝膠電泳(2DE)的方法將磷酸化的αs1-酪蛋白進行染色,清晰地看到PrkD 或 YabT 共表達的αs1-酪蛋白產生了強烈的磷酸化信號,並且磷酸化水平與商業化的天然αs1-酪蛋白相當。最後,研究人員又通過鈣結合分析和熒光光譜等方法,評估了大腸桿菌生產的磷酸化酪蛋白的功能和結構特性,發現其與牛酪蛋白具有可比性。
被這兩種激酶磷酸化了。為了進一步確定磷酸化發生的具體位點,他們通過液相色譜-質譜聯用(LC-MS)的方法發現PrkD 激酶磷酸化了酪蛋白中所有的9個天然位點,而 YabT 磷酸化了其中的8個。這表明兩種激酶PrkD 和YabT具有生物活性的同時,還能夠高度精確地複製天然酪蛋白的磷酸化模式。研究人員還通過二維凝膠電泳(2DE)的方法將磷酸化的αs1-酪蛋白進行染色,清晰地看到PrkD 或 YabT 共表達的αs1-酪蛋白產生了強烈的磷酸化信號,並且磷酸化水平與商業化的天然αs1-酪蛋白相當。最後,研究人員又通過鈣結合分析和熒光光譜等方法,評估了大腸桿菌生產的磷酸化酪蛋白的功能和結構特性,發現其與牛酪蛋白具有可比性。
儘管大腸桿菌能夠同時表達這三個蛋白(激酶蛋白、酪蛋白、伴侶蛋白),但這種多蛋白共表達系統會對大腸桿菌菌株造成顯著的代謝負擔。這種負擔可能導致大腸桿菌無法處於其最佳生長狀態,進而影響蛋白質的表達產量和生產效率。因此接下來研究人員提出了一種曲線救國的方法——“磷酸化模擬修飾”來生產磷酸化的αs1-酪蛋白。
前文提到過,酪蛋白之所以可以和鈣離子結合,是因為帶負電的磷酸基團和帶正電的鈣離子之間的相互吸引作用。由於某些氨基酸本身就帶有負電荷,那麼是否可以用帶負電的氨基酸替換掉酪蛋白中原來的絲氨酸磷酸化位點,進而模擬磷酸基團抓鈣離子的功能呢?
於是,研究團隊選擇了帶負電荷的天冬氨酸,用它替代了酪蛋白中8個潛在的絲氨酸磷酸化位點,即用“假鈎子”替換“真鈎子”。這種基因層面上的方法,無需添加激酶,省去了複雜的“加鈎子”步驟,能在蛋白質翻譯後直接獲得“磷酸化”的效果,從生產角度來説更簡單高效。
研究人員將天冬氨基酸替換的Rαs1-PM酪蛋白的基因序列在大腸桿菌中表達之後,發現Rαs1-PM酪蛋白突變體增強了和鈣離子間的靜電相互作用。在使用熒光光譜分析時,磷酸化模擬酪蛋白的熒光發射波長髮生了“藍移” ,這意味着蛋白質的構象或寡聚化狀態發生了改變。也就是説,磷酸化模擬酪蛋白與天然酪蛋白有結構差異,而這種差異使其表現出更強的鈣結合能力。此外,動態光散射(DLS)測量顯示,Rαs1-PM酪蛋白突變體的流體動力學直徑比未磷酸化的酪蛋白更大,這進一步證明了其寡聚化狀態發生了變化。這些結構變化是使Rαs1-PM酪蛋白具有更強鈣離子結合能力的重要原因。
與第一種方法相比,這種磷酸模擬化策略使生產過程變得更為簡單的同時,還會得到具有更強鈣離子結合能力的“酪蛋白”。這種強結合能力的“酪蛋白”與普通的酪蛋白相比,可能具有更高的營養性價比。
從0到1的進步
綜上所述,這項研究的成功之處在於解決了利用微生物生產具有生物活性酪蛋白的長期難題——在天然位點實現磷酸化。研究人員提出的兩種可行性生產方案為未來的工業化生產提供了兩種不同路徑。當然,這只是最開始的第一步,這其中還有許多懸而未解決的問題需要進一步的探究。論文作者只合成出αs1-酪蛋白,文中的兩種策略是否可以應用到其他類型的酪蛋白(如 β-酪蛋白和 κ-酪蛋白)?更重要的是,該研究並未得到膠束結構,只實現了基本的“鈎子”能力。文中也明確指出,重組酪蛋白是否能形成與天然酪蛋白一致的膠束結構是未解決的關鍵問題。細菌激酶磷酸化的重組酪蛋白是否能像天然酪蛋白一樣形成穩定的磷酸鈣納米膠束?磷酸化模擬修飾能在多大程度上覆制磷酸基團的膠束穩定化和其擁有的生物物理功能?而更遙遠的未來,若能夠實現量產,在提高蛋白產率的同時,能否在成本上與普通動物性酪蛋白生產持平或更具優勢?
不過,對於生物工程來講,從0到1往往很難。現在已經有了酪蛋白的1,接下來通過研究人員對實驗過程、蛋白質結構、生產過程的優化,實現重組酪蛋白的規模化和可持續化生產,值得期待。
參考文獻
[1] Future Market InsightsCasein Market - Increasing Adoption of Dairy Proteins in Emerging Economies Is Shaping Casein Market. 2023-2033
[2]Petrova, S. Y., et al. “Structure and biological functions of milk caseins.” Russian Open Medical Journal, vol. 11, 2022, p. e0209, www.romj.org/2022-0209.
[3] Choi, B. K., & Jiménez-Flores, R. (2001). Expression and purification of glycosylated bovine β-casein (L70S/P71S) in Pichia pastoris. Journal of Agricultural and Food Chemistry, 49(4), 1761–1766 。
[4] Hettinga, K., & Bijl, E. (2022). Can recombinant milk proteins replace those produced by animals? Current Opinion in Biotechnology, 75, 102690.
[5]Suvasini Balasubramanian et al, Production of phosphorylated and functional αs1-casein in Escherichia coli, Trends in Biotechnology (2025). DOI: 10.1016/j.tibtech.2025.05.015

1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。