線粒體靶向療法首次獲FDA批准!處方級“線粒體修復”上岸,抗衰走通臨牀閉環_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯15小时前

讀者玩家請注意,以下是一場“狼人殺”遊戲,也是一場關於線粒體靶向療法首次獲得FDA批准用於治療罕見遺傳病——巴氏綜合徵的真實故事[1]。
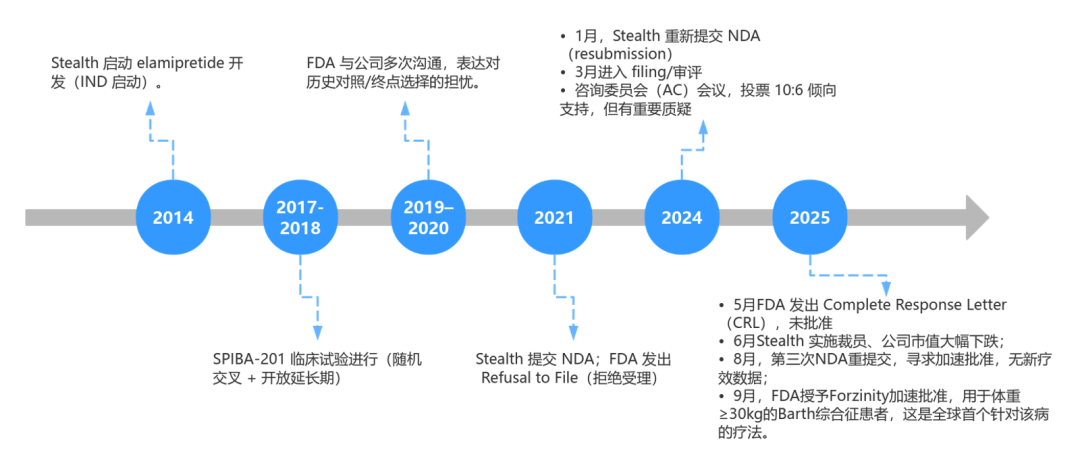
圖注:完整故事線
在進入遊戲前,我們必須先回答一個問題:一個罕見病,和我們普通人的衰老有什麼具體關係?

答案是:病因同源,只是進程快慢之別。
如果説我們體內的“能量引擎”線粒體是一台會自然損耗的機器,對我們大多數人而言,這台機器會用七八十年緩慢老化;而巴氏綜合徵患者短短十幾年內引擎就會徹底崩潰。
而這款獲得FDA批准的線粒體靶向療法首次在最嚴格的監管層面證實:直接修復線粒體的底層損耗,是一條可行的、能被最終認可的藥物開發路徑。這為其他靶向衰老核心機制的療法鋪平了道路。

遊戲任務
在一個名為“巴氏綜合徵”的村莊裏,村民們(患者)正因體內最核心的“能量引擎”線粒體的衰竭而接連倒下。這是一種罕見遺傳病,主要影響兒童和成年男性的心臟、骨骼肌和免疫系統。
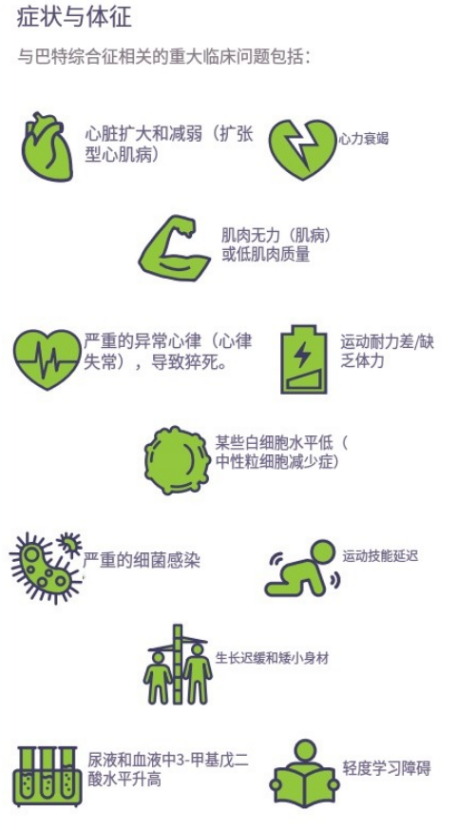
圖注:巴氏綜合徵症狀與體徵
好人陣營的任務是:讓村民成功使用解藥。
本局玩家
女巫:臨牀階段的生物技術公司Stealth BioTherapeutics,手握唯一的“解藥”——Forzinity,其核心成分Elamipretide,能可逆性結合並穩定心磷脂、改善線粒體膜與嵴結構。心磷脂的損傷,往往在多種年齡相關的病理過程中發揮重要作用[2]。
圖注:Stealth BioTherapeutics公司官網
狼人:監管壁壘。隱藏在規則中的兩頭惡狼——“僵化的審批標準”與“統計學的質疑”。它們用拒絕信和無盡的拖延來“刀”掉希望。
法官:FDA審評委員會,唯一的決策者,他將聽取所有人的發言,並最終宣判Stealth的Forzinity藥物是否“合規”。
現在,局面岌岌可危。村民急需解救,女巫手持解藥,卻被法官以“證據不完美”為由再三阻攔。而潛伏的狼人,正利用規則,試圖將女巫和所有村民一起拖入深淵。
背景交代完畢。那麼,遊戲開始。
天黑請閉眼!


第一輪發言:新手女巫,慘遭
“規則之狼”一刀斃命
天亮了,女巫Stealth開始發言。
Stealth舉起了她的解藥。這瓶藥,她從2014年就開始煉製;到2018年,她終於完成了一場歷時多年的II期臨牀實驗——SPIBA-201[3],並於2021 年向FDA提交了新藥上市申請(NDA)。
由於巴氏綜合徵極為罕見,進行傳統的、大規模的安慰劑對照試驗既不人道也幾乎不可能。因此,在這場試驗裏,Stealth選擇了一個在當時看來最務實的方案:將12位用藥患者的數據與過去幾年自然惡化的歷史病人數據進行了比較。
報告顯示,試驗達到了其主要目標:改善患者的“6分鐘步行距離”(6MWT),這是一種衡量心肺功能和運動耐力的常用指標[4]。
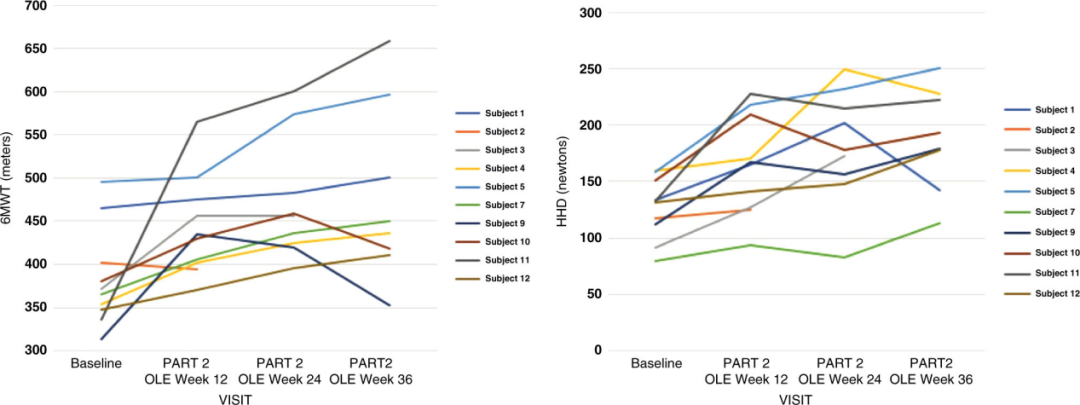
圖注:左圖每條線代表一名受試者在 6 分鐘步行測試中的變化,橫座標為時間,縱座標為步行距離。大多數患者的步行距離隨治療時間延長而增加。右圖每條線代表一名受試者在手持測力測試中的變化,橫座標為時間,縱座標為肌力值。整體趨勢顯示肌力持續提升。
這一試驗對照方式立刻引來了第一頭狼人(僵化的審批標準)的無情攻擊。它的發言直指要害:這種非同期的、沒有隨機化的對比,充滿了不可控的偏見,是典型的“不合規”操作,完全無法替代一場設計嚴謹的對照試驗。
【法官的裁決筆記】
核心問題:缺乏充分且控制良好的試驗設計。回顧性數據對比存在不可控的偏見,無法作為有效性的主要證據。
指令:申請人需重新進行一場設有安慰劑對照的、設計嚴謹的臨牀試驗。
這句指令,對Stealth來説是打擊性的。對於一個全美只有150名患者的罕見病,重開一局臨牀試驗意味着數年的時間和數千萬美元的投入,而患者根本等不起。
本輪結果
法官於2021年10月發出“拒絕受理”(Refuse to File)信函。申請因試驗設計存在根本性缺陷,甚至沒有資格進入審評環節[5]。
本輪覆盤
Stealth的第一次嘗試,栽在了臨牀試驗設計上。這和許多抗衰老研究的困境類似:當無法進行完美的、大規模的人體試驗時,我們手頭的“次優證據”是否應該被接受?
在第一輪,法官的答案是:絕不。

第二輪發言:
捲土重來,再遇“完整回應”
在經歷了第一次的失敗後,Stealth進行了大量的數據重分析和論點重構,並進行了更嚴格的III期安慰劑對照試驗(TAZPOWER),於2024年捲土重來,第二次提交了NDA[6]。
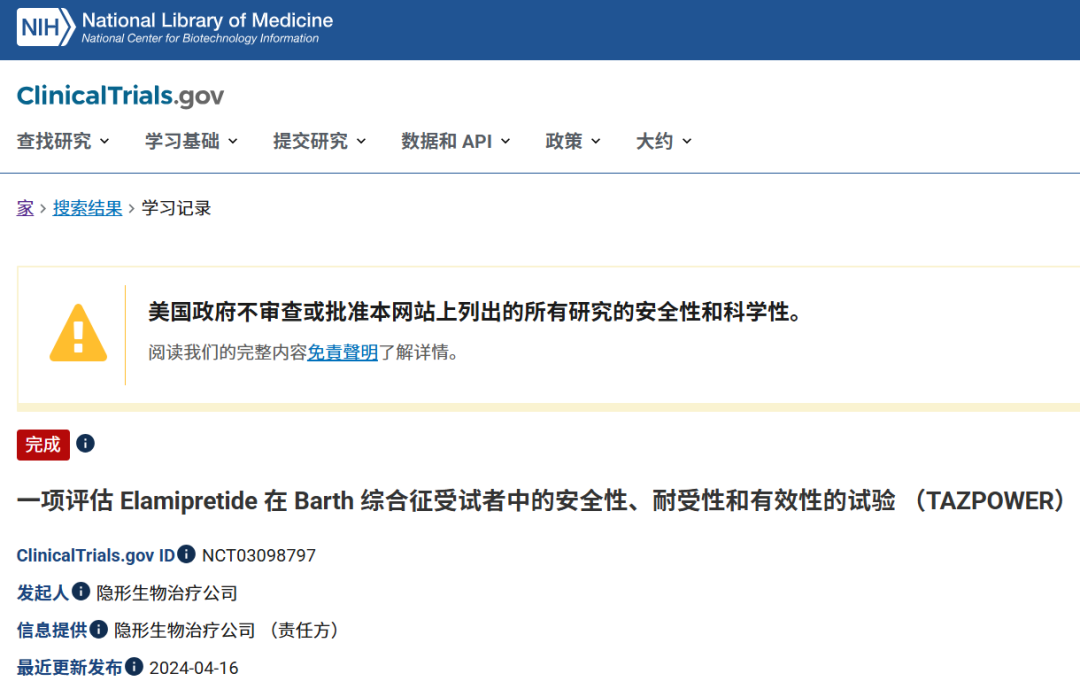
圖注:TAZPOWER試驗
這一次,法官決定受理申請,以便進行更詳細的審查。然而這次的問題是:在這場FDA視為金標準的試驗中,Stealth預設的主要療效指標——“6分鐘步行距離(6MWT)”,在與安慰劑組的數據對比中,並未達到統計學上的顯著性。
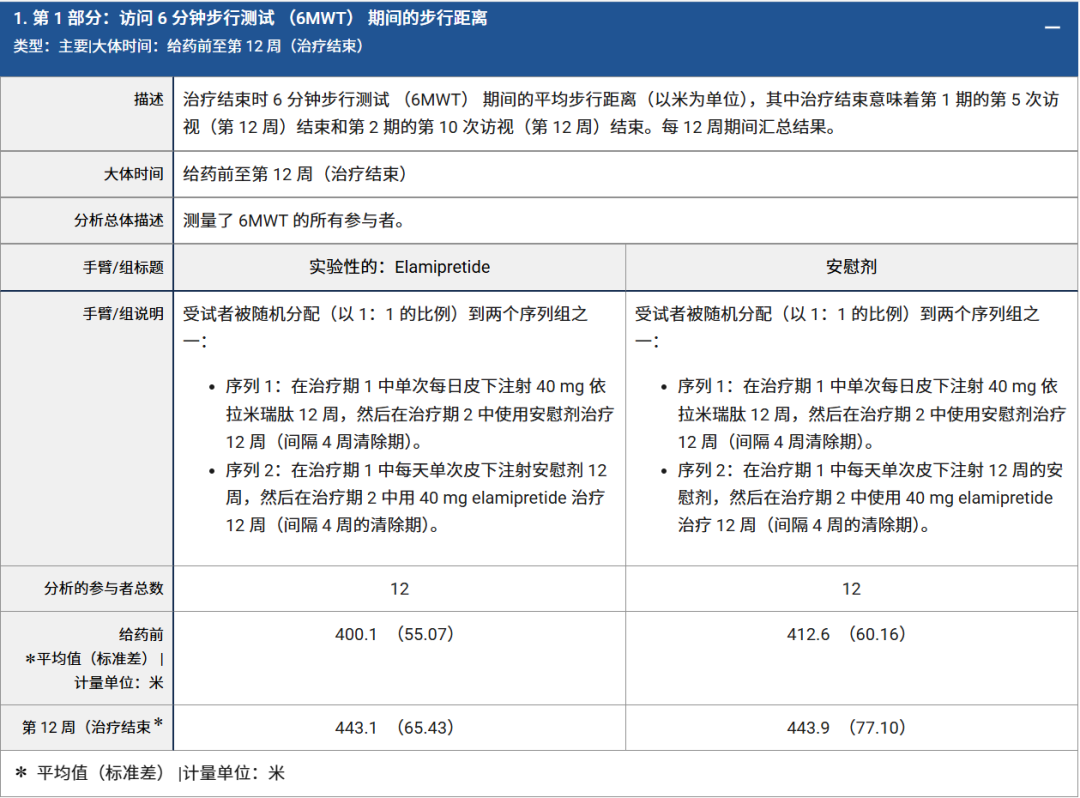
圖注:6分鐘步行距離(6MWT)對照試驗
面對主要目標被質疑的窘境,Stealth被迫改變戰術,將所有希望寄託在了説服法官能夠“基於證據的總體性”進行靈活審評。她強調那些雖然未達統計學顯着性、但顯示出積極趨勢的數據,尤其是“手持式測力(HHD)”用它來證明藥物確實讓患者的肌肉力量獲得了實質性改善[3]。
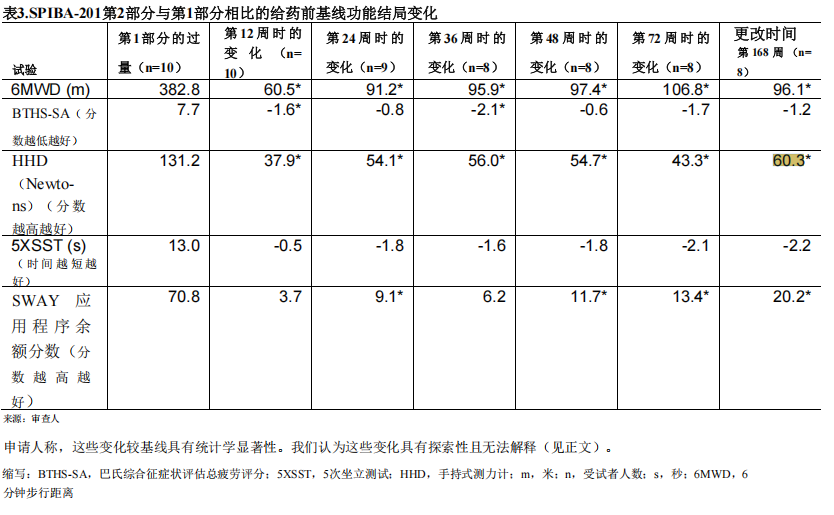
圖注:所有患者在 HHD 的平均肌肉力量測量中觀察到基線的顯着改善 (P < .05),改善範圍為 37.9 至 60.3 牛頓
在2024年10月10日的關鍵諮詢委員會會議上,這一策略似乎部分奏效,以10:6的票數驚險地贏得了“民心”[7]。

但狼人(統計學的質疑),早已準備好了更深入的拷問。它指出,這種在主要目標失敗後,轉而強調次要指標的行為,是典型的“移花接木”。這種事後從一大堆數據裏挑出一個好看的結果來當主要證據的行為,是科學研究的大忌,因為這極有可能是“數據挖掘”,即在眾多不顯著的結果中,偶然發現了一個顯著的,然後就宣稱勝利,這嚴重破壞了預設方案的科學性。
狼人的攻擊,又一次精準地擊中了Stealth的要害。
也讓法官陷入了無法辯駁的困境。如果FDA在“數據操縱”嫌疑的情況下依然批准藥物,就等於背叛了自己作為科學守門人的核心職責。它將無法向公眾和科學界交代,為何會放行一款有效性存疑、嚴謹性受損的新藥。
【法官的裁決筆記】
核心問題:主要療效指標未達統計學顯著性。
疑問:申請人提出的替代終點(肌肉力量)其臨牀意義尚不明確,且非預先設定的主要終點。
因此,在原定2025年1月29日的審批日期被兩次延期,讓整個村莊在長達16.5個月的煎熬中等待後,最終的判決書還是來了。
本輪結果
法官於2025年5月發出“完整回應函”。申請被再次拒絕。
這一刀的後果立竿見影。在現實世界中,Stealth公司為了活下去,在2025年6月宣佈裁員30%,以節約現金流[8]。女巫的解藥瓶幾乎見底,她已處於被淘汰的邊緣。
本輪覆盤
這次失敗的核心在於臨牀終點的選擇與統計學意義。這是所有創新療法都會遇到的“阿喀琉斯之踵”。選擇的衡量指標,是否真的能代表患者獲益?數據優勢,究竟是真實的療效,還是僅僅是統計學上的偶然?當“金標準”數據失敗時,用“銀標準”(替代終點)來補救,FDA會認嗎?
在第二輪,法官的答案是:依然不認。
(另外還有一家長壽生物科技公司Mitrix Bio此前已經開始給90歲物理學家進行線粒體移植來逆轉衰老,點擊下方卡片,關注時光派並後台回覆 線粒體移植 獲取原文查看)

第三輪發言:絕地反擊,女巫找到了最適合自己的取勝路徑
村莊陷入了絕望。所有人都以為,故事將以悲劇告終。
但就在那封冰冷的拒絕信裏,Stealth發現了一行至關重要的文字。法官在關上大門時,為她指明瞭一條早已存在、但此前無法進入的秘密通道:“……我們建議,可以考慮通過加速批准通道,基於替代終點重新申請……”
“加速批准”是FDA為應對嚴重疾病而設的特殊條款,它允許藥物基於一個“很可能預測臨牀獲益”的替代終點先行上市。Stealth抓住了這最後的機會。
天亮了,最後一輪發言開始。
在經歷了裁員30%以節約現金流的巨大痛苦後,Stealth爭分奪秒,於2025年8月15日,第三次提交了申請。
這一次,整個申請的策略發生了根本性轉變。Stealth將全部論證焦點集中在了“手持式測力(HHD)”這一替代終點上。其核心論點是:對於巴氏綜合徵患者,肌肉力量的恢復,是改善其整體身體功能的直接生物學基礎。因此,這一指標完全符合“加速批准”通道所要求的原則。
系統提示:玩家已選擇“加速批准”路徑。最終審判即將開始!
這一次,統計學的狼人無法再用“主要終點失敗”來攻擊,因為女巫已經切換到了一個全新的、規則允許的戰場。
本輪結果
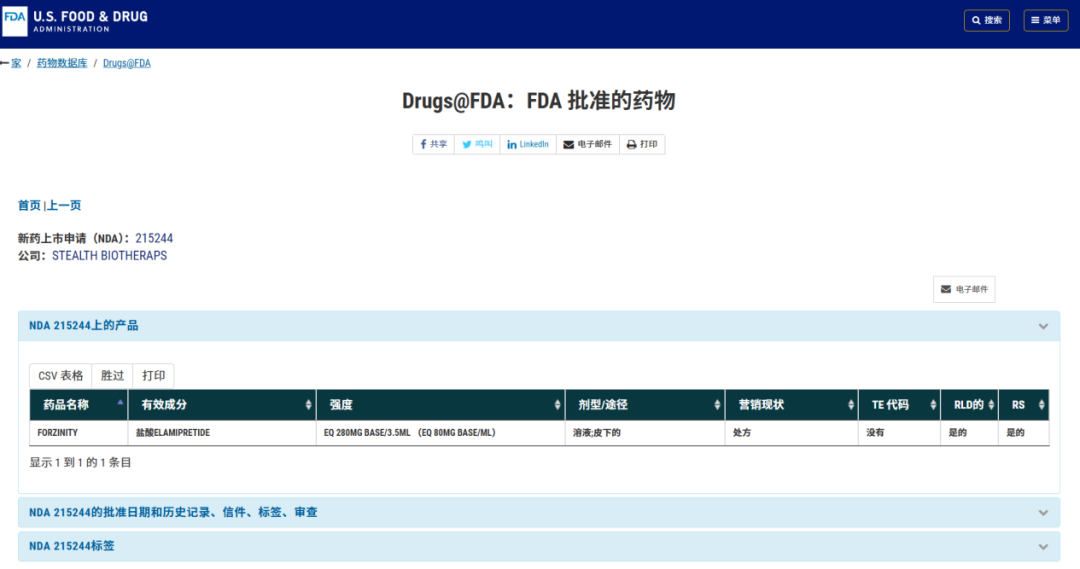
2025年9月19日,法官的最終判決終於到來:Stealth的請求獲得“加速批准”!解藥Forzinity獲准使用!這是歷史上首款獲批的線粒體靶向療法[12],也是巴氏綜合徵患者等來的第一縷曙光。當然,批准附帶條件:遊戲結束後,女巫需進行一項上市後驗證性試驗,以最終證明力量改善能轉化為臨牀獲益[9]。
遊戲覆盤
女巫最終的勝利,並非靠推翻規則,而是靠理解和利用規則。她接觸到了臨牀轉化問題的真正核心——收益&風險比。當面對一種無藥可醫的致命疾病時,一個“很可能有效”的希望,其收益遠大於證據鏈不完美的風險。
這場勝利,為整個抗衰老領域帶來了深遠的啓示。FDA首次為一款“線粒體靶向療法”宣告:直擊衰老的細胞底層機制,是一條可以走通的路。
小結:遊戲結束,贏家發表獲獎感言
天亮了,巴氏綜合徵這個村莊迎來了久違的陽光。這場艱苦的狼人殺對局,似乎終於畫上了句號。
但,真的結束了嗎?
對於Stealth而言,巴氏綜合徵從來不是全部,它只是最關鍵的灘頭陣地。攻下它,是為了驗證其修復線粒體靶向療法是有效的。
FDA的這次點頭,不僅給巴氏綜合徵患者帶來了希望,更重要的是,他為所有瞄準“線粒體健康”的療法,勘定了一條可以通行的航道。
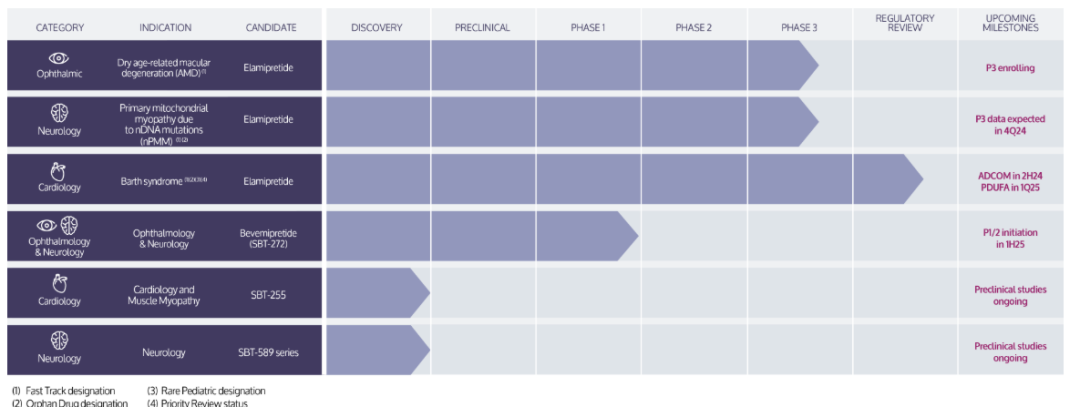
現在,Stealth可以帶着這枚經過驗證的“銀色子彈”,去挑戰森林更深處、那些盤踞在更廣闊領地上的“狼羣”——那些同樣由線粒體功能障礙驅動的、影響數億人的衰老相關疾病。
在Stealth公司的管線中,我們看到了她的真正野心:用於治療老年性黃斑變性(Dry AMD)的SBT-272,以及瞄準更廣泛心血管疾病的療法等[10]。
下一局遊戲,即將開始。而這一次,玩家又會是誰呢?
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Longevity.Technology. (n.d.). Is this mitochondria’s big moment?Retrieved October 21, 2025, fromhttps://longevity.technology/news/is-this-mitochondrias-big-moment/
[2]Stealth BioTherapeutics. (n.d.).Programs & Pipeline. Retrieved October 21, 2025, fromhttps://stealthbt.com/programs-pipeline/#resources
*[3]**U.S. Food and Drug Administration. (2024, October 10).FDA Briefing Document NDA 215244 Drug name: Elamipretide hydrochloride injection Applicant: Stealth Biotherapeutics Inc. Cardiovascular and Renal Drugs Advisory Committee Meeting.*https://www.fda.gov/media/182553/download
*[4]**Thompson, W. R., et al. (2021). A phase 2/3 randomized clinical trial followed by an open-label extension to evaluate the effectiveness of elamipretide in Barth syndrome, a genetic disorder of mitochondrial cardiolipin metabolism.Genetics in Medicine,23(3), 471-478.*https://doi.org/10.1038/s41436-020-01006-8
[5]BioPharma Dive. (2025, September 19).FDA clears first Barth syndrome drug amid scrutiny of rare disease stance. Retrieved October 21, 2025, fromhttps://www.biopharmadive.com/news/fda-approve-barth-syndrome-forzinity-stealth-biotherapeutics-rare-diseases/760710/
[6]ClinicalTrials.gov. (n.d.).A Trial to Evaluate Safety, Tolerability and Efficacy of Elamipretide in Subjects With Barth Syndrome (TAZPOWER). Identifier NCT03098797. Retrieved October 21, 2025, fromhttps://www.clinicaltrials.gov/study/NCT03098797?tab=results
[7]Stealth BioTherapeutics. (2024, October 11).Stealth BioTherapeutics Announces Positive Vote from FDA Advisory Committee Meeting Supporting Potential Approval of Elamipretide for the Treatment of Barth Syndrome. Retrieved October 21, 2025, fromhttps://stealthbt.com/stealth-biotherapeutics-announces-positive-vote-from-fda-advisory-committee-meeting-supporting-potential-approval-of-elamipretide-for-the-treatment-of-barth-syndrome/?utm_source=chatgpt.com
[8]Fierce Biotech. (n.d.).Fierce Biotech Layoff Tracker 2025: Kezar plots cuts; Ascidian Tx trims team*. Retrieved October 21, 2025, from**https://www.fiercebiotech.com/biotech/fierce-biotech-layoff-tracker-2025*
[9]U.S. Food and Drug Administration. (n.d.).Drugs@FDA: FDA-Approved Drugs. Retrieved October 21, 2025, fromhttps://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process
[10]Stealth BioTherapeutics. (n.d.).Programs & Pipeline. Retrieved October 21, 2025, fromhttps://stealthbt.com/programs-pipeline/