5種“續命藥”離人類更近?我們都曾返老還童?_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯2小时前

作為忠實的抗衰分子,吾日三問吾身:
在冰冷的北極海域,弓頭鯨正以200歲高齡挑戰哺乳動物的壽命極限。人,能從長壽物種身上找到長壽秘訣嗎?
推薦閲讀:200歲鯨魚抗癌秘密首發!Vera Gorbunova教授:基因組“寄生蟲”也促衰,海帶延壽13%丨第六屆衰老幹預論壇嘉賓回顧
衰老時鐘頻頻更新,目前科研團隊在研究衰老變化和測量衰老上還有啥新發現?
想變年輕,除了細胞重編程,最近科學界都在往哪些領域在發力呢?
在不久前的時光派第六屆衰老幹預論壇上,美國國家科學院院士、哈佛醫學院教授Vadim N. Gladyshev教授恰好圍繞以上問題——**“長壽特徵、量化衰老、干預衰老”**發表了精彩演講。

現場可謂座無虛席,不少觀眾坦言:照這個邏輯線,看懂目前的衰老研究在幹什麼,好像一下子就豁然開朗了!接下來,我們來解讀Gladyshev教授的演講——量化衰老、長壽與再生,保證乾貨滿滿,讀完不虧!

向長壽生命“取經”:讓抗衰策略人也能用
長久以來,科學界在做的一件大事就是研究長壽的特徵。簡單來説,我們想活得久,得知道到底是哪些特別的分子、機制賦予了個別生物體長壽的資格。比如最近發現,弓頭鯨能活200歲不容易得癌症的秘密,可能就在一種叫CIRBP的蛋白裏[1]。

目前發現,不同動物、不一樣的器官在決定壽命的基因上其實有不少相似點。而無論是基因改造、少吃點,還是吃藥來延長壽命,這些辦法在機體內也都能引發類似的分子變化,就好像它們在激活同一種“長壽程序”[2]。
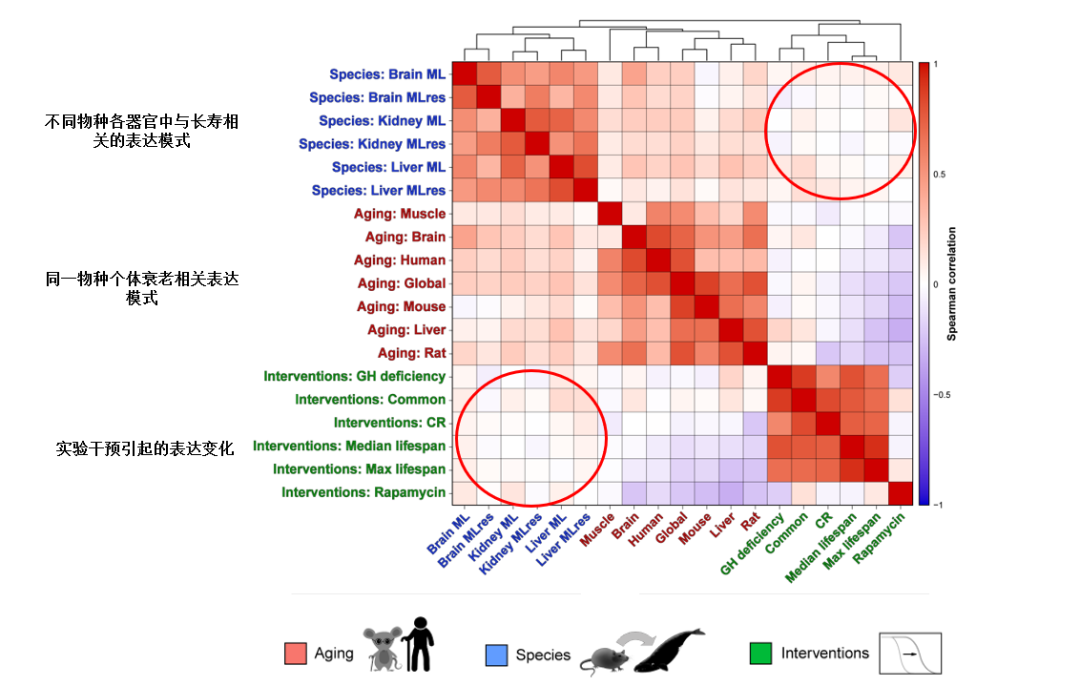
圖注:自然長壽的表達方式與長壽干預引起表達方式缺乏關聯(紅圈部分)
有意思的是,海龜、弓頭鯨這些動物能活上百年,可如果把它們與我們在實驗室裏通過基因改造、節食這些創造的“長壽鼠”拿來對比後會發現:自然界與實驗室長壽的方式之間還真有着很大的差別。
顯然,在實驗室“小作坊”裏搞長壽研究不是我們的最終目的。於是,聰明的科學家想到了去尋找那些不僅在實驗室裏表現出色,還能契合自然界不同哺乳動物長壽特徵的關鍵分子或基因。
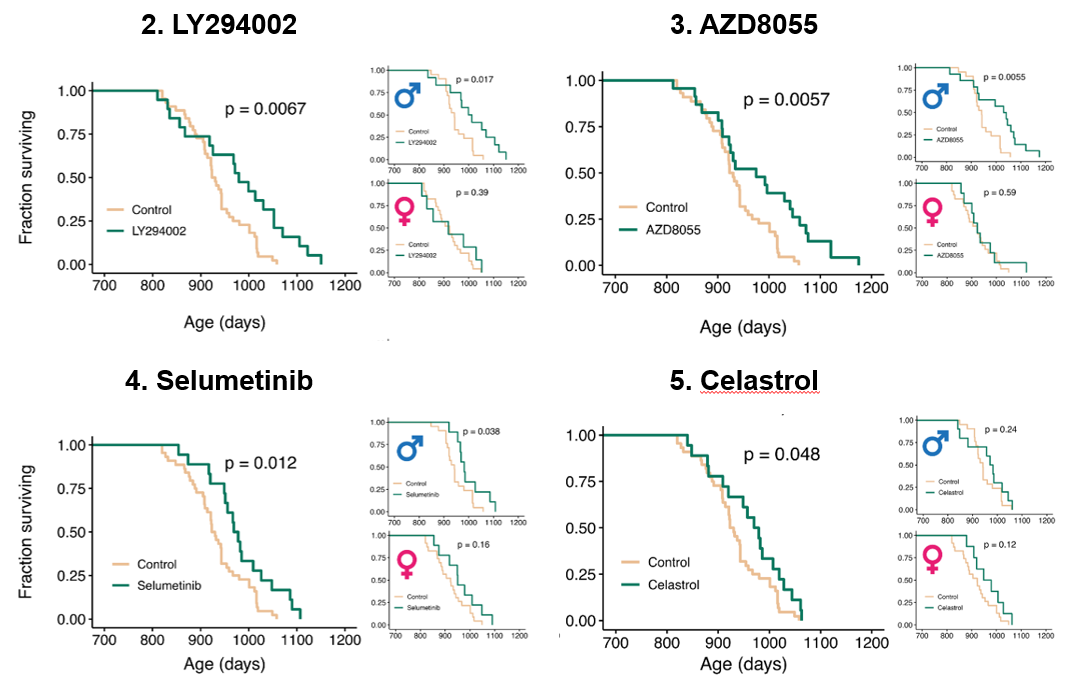
在這種思路下,他們成功找到了5種能顯著延長壽命的全新化合物,以及2種在不同性別、長期觀察下均顯示出延壽效果和健康狀態改善的化合物[3]!
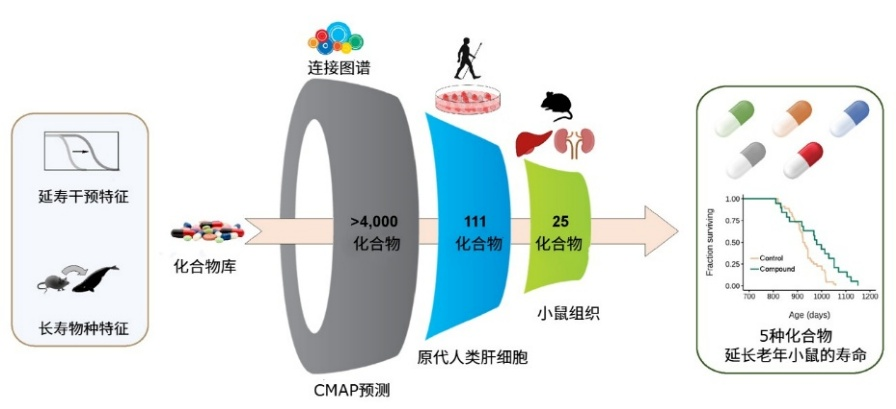
圖注:整合跨干預措施的長壽特徵圖譜與跨哺乳動物的長壽特徵圖譜來篩選長壽藥物
過去,我們篩選干預措施,大多停留在實驗室有效,撈到些好物質,卻不一定對人管用。而在這種新篩選策略下,利用長壽物種中的發現,説不定我們就能找到那些最核心、最普適的長壽干預策略!

描繪衰老軌跡,鎖定衰老精準刻度
長壽特徵能給我們提供長壽的“標準答案”,但同時我們也要搞清楚它的“敵人”——衰老,到底是個啥過程,以及如何測量衰老。
Gladyshev教授介紹了幾種相關發現:
首先,衰老並不是一個單向、不可逆的過程。研究發現,人的生物年齡可以在幾天到幾個月內因重大手術、妊娠或瀕死等壓力快速上升,並在壓力解除後恢復。而恢復能力是健康老化的標誌。現有的第二代衰老時鐘能用來監測和評估干預效果[4]。
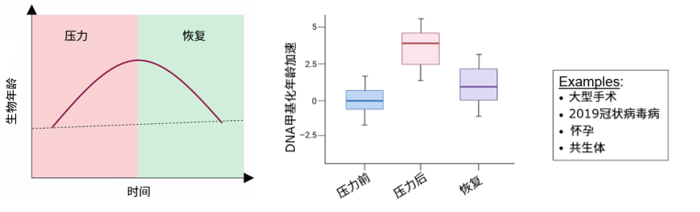
圖注:生物年齡具有“可逆性”和“波動性”
另一個重要發現是:衰老既不是完全隨機的崩解,也不是被精密控制的程序,更像是一場秩序與混亂並存的過程。研究發現,當一個DNA甲基化位點變化時,其他位點也會跟着響應,就好像它們之間存在着某種對話。但與此同時,許多變化也是隨機出現的[5]。
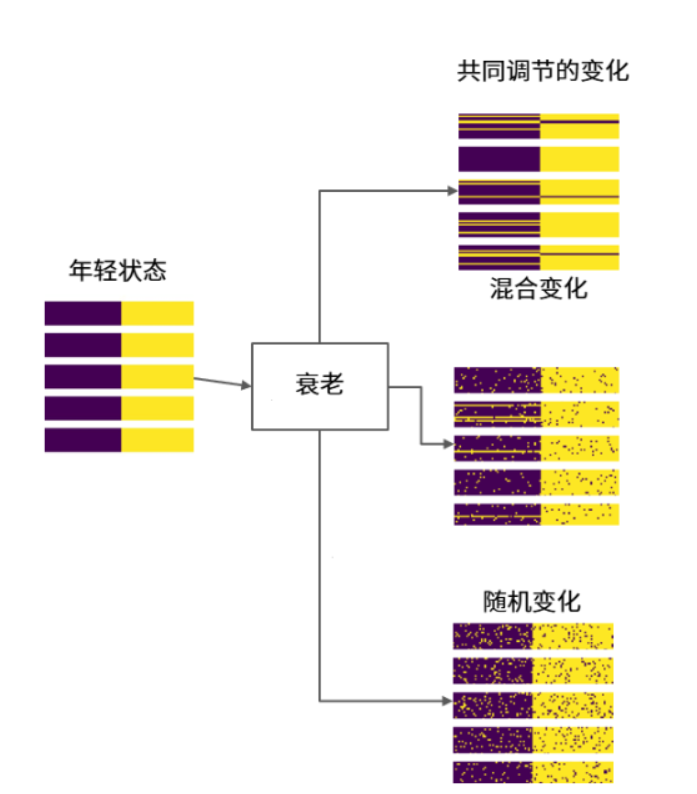
圖注:衰老過程中的變化既有秩序發生,也隨機發生
越深刻理解衰老的過程,測量衰老的時鐘也就被做得越精細、越聰明。
去年,出現了兩種新型**“因果版”衰老時鐘——DamAge和AdaptAge**[6]。前者能測量與衰老、疾病、死亡相關的有害甲基化變化,後者則能反映與健康、恢復力相關的適應性甲基化變化。
相比於傳統時鐘,它們不光能測生物年齡,還能揭示是什麼在推動或減緩衰老指針的移動。
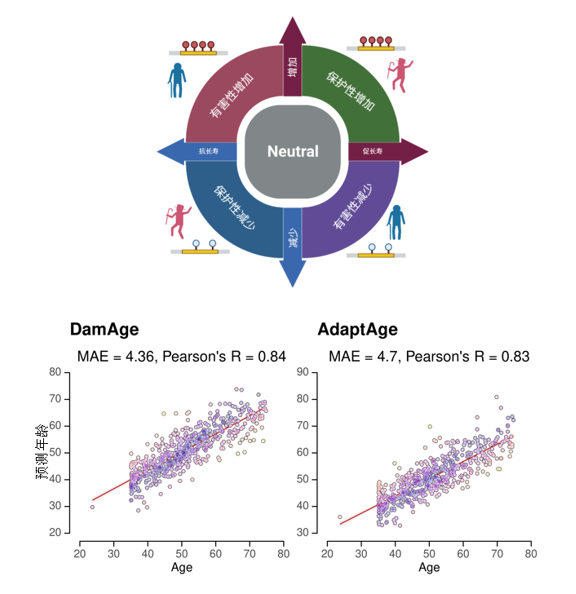
圖注:DamAge和AdaptAge
除了正在開發的能省錢的免疫年齡時鐘,Gladyshev教授還提到了未來測量衰老的兩種方式:量化損傷和監測衰老的變化速率。
例如,我們知道DNA損傷、蛋白質損傷等損傷累積是衰老的根源。但現階段只能在外圍有限地干預,比如減少損傷、或者促進其清除,還沒辦法去量化這一過程。但顯然,只聽聽聲音、看看油耗,車肯定是不能被修好的,衰老也是這個理。


多維“抗衰”攻堅,倒撥衰老指針
接下來,Gladyshev教授還着重介紹了逆轉衰老方面的實踐和發現:
No.1
換血延壽,實錘了?
把老年鼠和年輕鼠的身體連接在一起,通過共享血液循環來抗衰不稀奇。但有研究把實驗時間延長到了3個月,並且揭示了老年小鼠的生物年齡和整體壽命的情況[7],這比較新鮮!(PS:以前多為短期觀察、聚焦於某組織的改善)。
這項研究顯示,血液交換後,老年小鼠的中位壽命和最大壽命分別延長了6周和2周。同時生物年齡顯著降低,這種年輕化效應在身體分離2個月後依然存在。年輕小鼠雖短暫沾染了衰老氣息,但最後逐漸恢復到了正常年齡。
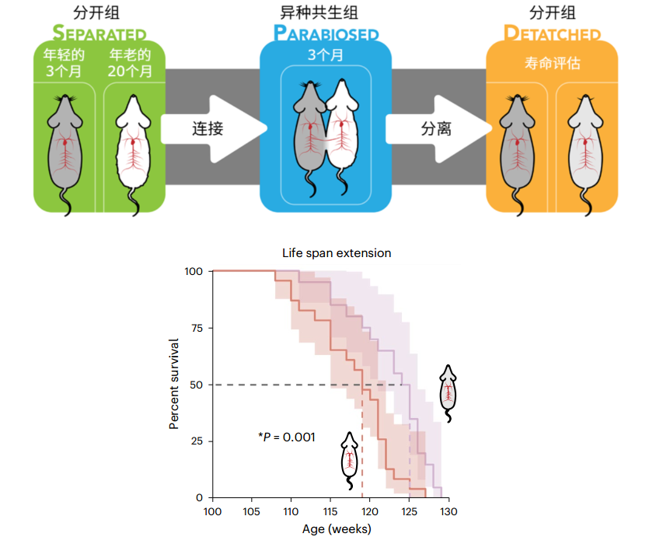
圖注:實驗流程圖(上);分離後的老年小鼠的生存曲線(下)(紅色:同齡共生組,紫色:異體共生組)
更接地氣的治療性血漿置換,目前已經開始了初步的人體探索[8]。從這些研究來看,在年輕的血液中我們確實能找到某些關鍵的抗衰老信號。
No.2
在生命原點,衰老才真正開始
現在,再來問大家一個問題:你認為衰老是從什麼時候開始的?從出生?還是從受精卵形成的那刻?Gladyshev教授認為,答案可能介於兩者之間。
研究發現,在受精後的最初發育階段(約頭3周,在小鼠中是6.5到8.5天),胚胎細胞的生物年齡會降至最低點——即衰老的"生命原點"。而衰老正是從這一節點才真正開始的。
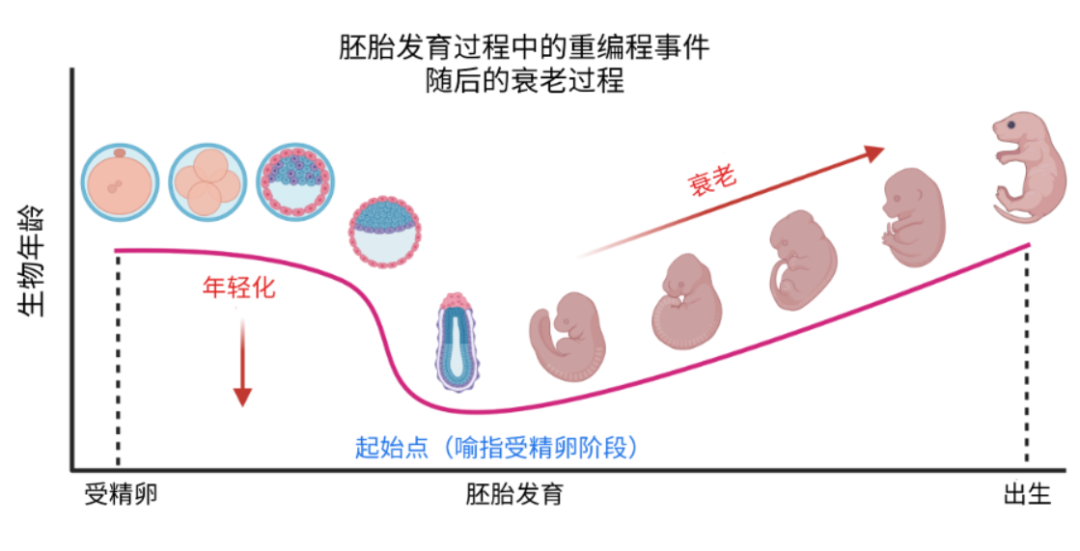
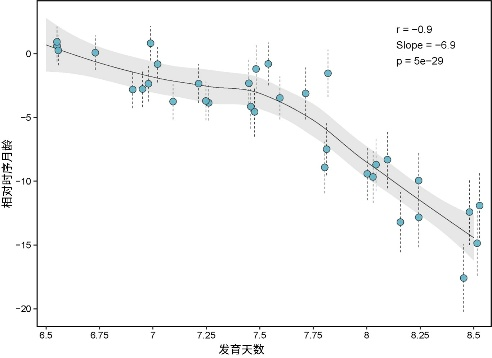
圖注:生命原點及用轉錄組時鐘在小鼠中的驗證
值得注意的是,除了少數特殊的細胞或組織(如胎盤),胚胎中幾乎所有細胞類型都會發生這種年輕化逆轉,胚胎也會因此變得更加年輕。
Gladyshev教授表示,這非常有意思,可能是哺乳動物體內唯一自然發生的年輕化現象。如果我們能理解胚胎是怎麼做到“重置年齡”的,可能有一天就能在成人細胞中複製這種重置機制,讓細胞“返老還童”,甚至讓器官實現再生。
No.3
大腦20歲,腎卻已經來到了40……
最後,Gladyshev教授提到了研究和干預器官年齡的重要性。
不同器官的生物年齡可能存在細微差別——有些人可能大腦更顯衰老,而另一些人可能心臟或肝臟等器官老化得更快。
基於蛋白質組衰老時鐘的原理(採集血漿中蛋白質數據來量化年齡),研究者認為,追溯器官特異性蛋白質的組織來源,能評估器官的衰老程度[9]。
目前,他們已經給十多種組織建立了不同的時鐘,並證明它們能很好的預測疾病的發生和死亡率。例如,肺的加速衰老與對應的慢性阻塞性肺疾病(COPD)存在明顯關聯、大腦和血管加速老化能獨立預測阿爾茨海默病的進展……
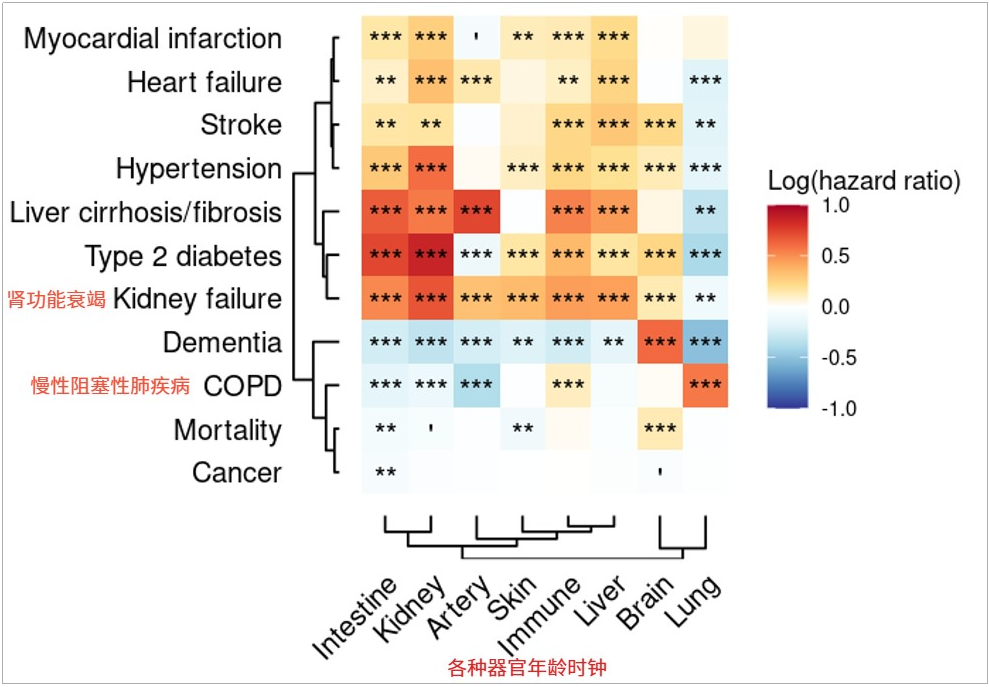
圖注:特定器官的加速衰老與對應器官的疾病發生存在明確關聯
當一個人的大腦加速衰老時,他得腦部疾病和死亡的風險會顯著增加。但如果我們提前識別到了這些提前要衰老的組織,就能進行早期干預,有望延長該個體的健康壽命與整體壽命。
從尋找長壽物種的長壽特徵,到描繪衰老、測量衰老,再到嘗試各種路徑干預衰老,人類正以前所未有的系統性策略向衰老的黑暗大陸發起全面進攻。每一條傳來捷報的路徑,都在挑開一束新的長壽之光。儘管任重道遠,但人類卻充滿信心!

聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。文內提及效果僅指成分特性,非疾病治療功能。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Firsanov, D., Zacher, M., Tian, X., Sformo, T. L., Zhao, Y., Tombline, G., Lu, J. Y., Zheng, Z., Perelli, L., Gurreri, E., Zhang, L., Guo, J., Korotkov, A., Volobaev, V., Biashad, S. A., Zhang, Z., Heid, J., Maslov, A. Y., Sun, S., Wu, Z., … Gorbunova, V. (2025). Evidence for improved DNA repair in long-lived bowhead whale. Nature, 10.1038/s41586-025-09694-5 . Advance online publication.
[2] Tyshkovskiy, A., Ma, S., Shindyapina, A. V., Tikhonov, S., Lee, S. G., Bozaykut, P., Castro, J. P., Seluanov, A., Schork, N. J., Gorbunova, V., Dmitriev, S. E., Miller, R. A., & Gladyshev, V. N. (2023). Distinct longevity mechanisms across and within species and their association with aging. Cell, 186(13), 2929–2949.e20.
[3] https://www.biorxiv.org/content/10.1101/2025.06.26.661776v1-0 .
[4] Poganik, J. R., Zhang, B., Baht, G. S., Tyshkovskiy, A., Deik, A., Kerepesi, C., Yim, S. H., Lu, A. T., Haghani, A., Gong, T., Hedman, A. M., Andolf, E., Pershagen, G., Almqvist, C., Clish, C. B., Horvath, S., White, J. P., & Gladyshev, V. N. (2023). Biological age is increased by stress and restored upon recovery. Cell metabolism, 35(5), 807–820.e5.
[5] Tarkhov, A. E., Lindstrom-Vautrin, T., Zhang, S., Ying, K., Moqri, M., Zhang, B., Tyshkovskiy, A., Levy, O., & Gladyshev, V. N. (2024). Nature of epigenetic aging from a single-cell perspective. Nature aging, 4(6), 854–870.
[6] Ying, K., Liu, H., Tarkhov, A.E. et al. Causality-enriched epigenetic age uncouples damage and adaptation. Nat Aging 4, 231–246 (2024).
[7] Zhang, B., Lee, D. E., Trapp, A., Tyshkovskiy, A., Lu, A. T., Bareja, A., Kerepesi, C., McKay, L. K., Shindyapina, A. V., Dmitriev, S. E., Baht, G. S., Horvath, S., Gladyshev, V. N., & White, J. P. (2023). Multi-omic rejuvenation and life span extension on exposure to youthful circulation. Nature aging, 3(8), 948–964.
[8] Fuentealba, M., Kiprov, D., Schneider, K., Mu, W. C., Kumaar, P. A., Kasler, H., Burton, J. B., Watson, M., Halaweh, H., King, C. D., Yüksel, Z. S., Roska-Pamaong, C., Schilling, B., Verdin, E., & Furman, D. (2025). Multi-Omics Analysis Reveals Biomarkers That Contribute to Biological Age Rejuvenation in Response to Single-Blinded Randomized Placebo-Controlled Therapeutic Plasma Exchange. Aging cell, 24(8), e70103.
[9] Oh, H. S., Rutledge, J., Nachun, D., Pálovics, R., Abiose, O., Moran-Losada, P., Channappa, D., Urey, D. Y., Kim, K., Sung, Y. J., Wang, L., Timsina, J., Western, D., Liu, M., Kohlfeld, P., Budde, J., Wilson, E. N., Guen, Y., Maurer, T. M., Haney, M., … Wyss-Coray, T. (2023). Organ aging signatures in the plasma proteome track health and disease. Nature, 624(7990), 164–172.