阿斯利康搶跑,超20億元授權,還能幫來凱醫藥贏得多大商業機會?_風聞
医药研究社-2小时前
對於來凱醫藥來説,“臨牀產品商業化”這一重要時刻是越來越近了。
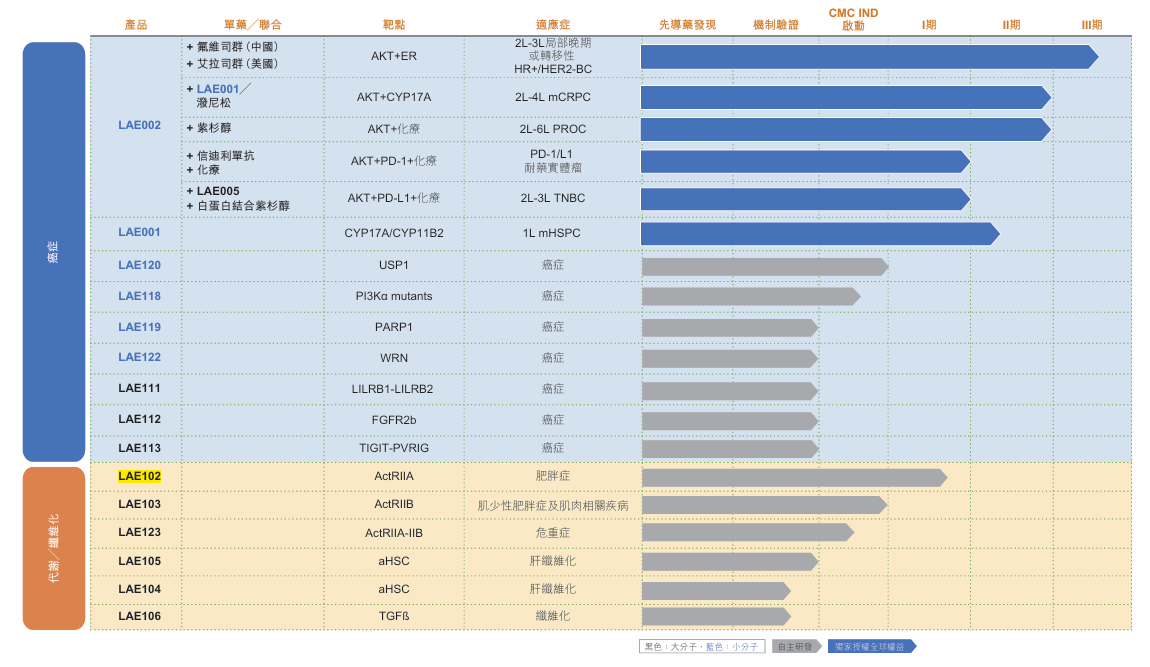
11月12日,該公司發佈公告稱,根據許可協議的條款與條件,齊魯製藥獲授獨家許可,於中國地區(包括中國內地、香港特別行政區、澳門特別行政區及中國台灣地區)進行LAE002 (afuresertib)的研究、開發及商業化。
另外,作為回報,直至首個適應症在中國獲得新藥申請批准,來凱醫藥有權獲得最高總計人民幣5.3億元不可退還的首付款與臨牀開發里程碑付款,以及最高總計人民幣20.45億元的首付款及里程碑款項,亦有權就許可區域內LAE002的未來淨銷售額收取梯度銷售分成,分成比率在十餘個百分點至二十餘個百分點。
消息公佈後,市場情緒也被帶動,今日來凱醫藥早盤高開超4%。在投資市場看來,成功接上市場化這一環,藥企的“苦苦研發”才算得上真正有意義,尤其是對潛在BIC/FIC藥物的開發更應着眼於務實。
商業化速度還是慢了?
即將“登場亮相”的LAE002是來凱醫藥的核心管線之一。
據介紹,LAE002為一種AKT強效抑制劑,能同時抑制所有三種AKT亞型,也是全球僅有的兩種處於晚期臨牀開發階段的針對乳腺癌及前列腺癌的AKT抑制劑之一。
產品開發上,來凱醫藥已針對LAE002啓動HR+/HER2-乳腺癌III期臨牀試驗(AFFIRM-205),目前試驗招募正在按計劃進行,目標於2025年第四季度完成受試者入組,2026年向中國國家藥品監督管理局藥品審評中心提交新藥上市申請。
對LAE002這款產品,市場其實也期待許久了。
從療效上來看,AKT抑制劑有望成為“抗癌利器”。據瞭解,AKT是一種絲氨酸/蘇氨酸蛋白激酶,具有AKT1、AKT2、AKT3三種亞型,在調節細胞增殖、存活及代謝方面發揮着關鍵作用。尤其是AKT抑制劑與其他分子的聯合療法以治療耐藥性癌症,包括對其他抗癌藥物的獲得性耐藥及對化療和靶向療法的適應性耐藥,具有很強的臨牀前理論基礎。
比如,在2024年歐洲腫瘤內科學會(ESMO)大會上,來凱醫藥公佈了LAE002聯合氟維司羣用於標準治療失敗的局部晚期或轉移性HR+/HER2-乳腺癌患者Ib期研究的最終數據:在18位PIK3CA/AKT1/PTEN變異的乳腺癌患者中,中位無進展生存期(PFS)為7.3個月。
橫向對比,阿斯利康同類AKT抑制劑Capivasertib(卡匹色替片)聯合氟維司羣在相同人羣的PFS僅5.7個月,單藥組僅1.9個月。
不過,值得一提的是,來凱醫藥的LAE002雖然積極在進行療效搶跑,但商業化速度還是有些趕不上阿斯利康。
今年4月,國家藥品監督管理局官網發佈的公告顯示,阿斯利康研發的1類創新藥物Capivasertib獲批上市,成為全球首創AKT抑制劑,用於治療激素受體(HR)陽性、人表皮生長因子受體2(HER2)陰性的晚期或轉移性乳腺癌成年患者。
眼看着已有藥企贏得先發優勢,來凱醫藥的心情可能也比較急切。而且,對比阿斯利康這樣的老牌跨國醫藥巨頭,來凱醫藥在產品研發、商業等方面的積累相對薄弱。這種情況下,推進戰略合作確實有必要。
此次合作中,齊魯製藥的助力應該也不會小,其是國內領先的垂直整合型製藥企業之一,集成品劑型(FDF)和活性藥物成分(API)的研發、生產和銷售於一體,產品現已遠銷全球100多個國家和地區,商業模式頗為成熟。
 但必須認清的一個事實是,經歷過漫長的產品研發週期以及隨着市場競爭環境越來越複雜,來凱醫藥的商業崛起顯然難以一蹴而就。
但必須認清的一個事實是,經歷過漫長的產品研發週期以及隨着市場競爭環境越來越複雜,來凱醫藥的商業崛起顯然難以一蹴而就。
等待另一駕馬車接力
這些年,“虧損”已經是來凱醫藥的一個經營常態。
公開財務數據顯示,2021-2024年及2025年上半年,來凱醫藥分別實現淨虧損為7.49億元、7.82億元、3.69億元、2.54億元及1.30億元。好消息是,隨着研發費用下降,虧損已經明顯收窄。
 比如,今年上半年,來凱醫藥的研發費用為1.05億元,同比減少16.6%,主要由於2024年上半年產生與III期臨牀試驗AFFIRM-205有關的里程碑付款1.78億元,而於2025年同期並無產生該類費用。
比如,今年上半年,來凱醫藥的研發費用為1.05億元,同比減少16.6%,主要由於2024年上半年產生與III期臨牀試驗AFFIRM-205有關的里程碑付款1.78億元,而於2025年同期並無產生該類費用。
不過,要徹底扭轉虧損的局面,最關鍵的還是要看核心產品的市場表現。而且,考慮到臨牀結果不及預期、市場競爭加劇等風險,“一架馬車上路”應該是不夠的。
這種情況下,我們也注意到來凱醫藥還有一款備受關注的新藥——LAE102。據悉,這是全球為數不多已經進入臨牀試驗階段的靶向ActRII的在研管線,可與GLP-1受體激動劑聯用,達到減少脂肪並降低肌肉流失的效果,同樣立足於風口。
 世界肥胖聯盟(World Obesity Federation)預測,2030年全球肥胖症患者人數將高達12億。而目前熱門減重藥物如GLP-1受體激動劑仍存在一定的短板。據悉,使用GLP-1藥物減重,總是會伴隨着大約25%-40%的肌肉流失,容易加大人體患骨質疏鬆症、免疫力降低的風險,這也凸顯了LAE102這類候選藥物的應用潛力。
世界肥胖聯盟(World Obesity Federation)預測,2030年全球肥胖症患者人數將高達12億。而目前熱門減重藥物如GLP-1受體激動劑仍存在一定的短板。據悉,使用GLP-1藥物減重,總是會伴隨着大約25%-40%的肌肉流失,容易加大人體患骨質疏鬆症、免疫力降低的風險,這也凸顯了LAE102這類候選藥物的應用潛力。
只不過,該產品的開發週期依舊漫長。來凱醫藥半年報透露,集團於2025年3月底在中國啓動LAE102的I期MAD研究招募工作,旨在評估皮下給藥的LAE102在60名超重/肥胖受試者中的安全性、耐受性、藥代動力學和藥效動力學。
另外,ActRII降脂增肌領域同樣不乏醫藥巨頭的參與,比如禮來的Bimagrumab,研發進度已經快於來凱醫藥的LAE102。
但兩款藥之間的關係可能是共存大於競爭。據悉,2024年11月,來凱醫藥與禮來簽訂了一項臨牀合作協議,旨在支持和加速LAE102針對肥胖症治療的全球臨牀開發。我們也希望LAE102這一架馬車能夠儘快商業化到站。
來源:醫藥研究社