中國製藥二次崛起邏輯_風聞
星船知造-星船知造官方账号-1小时前

文 |李怡雲、嚴大方
編輯|唐曉園
視覺設計:星船知造
正文共計:9523字
預計閲讀時間:12分鐘
僅僅十年時間,中國藥企在全球製藥產業舞台上已從幕後走到台前。
幕後:2015年左右,我國還主要生產原料藥和仿製藥。
這一階段可以看作是中國製藥產業的“第一次崛起”——我們以生產原料藥和仿製藥成為全球製藥產業重要的“隱形參與者”。
台前:今天,中國創新藥產業加速崛起。大量中國藥企正褪去為美國“打工”的身份👇
●2024年,我國批准上市創新藥48個,在研新藥數量已躍居全球第二位。
●2025年上半年,國家藥監局又批准了40多個創新藥上市,這一數字已接近去年獲批總量(48個)。
●2024年,中國發起的新藥臨牀試驗佔全球總量的30%。
《經濟學人》雜誌今年發表文章稱,中國已成為僅次於美國的第二大創新藥研發國。
在展開中國製藥“二次崛起(創新藥)”邏輯之前,《星船知造》想先分享我們觀察到的與此有關的兩件事。
01 兩個“反直覺”
第一件事,十年前有篇速朽的爆款,叫《去日本買只馬桶蓋》。
文章大概意思是——中國人特別喜歡去日本買小家電。為什麼呢?因為日本電飯煲煮出來的米更“晶瑩不粘鍋”;日本電吹風更能“讓頭髮乾爽柔滑”;日本的馬桶蓋呢,更能讓“屁股潔淨似玉,如沐春風”。
該文速朽的原因在於:觀點落伍。
一是其實當年很多日本馬桶蓋就是中國製造。
有杭州消費者千辛萬苦背了只松下馬桶蓋回去,結果該馬桶蓋唯一生產基地就在杭州。
source:松下
二是國內市場已有同類型產品銷售。
董明珠説,中國遊客去國外買馬桶蓋和電飯鍋是個笑話,中國不是沒能力做出好的產品。恆潔衞浴董事長謝偉藩稱,該文作者可能對中國行業不太瞭解——中國智能馬桶蓋技術已經比日本好了(中國採用即熱式技術,優於日本儲水式)。
但這篇文章,恰恰因為其觀點滯後,反而反映了一個現象:
中國製造崛起的速度是遠快於當年歐美的——這讓部分產業(尤其是歐美日曾大幅領先的產業),其實際崛起和大眾認知、消費者信心之間,存在一個時間差。
這個認知時間差,不僅僅存在於普通消費者,有時也同樣存在於媒體報道。

source:giphy
今天,在人們還未普遍意識到時,事實上,中國製藥業已從全球原料藥、仿製藥的重要一極,進化為創新藥的重要參與者。
創新藥:可以簡單理解為,從零開始自主原創研發的藥物。需要花費大量時間和資金,有專利保護。在專利期內享有市場獨佔權,價格較貴。
仿製藥:可以簡單理解為,昂貴藥物的“平替”——創新藥專利過期後,複製其成分和療效的藥。我們藥店買到的,醫院開的,大部分都是仿製藥。是普通人一生的用藥基本盤。
原料藥:藥物中的有效成分,需要加工成製劑才能使用。
此外,還有“專利藥”和“原研藥”。
專利藥顧名思義,就是有專利保護的藥品。它和創新藥是高度重疊的:所有的創新藥在上市初期都是專利藥(還在專利保護期內),但並非所有的專利藥都稱得上是嚴格意義的“創新藥”。
原研藥是由研發廠家生產,但沒有專利保護的藥。那麼仿製藥,也就可以理解為是一種在藥品專利保護期滿後,由其他藥企仿製生產出的藥——和原研藥具有相同的成分和療效,但價格更低。
總之,打比方的話,原料藥和仿製藥更像是“中國製造”。而創新藥則是“中國創造”,是製藥行業皇冠上真正的明珠。
以創新藥為代表的中國製藥“二次崛起”號角早已吹響,只是在大家的印象中,還存在一些信心和認知滯後。

source:pexels
我們想分享的第二件事是,中國生物製藥業已成為全球供應鏈關鍵支柱,深度嵌入全球醫藥健康產業網絡。
比如,美國藥店出售的藥品大都不會標明和“中國”有關,但其實美國很多藥品中的藥物成分(原料藥)由中國供應。
據trade map等相關數據,美國進口的大部分對乙酰氨基酚和布洛芬都來自中國。它們分別是泰諾(Tylenol)和Advil的重要成分。
source:unsplash
美國作為全球醫藥研發大國,其仿製藥長期依賴的就是印度藥廠。
中國是印度原料藥的最大供應商。
一旦“印度製造”出現問題,美國就會同步出現藥物短缺。
《星船知造》在一篇舊文裏寫到過:《美國短缺、印度挖坑、中國救急》👇
“來自中國的順鉑注射液一進入美國,還沒來得及換下中文標籤,就被一搶而空。”
美國藥品短缺先在2023年創了紀錄。2024年第一季度,全美藥品短缺數量又達到新高。
《星船知造》寫作該文時查詢了FDA(美國食品藥品監督管理局)官網上最新的緊缺藥物名單(截至北京時間2023年8月2日晚),發現已有12種抗腫瘤相關的藥物停產、14種抗腫瘤藥物短缺,給美國的患者和患者家屬帶來極大困擾👇
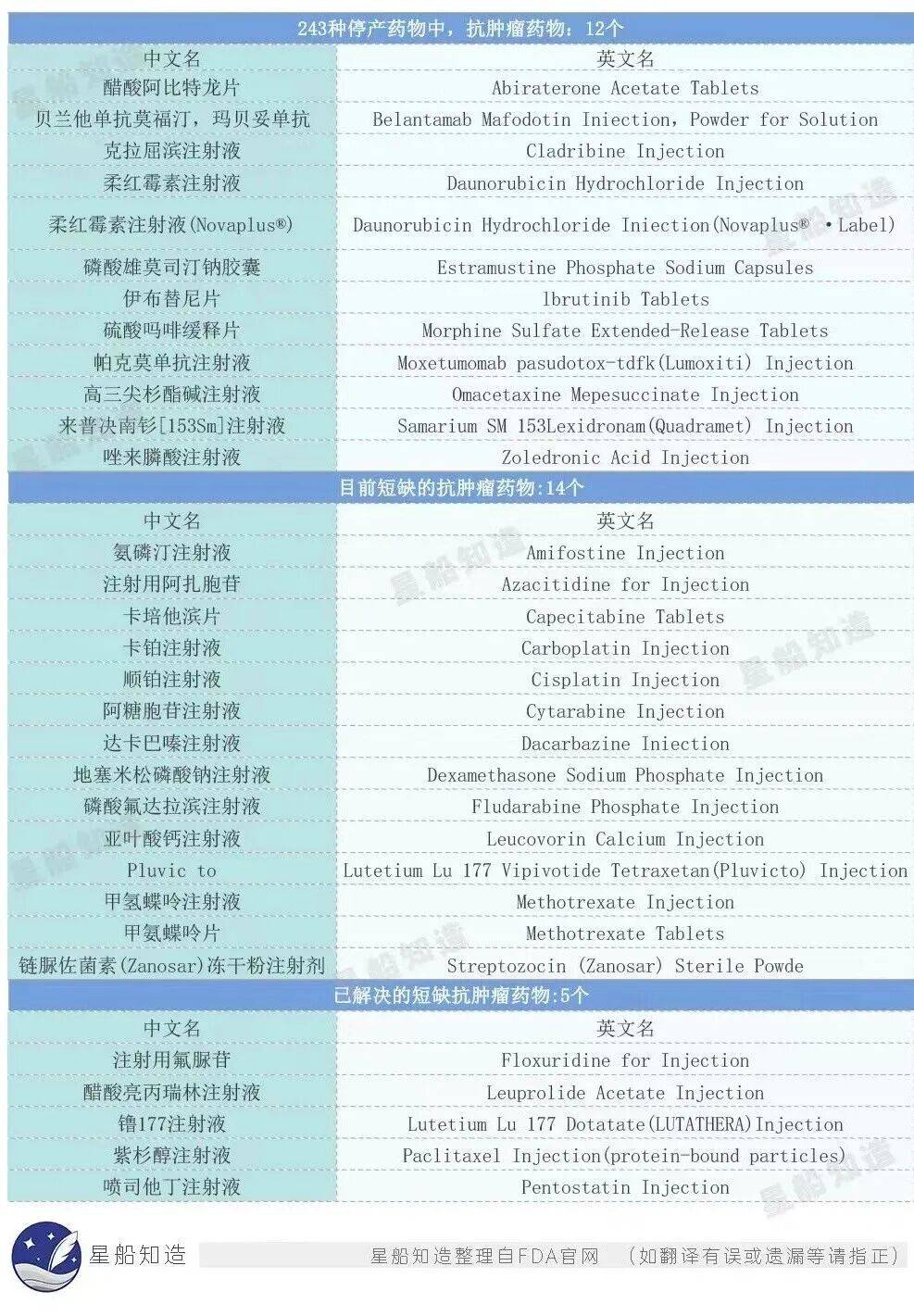
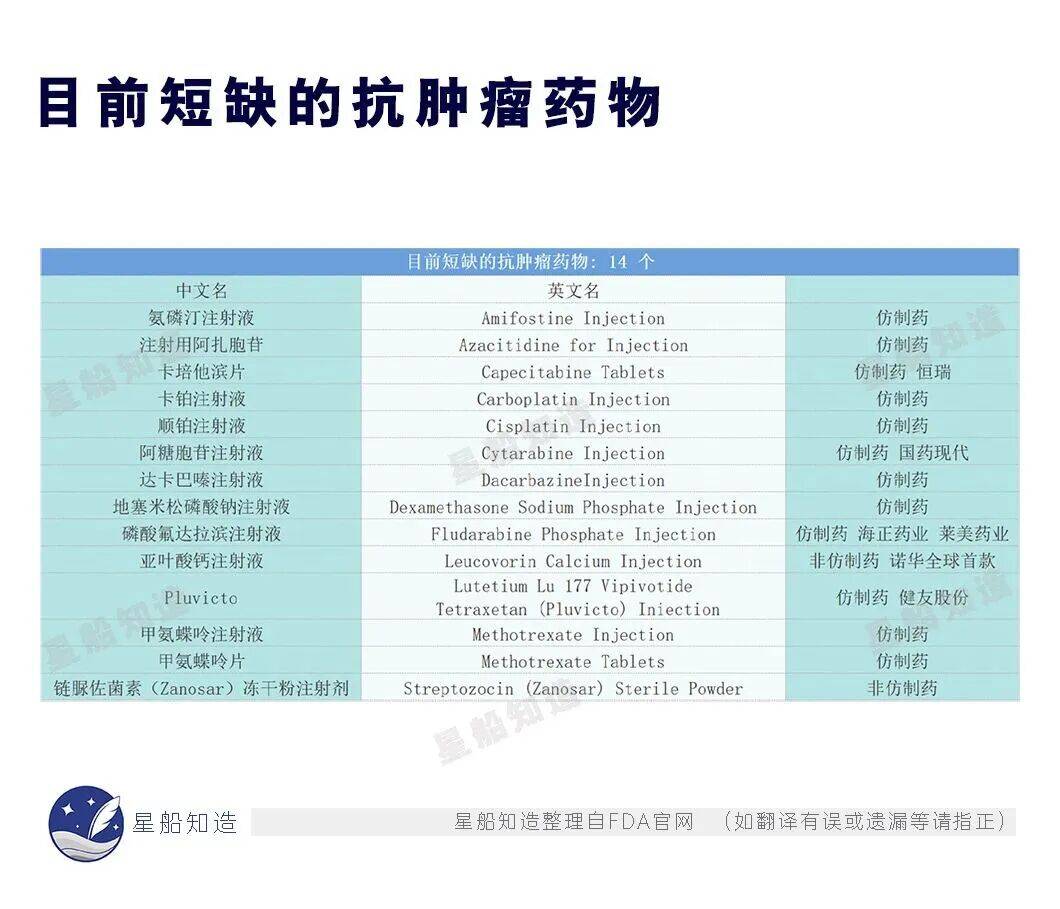
在上述14種短缺的抗腫瘤藥物中,又有12種屬於仿製藥👇
2023年藥物短缺時,芝加哥大學醫學專家在署名文章《A proposal for the Cancer Moonshot: Set up a strategic reserve forlifesaving generic cancer drugs》中寫道:
“我們今天的問題是……儘管擁有世界上技術最先進的醫療系統,但目前相關藥品日益短缺。”
該文建議將包括順鉑、卡鉑、阿糖胞苷、環磷酰胺、甲氨蝶呤等在內的仿製藥加入“仿製藥戰略儲備”計劃。

source:pexels
美國藥品短缺情況之後也並無太大好轉。截至2025年第一季度,美國短缺的仿製藥品種數量仍然在270種左右。
一方面,由於仿製藥利潤低等原因,美國各大品牌從上世紀就開始搞“外包”,大量本地製藥工廠關閉👇
2004年,美國最後一家生產青黴素關鍵成分的工廠關閉。這意味着,美國本土不再生產包括青黴素在內的多種抗生素。
2012年,美國通過仿製藥收費法GDUFA,中小仿製藥商生存變得更為困難,陸續退出美國市場。更多商家將仿製藥生產轉移海外。
2018年,美國仿製藥的處方佔有率達到90%,但費用僅是處方藥費用的20%左右。新澤西州、加利福尼亞州和密蘇里州的製藥工廠關閉。
另一方面,美國仿製藥十分依賴印度等地的供應鏈。利潤博弈又使得僅有的幾家印度企業佔據了絕大多數市場。
但早在2019年,FDA就告訴美國國會,在大約90個國家中,印度製藥商的檢查結果合格率最低。
FDA曾表示,美國約60%的藥品短缺都與質量問題有關。
當印度挖坑,美國“順鉑短缺”威脅到了很多癌症病人的生命和救治時,中國藥企填上了緊急供應的空白。
我們同樣在《美國短缺、印度挖坑、中國救急》中查閲了近十年中美貿易相關數據👇
在高技術產品領域——如信息通信、先進材料、光電、核技術、柔性製造——美國這些領域產品的進口總額中,來自中國的佔比都在下降。
比如,2016年中國出口美國的光電產品,佔該年美國光電產品總進口額中的22.39%。但到了2022年,佔比數字變為了6.35%。
一個領域卻是例外——中國出口美國的生物技術產品份額佔比一直在增加。
2016年中國出口美國的生物技術產品,佔該年美國生物技術產品總進口額中的0.66%。到了2022年,這個數字已經變為2.79%。
日經中文網的報道也印證了這一趨勢:2022年美國來自中國藥品的進口額達到69.5億美元,是2021年8.2億美元的約8倍。僅2023年1至5月,進口額就已達到2021年同期的2倍以上。
美國食品藥品監督管理局(FDA)曾臨時許可中國的齊魯製藥向美國出口更多抗癌藥物“順鉑”等產品,以緩解供應短缺。此外,免疫抑制劑、循環系統治療藥等也從中國大量進口。
美國75%以上的維生素B6、B12、B1、C以及近70%的維生素E的進口都依賴中國。

source:unsplash
仿製藥是每一個普通人的用藥基本盤。如果説創新藥是100分,那麼一款合格的仿製藥就是80分。
80分,就能解決大多數人大多數疾病的治療。至於剩下的20分,將由其巨大的價格優勢補足。
過去,中國製藥界正是以仿製藥、原料藥參與着人類與疾病的戰爭。
現在,僅僅十年時間,中國創新藥已經崛起。
產業做對了什麼?還需要跨過哪些關卡?
source:unsplash
我國創新藥的關鍵轉折點,發生在十三五期間。
《中華人民共和國國民經濟和社會發展第十三個五年規劃綱要》中,將藥品和醫療器械生產列為產業優先事項。
2025年,“十五五”規劃中,生物製造被定義為未來產業。在未來五年內支持創新藥品和醫療器械的開發。
更大的勝利將在下一個“五年”到來。
02中國創新藥,走到哪步了?
過去,提起中國藥物出口,大多還是原料藥——佔全球市場的三分之一左右。
據2024美國的一份調查,79%的受訪美國生物技術公司,與中國的製造商至少簽訂了一份合同或產品協議,其中30%的公司有已批准藥物的製造委託合同在中國。
根據Grand View Horizon的統計:按收入計算,2024年中國佔全球生物藥代工市場的10.4%。
所謂原料藥,就是我們上文提到過的構成成品藥的主要核心成分。中國的原料藥廠商負責把化學或生物原料提煉成高純度的有效成分,再供應給各地的製藥商。
很長一段時間裏,中國製藥界都在以這種隱形但重要的方式參與着人類與疾病的戰爭。
source:pexels
現在,創新藥的崛起,讓生物製藥行業也開始成為“中國創造”的主力軍了。
數量上——
2023年,我國創新藥出海交易共計69筆,披露總金額達303.235億美元。其中,百利天恆的雙抗ADC藥物BL-B01D1創下了84億美元的最高單筆授權記錄。
2024年,我國創新藥出海總數達98筆,披露總交易金額攀升至595.505億美元。
恆瑞醫藥、百濟神州等頭部企業2024年創新藥收入突破百億元大關。
從市場規模看,2020-2024年中國創新藥市場從0.82萬億元增長至1.14萬億元,年均複合增長率達8.53%,
艾昆緯報告顯示,2024年中國發起的新藥臨牀試驗佔全球總量的30%。
實際上,我們僅僅用了十年,就把這個數字從1%躍升至30%,目前僅次於美國。
而在腫瘤領域,中國臨牀試驗啓動數量已經超越美國。

source:pexels
從質量和成果來看——
中國製藥也發生了脱胎換骨的變化。越來越多來自中國的創新藥獲得FDA(美國食品藥品監督管理局)上市批准,有些還拿到了獲得優先審評資格或突破性療法認定。
雖然還需等待這一批過審創新藥破冰美國市場,但在此之前,一個更加普遍的事件已經蔓延:
創新藥license-out(對外授權\出海授權)模式在近兩年成為國內製藥界主流。
license-out:將自己某個研發階段的候選藥物的開發、生產或銷售權,“賣”給其它藥企。
這意味着,大量中國企業正脱下為美國製藥公司的“打工”的身份,搖身一變成為更有話語權的“生意夥伴”。
僅2025年上半年,已披露創新藥License-out交易的首付款總額便達到33億美元,交易總金額達到484.84億美元。
百濟神州的澤布替尼在2023年成為首款全球年銷售額突破10億美元的國產創新藥,標誌着國際市場的認可。
我國腫瘤治療也在對外授權上頗有佳績——舶望生物siRNA療法和石藥集團降脂藥物分別以超1億美元首付款授權諾華、阿斯利康。

source:舶望生物
其實,License-out原本是美國藥品研發產業分工的典型。
早期創新型企業負責發現靶點、設計候選藥、做早期臨牀;而有錢的大製藥公司,則把這些開發中的資產買過來,繼續做臨牀後期、監管申報、市場推廣等費錢的工作。
這樣一來,有技術的企業拿到了錢,有錢的企業拿到了產品和市場,算是兩全其美。
而現在,由於中國早期創新藥資產技術含量越來越高、臨牀數據越來越好,我們與海外製藥商的交易頻率也自然快速增加。
越來越多大藥企推着購物車來到了中國。

source:giphy
除了海外授權交易,我們還有兼併收購等多種模式,共同推動創新藥出海。
2024年5月,恆瑞醫藥將具有自主知識產權的GLP-1類創新藥HRS-7535、 HRS9531、HRS-4729有償許可給美國 Hercules 公司。作為對外許可交易對價一部分,恆瑞醫藥將取得美國Hercules公司19.9%的股權。
可以説,中國製藥業已從過去以原料藥和仿製藥為主的“隱形參與者”,升級為在生物藥生產(佔全球市場10.4%)和創新藥研發(佔全球新藥臨牀試驗30%)都具有全球影響力的力量。
中國製藥業已從幕後走到前台,並隨着一個個穩紮穩打的五年進展,將在可預期的未來競爭主角。
03 中國製造邏輯也在這個領域上演
如何理解中國製造崛起邏輯在創新藥領域的上演?
主要看三點——
1)CXO(醫藥外包)行業是我國創新藥崛起的核心基石。
2)中國憑藉人才優勢、強大的工業化、標準化能力,抓住了全球藥企研發外包的趨勢,成功將自身角色從“生產”拓展至了“開發”。
3)2010年之後,中國CXO(醫藥外包)企業紛紛登陸資本市場,拿到資金後擴大產能、全球佈局。
這意味着,中國第一次在醫藥創新鏈上有了具有全球競爭力的產業集羣。

source:pexels
2005年,上海張江的一個廠房內,幾台進口分析儀嗡嗡作響。由李革創建的藥明康德彼時員工不到百人,靠着為外國藥企代做實驗維持現金流。
從上世紀90年代開始,我國已經憑藉着規模化生產,在仿製藥供應和原料藥出口上深度參與了全球醫藥市場。
但當時,跨國藥企在中國主要是設廠、做銷售,很少把核心業務外包到這裏。
進入新世紀之後,全球新藥研發逐漸進入高成本階段。隨着上一個時代的技術果實被紛紛摘完,研發分子複雜度提升,一款藥的平均研發成本從10億美元飆升到20億美元以上。這種背景下,跨國藥企們開始尋求相對成本更低但質量可靠的研發夥伴。
2000年,在美求學並在醫藥行業工作多年的李革懷揣着50萬的創業基金回到中國。
彼時,各行各業的海外華人開啓了“反向遷徙”浪潮,政府和產業資本聯手,為一眾科學家和技術人員們提供了寬鬆而優渥的創業環境。
李革就是其中之一。

藥明康德的第一間實驗室 source:藥明康德
曾有業內人士回憶:在當時,藥明康德這種新穎的製藥“代工”在國內還很小眾。雖然公司大部分員工都是博士,但相關工作經驗卻是空白。公司對博士們進行培訓,然後將跨國藥企們的訂單任務分配給他們。
同時,工作負責的是藥品研發的關鍵前期環節,但操作起來“和富士康的流水線工人無異。”
沒人想到,十幾年後,這種“代工”會變成一個數千億級產業,撐起中國製藥工業全球化的半壁江山,並直接把中國在全球醫藥產業鏈中的作用從“生產階段”拓展到了“開發階段”。
source:unsplash
在公眾想象裏,新藥的誕生似乎是某個科學家在實驗室發現了一個神奇分子,像愛迪生髮明燈泡那樣。
但事實上,在研發環節,藥品需要可重複性與一致性。這也就決定了:一款藥從實驗室走向臨牀,需要經歷上千次驗證:
動物實驗、
穩定性試驗、
工藝驗證、
毒理評估、
藥代動力學分析……
這些複雜環節的堆疊,意味着在一款藥的研發之路上,永遠少不了兩樣東西:人,和工業化系統。

source:unsplash
從外部視角看,中國CXO(醫藥外包)的崛起,源於跨國藥企們在成本壓力下的一次次選擇。
但從更高視角看,它一定程度上是“中國製造邏輯”在製藥領域的延伸。
由於操作量巨大,在藥品研發的成本結構中,人工佔比極高。中國有着龐大的生物醫藥人才基礎,大部分頭部CRO企業的博碩員工佔比超過了50%;同時中國博士的平均薪資低於美國同行,卻能提供相當的技術能力——這是天然的結構紅利。
龐大的人口基數,也讓產業擁有更高效的臨牀試驗體系。
同時,CXO的底層邏輯,是研發和生產的流程化與標準化——這又與中國在電子、汽車、化工產業積累的工業化經驗高度契合。
比如,在中國建立GLP標準的藥物安全評估中心,建設時間和成本上都更有優勢。公開信息表明,在美國,這種設施需要兩年至三年時間建設,但中國只需要一年半的建設時間。有生物製藥領域創始人表示,“我們(在中國)做事的速度比世界上任何其他地方都快兩倍甚至三倍。”
source:藥明康德
嚴格來説,藥明康德在CXO(醫藥外包)中屬於CRO(醫藥合同研發企業),主要負責的是研發環節。
而隨着“藥明”模式的成功,眾多中國企業開始嘗試將服務拓展到產品週期的其它部分:
比如工藝和臨牀。由此又誕生了如博騰股份、泰格醫藥、昭衍新藥等CPO(以合同形式為製藥企業提供生產環節外包服務)、CMO(側重藥物生產環節)等企業。
創新藥的誕生,要經過四個階段:
藥物發現、新藥開發、藥物生產、市場營銷。
CRO(醫藥合同研發企業):Contract Research Organization,通俗一點説就是傳統藥企出錢,CRO企業來做研發,效率共贏。
它主要負責前兩個步驟——藥物發現和新藥開發。
CMO負責第三個階段——藥物生產。
2010年之後,中國CXO(醫藥外包)企業紛紛登陸資本市場,拿到資金後擴大產能、全球佈局。
藥明康德赴美上市、藥明生物拆分獨立、康龍化成與泰格醫藥在A股崛起——這讓中國第一次在醫藥創新鏈上有了具有全球競爭力的產業集羣。
它們已經為中國進擊更有技術力的環節做好了鋪墊。
只待一個同樣強有力的力量,再次助力中國高技術產業的崛起。
04十三五到十五五,創新藥爆發的關鍵“轉折點”
我國創新藥的關鍵轉折點,發生在十三五期間。
一輪藥改直指當時的一個核心問題——中國是仿製藥大國,卻不是強國。
一個強有力的力量出手。更多仿製藥企業將未來放到了創新和研發上。

source:pexels
CXO(醫藥外包)行業,有較高的技術門檻,但説到底依然是在承接跨國藥企的業務訂單。
這也就意味着,中國製藥在全球鏈條中的角色,一直到2015年,也只是從“打工仔”晉升“高級打工仔”。
《星船知造》的觀察中,之所以我國製藥行業在創新性和原創性上一度踟躕不前,其中一個原因就在於:企業們躺在仿製藥的金山上即可。

source:pexels
彼時,中國的藥品註冊制度仍有提升空間,一些仿製藥無需證明與原研藥的療效一致性,只要化學成分相似即可註冊。
因此,大量藥企形成了銷售驅動型的商業模式——靠渠道和營銷吃飯,而非研發。
2015年,轉折點到來。
《中華人民共和國國民經濟和社會發展第十三個五年規劃綱要》中,將藥品和醫療器械生產列為產業優先事項。
規劃通過鼓勵創新藥研發、推動醫療器械科技產業發展等措施,旨在提升我國醫藥產業的整體水平和國際競爭力。

source:pexels
為了扭轉國內市場低水平競爭的局面,有關部門以雷霆之勢開啓一系列監管改革,其中最知名的當屬“722風暴”。
2015年7月22日,國家食品藥品監督局(CFDA)下發通知,要求對1622宗在審藥品註冊申請進行臨牀數據自查。
一年之間,1165份註冊自願撤回——檢查期間,大量問題被暴露在公眾視野:
臨牀採集樣本與實驗室分析樣本之間存在差異、
用藥日記不連貫、
患者年齡不符合實際……
在監管部門的嚴厲注視下,仿製藥的門檻有所抬升,不少混日子的企業就此消失。
而之後幾年帶量集採的出現以及醫保支付的改革,都使得過去靠仿製和低成本複製的商業模式被逐步擠壓。
同一時間,我國一系列藥政改革開啓👇
●簡化臨牀試驗審批流程:2015年,國家藥品監督管理局(NMPA)開始簡化臨牀試驗審批流程,清理積壓申請,加速創新藥上市進程。
●藥品集中採購:2015年2月,國務院發佈《關於完善公立醫院藥品集中採購工作的指導意見》,明確提出藥品集中採購要做到量價掛鈎,以量換價。
●嚴格稽查臨牀試驗數據:2015年,藥監局對臨牀試驗數據進行嚴格稽查,打擊數據造假行為,確保藥品質量。
這輪藥改直指當時的一個核心問題——中國是仿製藥大國,卻不是強國。
因此,藥改意在讓“劣幣驅逐良幣現象”加速終結。倒逼更多的仿製藥企業“上進”,將未來放到創新和研發上。
source:unsplash
這之前,因為大部分藥的效果差不多,能不能賣有時靠的是藥廠和醫生和醫院的關係;
而當國家和各地醫保成為最大買方,帶金銷售之路被徹底堵死——由此倒逼企業拿真正的實力説話。
再加上前述海外科學家紛紛回國創業,產業創新的人才條件已有儲備。從2016年到2020年,監管規則的落地讓投資的閘門可以放心敞開:
2018年,港交所允許未盈利生物科技公司(18A)上市;
2019年科創板開板;
這些都拓寬了藥企的融資渠道。
2018年開始,中國醫藥研發投入以23.1%的年均複合增長率增長,是全球增速的5倍。從2016年到2021年,中國每年新登記臨牀試驗數量從 841個急劇攀升到3278個。
一切都致使創新研發成為一種規模化現象,並進入本土驗證階段。

source:unsplash
“看得見的手”和“看不見的手”合力加速下——
在這期間,中國製藥產業誕生了不少fast follow(快速跟進藥)或me better(改良型同類藥),比如君實生物、信達生物、恆瑞醫藥的PD-1/PD-L1 抑制劑以及百濟神州的BTK抑制劑。
從2019年開始,中國醫藥開發增幅高達200.9%。2021年至2024年間,中國研發中的藥物數量翻倍。
與此同時,一場讓中國創新藥引發國際範圍強烈注意的“出海浪潮”隨之到來。

source:pexels
2017年,傳奇生物與強生簽訂了獨家全球許可和合作協議,將管線中一款CAR-T藥物授權予後者。這個首付款就高達3.5億美元的大單,徹底點燃中國創新藥“向外走”的激情和信心。
之後幾年內,這種被成為license out(對外授權)的新模式,很快在數量和種類上不斷刷新記錄。
到2022年,中國創新藥的對外交易數量達到驚人的233起,佔全球的29.53%,交易總金額佔比全球10.08%;從技術難度來看,藥企創新點也開始進入雙抗等高難度、前沿的領域。
2024年,中國生物製藥企業達成了175筆融資,公佈的融資總額為32.9億美元,雖然相對於2023年和2022年分別下降了31%和59%——很快,各地政府開始加大對生物醫藥產業的扶持。
2024年7月,國務院常務會議審議通過《全鏈條支持創新藥發展實施方案》。
多地政策主要有:
1, 鼓勵創新,鼓勵企業進行技術創新和源頭創新;
2, 全鏈條支持創新藥發展,各地政策覆蓋了創新藥的研發、審評審批、臨牀應用、支付、投融資等多個環節;
3, 資金支持,各地政府提供了不同程度的資金支持,包括研發補貼、產業化獎勵、投融資支持等,以鼓勵企業加大研發投入。
去年四季度國內生物製藥融資出現了明顯的反彈趨勢。
《星船知造》相信,創新藥融資及出海基本盤依然堅硬。
截至2025年6月底,中國創新藥已達成52項出海交易,其中18項總額超10億美元,披露的總金額超過647億美元。
尾聲:下一步通關
很明顯,中國創新藥產業的崛起,既是一場產業升級的集體躍遷,也是一場由市場和政策共同塑造的通關征程。
我們已經進入舞台中央,創新藥領域——美國用近百年時間走過的路,在中國只花了十年。
但客觀看,也造成了一些環節的脆弱,需要進一步越過關卡。
一方面,諸多藥企“訓練”的時間被極度壓縮。同時,真正能決定創新藥產業可持續性的基礎設施和生態能力,尚未完全成熟。

source:unsplash
首先是商業化路徑的單一。
很多中國藥企在完成license-out後獲得了亮眼的賬面收入,卻在自有產品的商業化上遭遇瓶頸。
國內市場集中度低、支付體系複雜、醫保談判週期長;而國外市場壟斷現象嚴重,中國企業打不進當地醫院——
這些都意味着,中國企業只能將創新成果“轉手”跨國藥企,而不是真正“賣給”患者。
這種單一很容易造成頗具風險的財務結構。以創新藥企業中最近風頭正盛的映恩生物為例:
企業2023 年和 2024 年該模式收入佔比分別為99.78%和近100%。由於公司還未有產品上市,因此截至 2024 年末,公司累計虧損已達 17.95 億元,資產負債率高達 196.7%。
對於大部分創新藥企來説,儘管虧損幾乎是研發創新藥的必經之路,但如果公司一直把核心管線賣給他人,也便意味着未來不太可能具有IPO的可能性,股市槓桿也就無法進入公司長期發展的工具箱中。

source:pexels
這也就帶來了下一個問題:
沒有穩定商業化現金流的創新藥企業,需要來自投資機構的支持——也意味着:易遭到資本週期的反噬。
自2021年起,由於疫情和美元加息的影響,創新藥一級市場融資額下降、港股18A板塊持續低迷,大量Biotech被迫自救,有人轉向併購、有人削減管線、有人裁撤研發團隊。
過去,資本用充裕的流動性為行業按下快進鍵;現在,一定程度的資本退潮則迫使企業重新面對“無法讓創新和收益形成良性閉環”的問題。儘管在政策的不斷回調下,這一季的寒冬即將進入尾聲,但中國創新藥亟需在下次降温之前找到更多禦寒的手段。

source:unsplash
最後一個隱憂,是今天覆雜外部環境下,我國製藥產業鏈的外部依賴也同樣存在。
去年,拜登政府簽署生物安全法案,其中點名藥明生物、華大基因等生物製藥企業,要求聯邦政府關聯機構終止與這些企業的合作,意在“保護國家安全”及“產業迴流”;
上個月,紐約時報披露,特朗普可能簽署一項新的行政令,直接針對中國創新藥企的license-out以及臨牀數據的使用。
雖然中國的創新藥已具一定的全球競爭力,同時美國人民的用藥也大量依賴中國。但這也同時意味着,美國市場是我們的“超級買方”。
雙贏背景下,這種全球產業鏈分工可以各盡所能、各得所需;但是在地緣政治摩擦頻發的當下,中國創新藥或許也要在“合作”之外給自己多留一條後路。

source:unsplash
中國製藥產業從仿製藥到創新藥的崛起,正處在一個關鍵拐點上。
一邊是license-out交易頻頻刷新的紀錄、CXO產業鏈繼續外溢的繁榮;另一邊,是原創動力仍在孕育、全球化生態仍在形成的現實。
一艘剛駛出港口的巨輪,在進入深水區後,真正的考驗才剛剛開始。
主要參考資料:
[1] 藥明康德的發展歷程及境外投資視角
[2] Storm Surrounds Clinical Trial Data in China.PDAletter
[3] 創新藥系列深度報告.中航證券
[4] 關於中國創新藥BD的三個新真相. 氨基觀察
本文基於訪談及公開資料寫作,不構成任何投資建議
星船知造原創內容
未經授權,禁止轉載