CTLA-4又坐上了牌桌_風聞
氨基观察-生命科技新时代的商业智库和价值灯塔昨天 10:18
免疫治療進入“後PD-1時代”,迭代與突破正成為主旋律。
當眾多創新靶點尚在驗證途中,BioNTech正選擇將目光重新投向CTLA-4這一老靶點身上。
作為全球首個問世的免疫檢查點抑制劑,CTLA-4抑制劑高開低走後沉寂許久。在最新研發日中,BioNTech則將新一代CTLA-4單抗Gotistobart納入優先免疫調節管線,沉寂多年的CTLA-4再度迴歸行業視野。
憑藉分子設計的雙重創新,Gotistobart在早期臨牀中展現出增效減毒的潛力,提高了安全性窗口與持續療效,為PD-1耐藥患者帶來突破性希望。
眼下,BioNTech把CTLA-4重新推到幕前,意在搶奪下一代IO的基石。創新總是有着矛盾而迷人的兩面性,不到最後一刻,永遠不能對一款藥物下結論。
那麼,老靶點的新生,會成為下一代免疫治療的破局關鍵嗎?
/ 01 /老靶點的新生
在免疫治療的發展歷程中,CTLA-4的發現早於PD-1,卻走出了截然不同的發展軌跡。作為首個打開免疫治療大門的靶點,CTLA-4單抗以全身免疫激活的機制開闢了全新治療路徑,但也因固有缺陷長期處於PD-1的光環之下。
與PD-1單抗20餘款產品上市盛況不同,截至目前,全球獲批的CTLA-4單抗僅有兩款,分別是百時美施貴寶的Ipilimumab(Y藥)和阿斯利康的Tremelimumab。市場表現也與 PD-1抑制劑相差懸殊:2024年,K藥的全球銷售額近300億美元,而Y藥的同期銷售額僅為25.3億美元,不足K藥的十分之一,甚至一大部分的佔比是基於與PD-1單抗Nivolumab聯用的適應症。
安全性問題是制約CTLA-4抗體發展的核心瓶頸之一。早期CTLA-4抗體的作用機制直接:通過無差別抑制削弱Tregs的免疫抑制作用,進而激活全身免疫反應。缺點就是無法區分腫瘤與正常組織中的Tregs,易引發嚴重的免疫相關不良反應(IrAEs)。
療效上的劣勢則讓CTLA-4徹底被PD-1掩蓋。
2014年,K藥、O藥相繼上市,CTLA-4抗體在黑色素瘤、非小細胞肺癌(NSCLC)等核心適應症中表現遜色。以黑色素瘤為例,Y藥治療的客觀緩解率(ORR)僅10%-15%,而K藥的ORR可達 30%-40%,部分亞型甚至能突破50%。
即便是聯合治療場景,CTLA-4抗體也多處於“輔助地位”。比如Tremelimumab目前獲批的適應症均為與O藥聯合治療。
儘管發展受限,CTLA-4的研究從未停滯,而是朝着精準化方向轉型。BioNTech從OncoC4引進的新一代CTLA-4單抗Gotistobart正是這一轉型思路的典型代表,其分子設計通過雙重創新實現了對傳統CTLA-4抗體的突破。
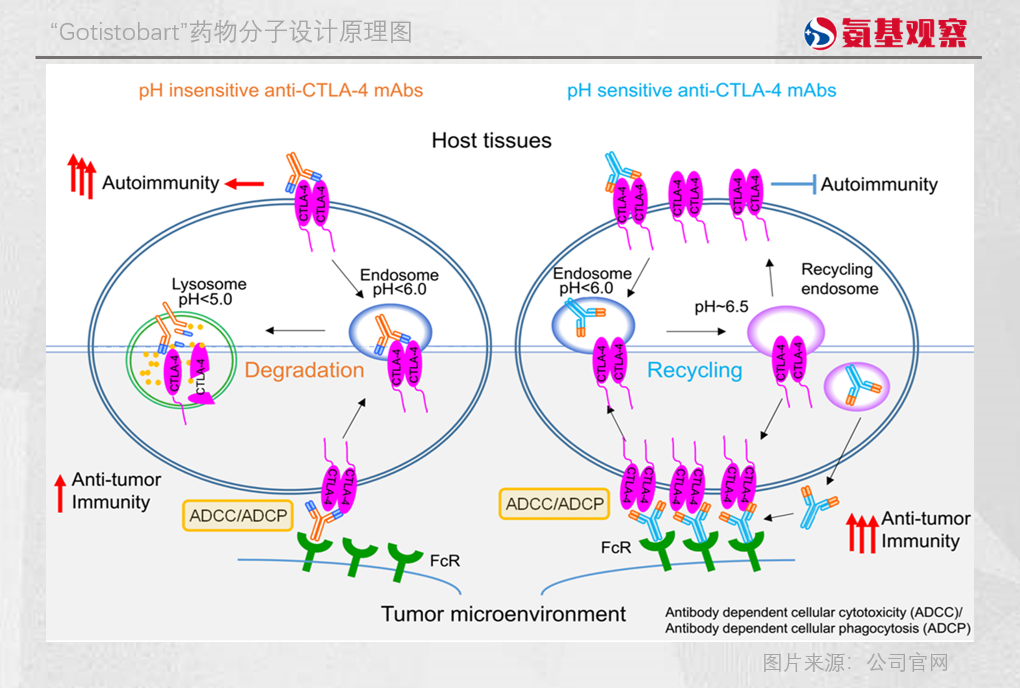 一方面,藉助pH敏感型抗體技術,Gotistobart與CTLA-4結合形成的複合物被細胞內吞後,會在溶酶體的酸性環境中發生解離,使CTLA-4蛋白能夠重返細胞表面重新發揮作用,避免了傳統抗體導致的CTLA-4內吞降解,大幅提升了藥物的治療窗口。
一方面,藉助pH敏感型抗體技術,Gotistobart與CTLA-4結合形成的複合物被細胞內吞後,會在溶酶體的酸性環境中發生解離,使CTLA-4蛋白能夠重返細胞表面重新發揮作用,避免了傳統抗體導致的CTLA-4內吞降解,大幅提升了藥物的治療窗口。
另一方面,通過Fc段的工程化改造,Gotistobart能夠更高效地招募免疫效應細胞,精準清除TME中的Tregs,同時減少對正常組織的影響。
正如OncoC4所言,這種機制使Gotistobart具備了長期、重複給藥的潛力,為持續控制腫瘤提供了可能。
早期臨牀數據初步驗證了其潛力:在針對ICI耐受的NSCLC患者開展的1/2期臨牀試驗中,Gotistobart單藥治療的ORR達29.6%,DCR高達70.4%,這一結果對PD-1耐藥人羣具有突破性意義。
基於此,今年10月,該藥物獲得NMPA授予的突破性療法認定,用於治療PD-1耐藥的晚期NSCLC患者,成為首個在該適應症中獲得突破性認定的新一代CTLA-4抗體。
/ 02 /BioNTech的IO雙支柱
將Gotistobart納入優先免疫調節管線,是 BioNTech構建下一代IO治療體系的關鍵佈局。
在其優先免疫調節劑研發管線中,PD-L1/VEGF雙抗Pumitamig與CTLA-4單抗Gotistobart構成兩大核心支柱,分別代表了多靶點協同增效與老靶點升級改造的發展策略。
作為BioNTech重點佈局的下一代IO基石,Pumitamig的核心優勢在於同時結合PD-L1與VEGF兩個靶點,一方面阻斷PD-1/PD-L1信號通路,激活效應T細胞的抗腫瘤功能,另一方面抑制VEGF介導的腫瘤血管生成,改善腫瘤微環境。
目前,BioNTech已推動Pumitamig20項臨牀落地,除了小細胞癌、NSCLC和三陰性乳腺癌的三期臨牀,更是加速推進泛癌種佈局以及與化療、ADC、新型免疫靶點藥物(如PVRIG抑制劑BNT3213)等不同且新穎的聯合療法研究。
 相比之下,儘管是首次進入BioNTech的重點研發項目名單,但從即將推進的研究佈局來看,Gotistobart的定位絕非對現有IO藥物的簡單補位,而是要成為BioNTech下一代IO治療的核心基石之一。
相比之下,儘管是首次進入BioNTech的重點研發項目名單,但從即將推進的研究佈局來看,Gotistobart的定位絕非對現有IO藥物的簡單補位,而是要成為BioNTech下一代IO治療的核心基石之一。
BioNTech在研發日中明確提出,Gotistobart的研發目標是“探索新的組合以確定潛在的未來治療標準”。Gotistobart的“魅力”在於循環利用的機制以及針對PD-1耐藥人羣的潛力,這為其開展多樣化的聯合治療研究提供了基礎。
從研發日的報告上看,BioNTech計劃圍繞Gotistobart啓動了覆蓋多個癌種、多種聯合模式的研究:開展單藥治療針對二線及以上鱗癌NSCLC患者的3期臨牀試驗,明確單藥治療潛力;開展聯合K藥治療宮頸癌的2期研究,以明確CTLA-4、PD-1的協同效應潛力;還有聯合核藥PLUVICTO治療轉移性去勢抵抗性前列腺癌的早期研究;以及開展覆蓋多種實體瘤的早期臨牀研究,進一步挖掘潛在腫瘤適應症。
其中,與PLUVICTO聯合治療前列腺癌的研究極具看點。2025年ASCO大會公佈的1期研究初步結果顯示,該聯合方案耐受性良好,且臨牀前模型已證實,放射治療能夠選擇性擴增並激活腫瘤微環境中的Tregs,這恰好與Gotistobart的作用機制匹配
此外,Gotistobart與mRNA疫苗BNT116的聯合研究也已啓動,藉助mRNA疫苗引導T細胞向腫瘤抗原特異性分化的能力,結合Gotistobart清除免疫抑制細胞的作用,有望實現更持久的抗腫瘤免疫記憶。
儘管Gotistobart目前還處於早期適應症擴張和驗證階段,但是BioNTech的雙支柱策略已經清晰:Pumitamig通過多靶點協同作用提升免疫治療療效,覆蓋廣泛實體瘤治療需求;Gotistobart目前則聚焦PD-1耐藥以及腫瘤晚期等難治人羣,兩者構成了腫瘤全週期的免疫治療。
/ 03 /CTLA-4值得期待
Gotistobart的進展與BioNTech的戰略佈局只是CTLA-4賽道升温的一個縮影,全球藥企正從分子設計優化、雙抗研發、聯合治療等多個維度挖掘這一靶點的潛力。
在單抗領域,Agenus公司的Botensilimab採用人源化Fc段增強設計,通過強化ADCC效應提升對腫瘤微環境中Tregs的清除效率,與ipilimumab相比,能同時激活先天與適應性免疫系統,尤甚至在冷腫瘤中表現潛力。其在與Balstilimab(PD-1抑制劑)聯合治療微衞星穩定型轉移性結直腸癌患者的2期臨牀中,實現了42%的兩年生存率,平均OS為20.9個月,而對於已經接受過4線或更多治療的患者,BOT/BAL的聯合治療方案可以實現兩年生存率43%,ORR為19%。
國產藥企在CTLA-4靶點的設計同樣表現亮眼,比如和鉑醫藥的HBM4003。作為一款全人源重鏈抗CTLA-4抗體,HBM4003僅有76kDa,小分子的優勢,能夠更高效穿透腫瘤組織,提升腫瘤微環境中的藥物濃度,同時,其Fc段經過突變改造,顯著增強ADCC活性,可精準清除高表達CTLA-4的腫瘤浸潤Tregs。
不久前公佈的2期臨牀數據顯示,在既往接受過多種治療的MSS轉移性結直腸癌患者中,每21天接受HBM4003聯合替雷利珠單抗治療的ORR達34.8%,DCR 60.9%,mPFS為4.2個月,且87.5%的相關不良事件為1、2級,安全性表現優異。
雙抗成為CTLA-4靶點的另一重要研發方向。康方生物的AK104是一款CTLA-4/PD-1雙抗,同時阻斷兩個免疫檢查點,實現協同激活免疫的效應。
儘管熱度低於PD-1/VEGF雙抗依沃西,但公司計劃通過聯合策略挖掘其價值,近期宣佈AK104與依沃西聯用治療術後輔助治療的1期臨牀已完成首例給藥。
阿斯利康的Volrustomig同樣是針對PD-1/CTLA-4的雙抗,目前正在在NSCLC領域的研究正開展頭對頭K藥的3期臨牀eVOLVE-Lung02,進度與實力不容小覷。
聯合治療則持續拓展着CTLA-4的應用邊界。BMS的“Y藥+O藥”組合已在黑色素瘤、NSCLC、腎癌等多個癌種中獲得FDA批准,涉及十餘項適應症;Tremelimumab與O藥的聯合方案已獲批用於NSCLC治療,與O藥+鉑類化療的三聯方案則拓展至前列腺癌一線。
信達生物的IBI310則是國內研發進度領先的CTLA-4抗體,其與PD-1抑制劑信迪利單抗的聯合方案在今年2月被CDE納入優先審批,適應症為可切除的微衞星高度不穩定型或錯配修復缺陷型結直腸癌患者的新輔助治療。
此外,CTLA-4抗體與ADC、核藥、小核酸等新型療法的聯合也是研究方向,BioNTech探索的Gotistobart與核藥PLUVICTO的聯合,不僅是適應症的拓展也是機制的補充,為靶點價值的挖掘開闢了更多可能。
總之,CTLA-4憑藉獨特的免疫調節機制與持續迭代的藥物研發,有望擺脱PD-1的陰影,與多靶點藥物、新型療法形成協同,構建下一代IO治療的基石。
尤其是當PD-1的耐藥及不敏感問題成為免疫治療的核心挑戰之際,CTLA-4則提供了另一條免疫調節途徑。
儘管過程仍充滿挫折和不確定性,但是創新藥的發展,從來都是螺旋上升的。隨着新技術、新機制的出現,以及更多臨牀數據的湧現,那些曾經被否定的藥物,也有可能重新煥發新的光芒。
老靶點的新生,值得期待。