中國科大揭示分子伴侶參與固碳機器羧酶體組裝成熟的分子機制
【環球網科技綜合報道】4月1日消息,據中國科學技術大學官方消息,中國科學技術大學生命科學與醫學部周叢照教授/江永亮副教授課題組聯合中國科學院分子植物科學卓越創新中心米華玲研究員課題組,利用X-射線衍射技術解析了參與藍藻固碳機器羧酶體組裝的分子伴侶CcmS及其與外殼蛋白CcmK1六聚體、CcmK1-CcmK2異六聚體的複合物晶體結構。基於結構和生化分析以及生理實驗,作者鑑定了CcmS在調控β-羧酶體組裝和維持固碳功能方面的作用,為人工設計高效固碳系統提供新的思路。
相關研究成果以“Assembly mechanism of the β-carboxysome shell mediated by the chaperone CcmS”為題於3月24日在線發表於植物學知名期刊New Phytologist上。
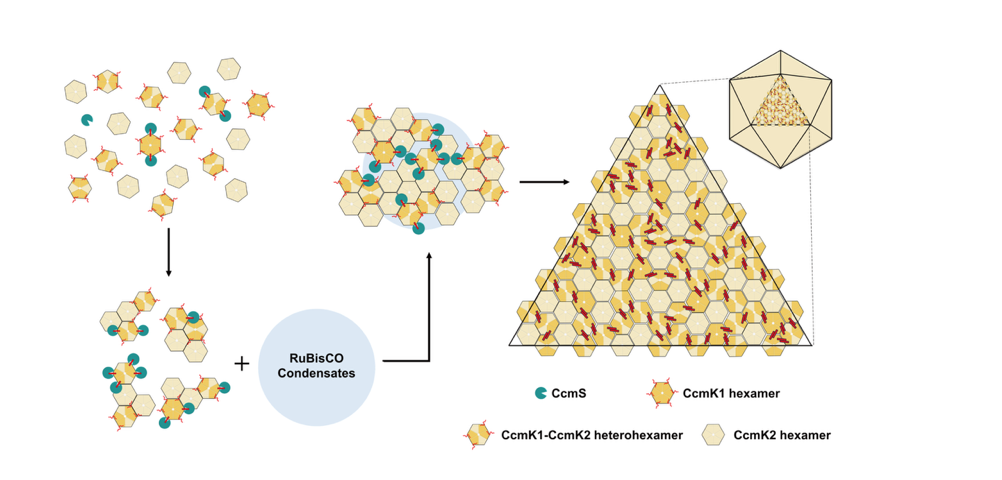
光合作用是地球上最重要的生物化學反應,為幾乎所有生物提供物質和能量,是維持生物圈穩態的基礎。作為地球上最古老的光合自養微生物,藍細菌每年固定CO2的總量約佔全球生物固碳的30%,是地球碳匯的主要貢獻者。藍細菌光合固碳的獨特之處在於,其為應對環境中不斷降低的CO2濃度,進化出CO2濃縮機制(CO2 concentratingmechanism, CCM),通過一系列的轉運體將環境中的無機碳運輸到細胞中,並在固碳機器羧酶體(carboxysome)內高度富集,從而提高固碳酶RuBisCO的催化效率。羧酶體是一種直徑約100~300 nm的正二十面體,由外殼蛋白封裝RuBisCO和碳酸酐酶有序自組裝而成。根據內部被包裹的RuBisCO的種類不同,羧酶體分為α和β兩種類型。其中β-羧酶體的外殼主要由BMC-H家族蛋白CcmK自組裝形成,在模式藍藻Synechocystissp. PCC 6803的β-羧酶體中,BMC-H有4個同源蛋白CcmK1-4,其中CcmK1和CcmK2為主要外殼蛋白,序列一致性超過90%,但與CcmK2相比,CcmK1具有C末端額外8個氨基酸殘基。
此前,中國科學院分子植物科學卓越創新中心米華玲研究員課題組發現一種新的羧酶體蛋白CcmS,其能特異性結合CcmK1的C末端,並且對β-羧酶體的組裝及CCM正常功能至關重要。然而CcmS在β-羧酶體組裝與功能中的具體作用機制尚不明確。
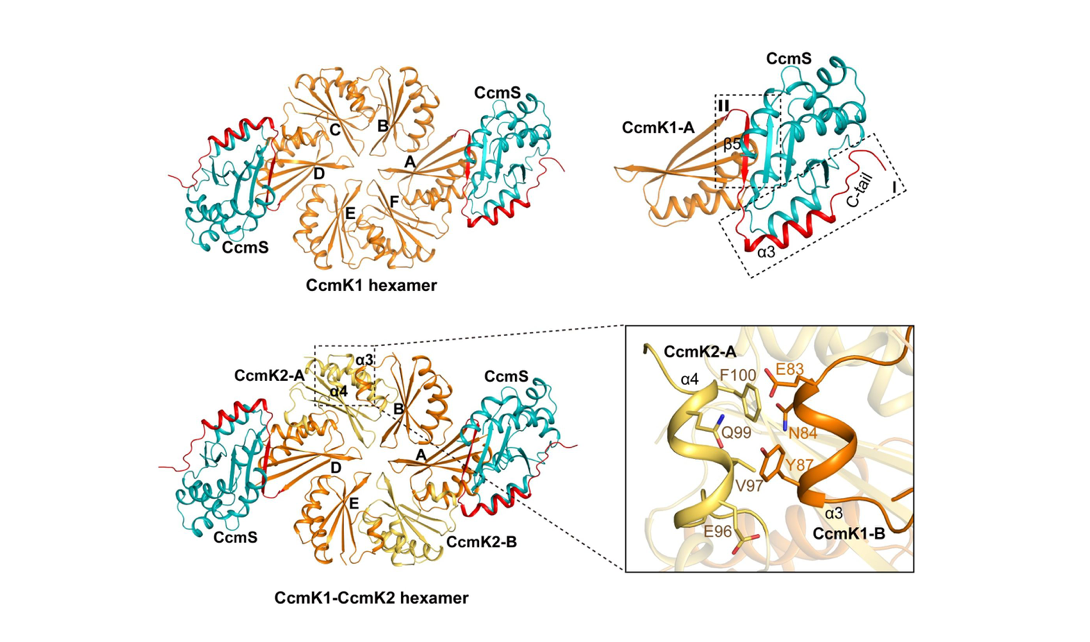
該文報道了藍藻Synechocystissp. PCC 6803的CcmS晶體結構,單體採用α/β摺疊類型。此外,CcmS與兩種BMC-H六聚體(CcmK1同源六聚體和CcmK1-CcmK2異源六聚體)的複合物結構顯示,CcmS以相同模式結合CcmK1的特徵性C末端區域——該區域包含一個兩親性α-螺旋以及C末端的8個氨基酸殘基,科研人員將其命名為鉸鏈(hinge)。CcmS的結合穩定了CcmK1的鉸鏈區域,使其從CcmK1的凹面一側向外延伸,並且與鄰近的CcmK1六聚體的鉸鏈區域形成coiled-coil結構,從而有助於相鄰的多個CcmK1六聚體組裝,促進β-羧酶體外殼的精確組裝。基於前期研究,我們提出了分子伴侶CcmS輔助藍藻β-羧酶體組裝的分子模型:β-羧酶體的RuBisCO與碳酸酐酶在支架蛋白驅動下交聯凝聚形成核心,隨後外殼蛋白CcmK1、CcmK2等自組裝形成外殼包裹核心,最終BMC-P五聚體蛋白封閉頂點形成完整外殼。在組裝過程中,分子伴侶CcmS穩定CcmK1的鉸鏈區域,使其向外突出並進一步穩定相鄰CcmK同/異源六聚體的互作界面,並且精準調控β-羧酶體的形態與大小。(青山)