中國科學家破譯人體衰老的蛋白密碼
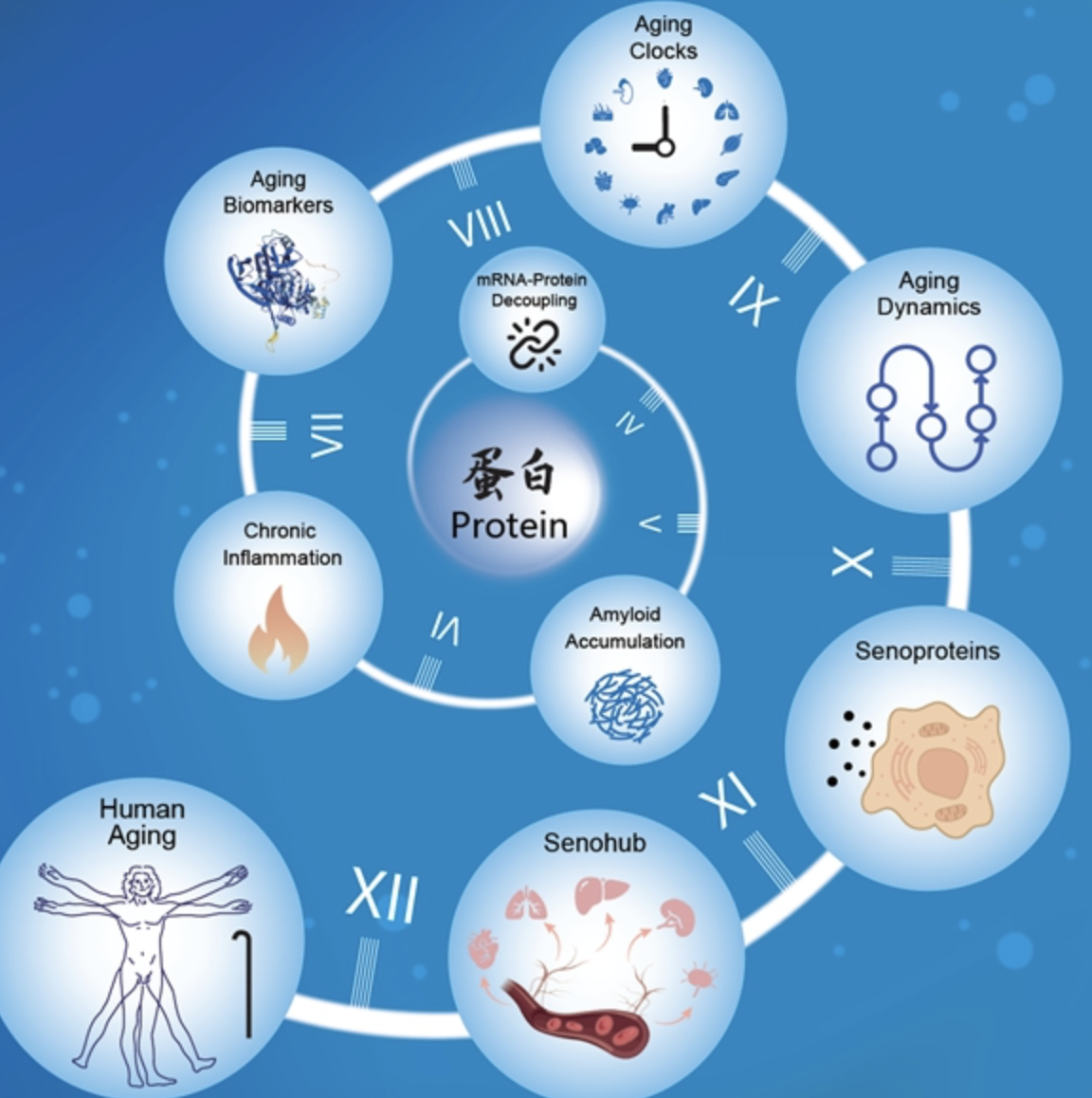
【環球網科技綜合報道】7月29日消息,根據中國科學院官網信息,中國科學院動物研究所研究員劉光慧、北京基因組研究所(國家生物信息中心)研究員張維綺、動物研究所研究員曲靜與四川大學華西醫院教授楊家印合作團隊,首次融合超高靈敏度質譜技術與機器學習算法,系統構建了橫跨人類50年生命週期的蛋白質組衰老圖譜,涵蓋七大生理系統、13種關鍵組織,從蛋白視角呈現了機體增齡性演變的全景式動態景觀。
據悉,近日,相關研究成果以“Comprehensive Human Proteome Profiles Across a 50-Year Lifespan Reveal Aging Trajectories and Signatures”為題發表在《細胞》(Cell)上。
資料顯示,衰老作為一項涉及多器官、跨越多重生物學層級的機體系統性退行性演變,其深層的分子機制至今仍是生命科學領域懸而未決的核心命題。我們的各器官系統是否遵循統一的衰老節律?是否存在調控系統衰老的分子時空樞紐?這些問題長期以來缺乏系統性的實證解答。
當前,科學共識指出,蛋白質穩態的失衡是衰老進程中標誌性的分子特徵之一。人類基因組編碼的超兩萬種蛋白質,作為細胞結構的基石,其構成的動態網絡精密調控着生理穩態,是一系列生命活動的核心執行者。因此,系統繪製跨越生命週期的蛋白質組動態全景圖譜,解析器官及系統尺度下蛋白質網絡的重編程規律,對於精準識別衰老的核心驅動因素並確立干預靶標具有重要意義。
上述“人體衰老蛋白質分子編年史”揭示,蛋白質信息流紊亂是器官衰老的核心特徵之一,其本質在於mRNA-蛋白質解偶聯與病理性澱粉樣沉積的協同作用導致蛋白質穩態網絡的系統性崩解。同時,研究首次確立血管系統為衰老進程的“先鋒組織”,其在生命早期即顯著偏離穩態軌跡。衰老的血管系統通過特異性分泌GAS6等促衰蛋白,激活跨器官級聯信號網絡,發揮“衰老樞紐”的核心調控功能,驅動並放大全身多器官的系統性衰老進程。
蛋白質穩態調控網絡作為維繫細胞功能的核心精密調控軸,統籌蛋白質合成、摺疊、修飾、轉運與降解等關鍵生命過程。該團隊首次在人類多組織層面確證,衰老伴隨系統性蛋白質穩態失衡,其核心表徵為:中心法則信息流斷裂——表現為mRNA與蛋白質丰度相關性隨增齡顯著解偶聯,導致遺傳信息向功能性蛋白的精準轉化普遍受阻;蛋白質量控制系統級聯衰減——核糖體蛋白、分子伴侶及蛋白酶體亞基呈現跨組織普遍性下調,提示合成、摺疊與降解通路的協同失能;病理性蛋白廣泛沉積——澱粉樣蛋白、免疫球蛋白及補體成分在衰老組織中異常累積並交互作用,形成促炎性的“澱粉樣-免疫球蛋白-補體”網絡,構成炎症性衰老的分子基石。尤為顯著的是,血清澱粉樣蛋白P被鑑定為最具跨組織保守性的“泛組織年齡上調蛋白”,在大多數衰老組織中一致性顯著升高;體外功能研究證實,其可損害年輕血管內皮細胞功能,誘導衰老表型及促炎因子表達,提示其作為驅動早期衰老的功能獲得性信號分子的核心作用。
基於前沿人工智能算法,該團隊構建了覆蓋13種人類組織的特異性“蛋白質組衰老時鐘”,首次在蛋白質時空維度,解析了器官衰老的顯著異質性及其動態架構。深度分析發現,30歲左右為衰老軌跡的初始分水嶺——腎上腺組織率先呈現衰老特徵,提示內分泌穩態失衡或為早期驅動力;同期主動脈亦出現穩態偏移,進一步印證了它作為“衰老哨兵”的先鋒定位。45歲至55歲被確認為衰老進程的里程碑式轉折點,大多數器官蛋白質組在此階段經歷“分子級聯風暴”,差異表達蛋白呈爆發性激增,標誌其成為多器官系統性衰老的關鍵生物學轉變窗口。主動脈蛋白質組在此過程中的重塑最為劇烈,其分泌組與循環血漿蛋白質組動態譜呈現強共演變特徵,提示衰老相關分泌因子可能是介導衰老信號系統性傳播的樞紐機制。
為驗證“血管衰老中樞”假説,該團隊鎖定關鍵衰老相關分泌因子展開功能解析。團隊發現,代表性範例GAS6在衰老主動脈組織及循環系統中呈現跨尺度顯著富集。體外功能研究證實,GAS6可直接驅動人類血管內皮細胞與平滑肌細胞衰老表型。動物模型進一步揭示,外源系統性給予GAS6顯著加速中年小鼠運動功能衰退及多器官衰老進程。類似地,GPNMB、COMP、HTRA1、IGFBP7等衰老相關分泌因子亦被證實可直接誘導血管細胞衰老。其中,外源注射GPNMB,模擬衰老血液GPNMB的累積,可重現系統性加速衰老表型。這些多維度、跨物種的因果性證據在機制層面確證了“衰老擴散”理論的核心原則,即局部衰老組織通過特異性分泌因子,驅動遠端器官衰老級聯,從而將衰老研究的範式從聚焦傳統的“細胞內分子機制”拓展至“器官間通訊網絡”的系統維度。
據瞭解,這一研究整合蛋白質組大數據、人工智能建模與多維度功能驗證,首次提出“蛋白質穩態失衡-血管衰老樞紐”模型,為系統性衰老機制提供了新範式。(青雲)