眼藥水召回2023年和感染是由於缺乏FDA監管 - 彭博報道
Peter Robison, Priyanka Pulla
 攝影師:Ina Jang for Bloomberg Businessweek銅綠假單胞菌是一種長度僅為幾分之一毫米的桿狀細菌。在培養皿中,它散發着玉米玉米餅的氣味。它是一種機會主義者,侵入任何已經受損的組織,並且可能致命:在特別脆弱的人羣中, 死亡率可能高達50%。但也許這種細菌最顯著的特徵是它有多難以殺死。最頑強的銅綠假單胞菌是抗生素耐藥的超級細菌,無論醫生使用什麼藥物,它們都會繼續肆虐。
攝影師:Ina Jang for Bloomberg Businessweek銅綠假單胞菌是一種長度僅為幾分之一毫米的桿狀細菌。在培養皿中,它散發着玉米玉米餅的氣味。它是一種機會主義者,侵入任何已經受損的組織,並且可能致命:在特別脆弱的人羣中, 死亡率可能高達50%。但也許這種細菌最顯著的特徵是它有多難以殺死。最頑強的銅綠假單胞菌是抗生素耐藥的超級細菌,無論醫生使用什麼藥物,它們都會繼續肆虐。
 2022年5月,一種異常兇猛的菌株首次出現在美國,出現在洛杉磯的一名醫院患者身上。整個夏天,又出現了三起本地病例。隨着醫生們試圖對抗這種細菌,疾病控制和預防中心開始跟蹤它,審查患者共同擁有的每個地點和物品。銅綠假單胞菌甚至可以在從未接觸過原始來源的人羣中傳播。這種細菌出現在康涅狄克州,然後是猶他州。它出現在人們的肺部和血液中。機構花了八個月的時間 確定罪魁禍首:非處方眼藥水。這兩個受影響的品牌在價格不到知名品牌的一半的情況下廣泛銷售。它們不是假冒的。它們沒有非法進口。它們是在印度生產的,並由兩家美國經銷商銷售,盒子上印有食品和藥物管理局發放的藥物庫存編號。
2022年5月,一種異常兇猛的菌株首次出現在美國,出現在洛杉磯的一名醫院患者身上。整個夏天,又出現了三起本地病例。隨着醫生們試圖對抗這種細菌,疾病控制和預防中心開始跟蹤它,審查患者共同擁有的每個地點和物品。銅綠假單胞菌甚至可以在從未接觸過原始來源的人羣中傳播。這種細菌出現在康涅狄克州,然後是猶他州。它出現在人們的肺部和血液中。機構花了八個月的時間 確定罪魁禍首:非處方眼藥水。這兩個受影響的品牌在價格不到知名品牌的一半的情況下廣泛銷售。它們不是假冒的。它們沒有非法進口。它們是在印度生產的,並由兩家美國經銷商銷售,盒子上印有食品和藥物管理局發放的藥物庫存編號。
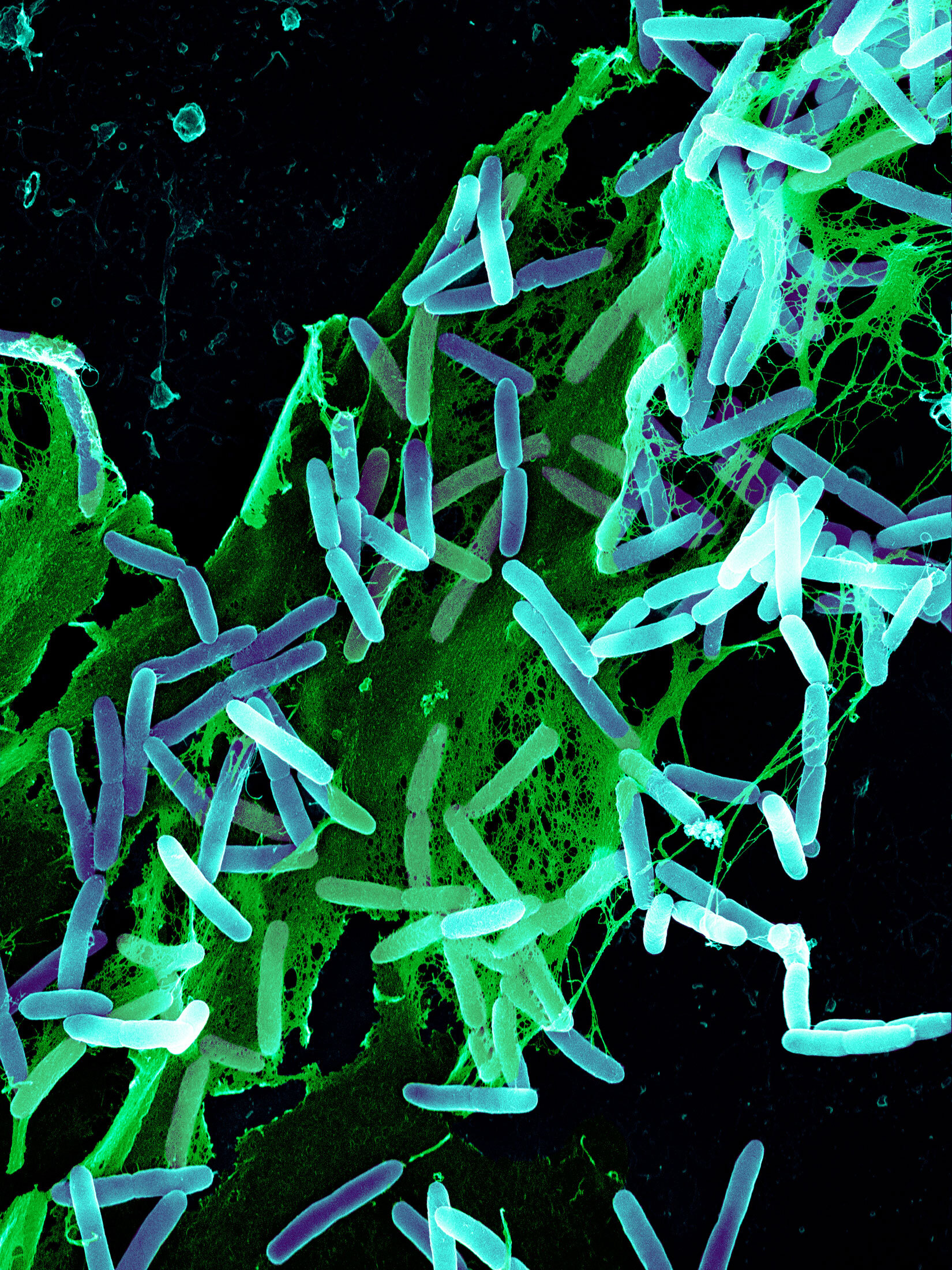 銅綠假單胞菌細菌(藍色),被白細胞吞噬。來源:科學圖片庫/科學來源 EzriCare LLC和Delsam Pharma LLC的眼藥水在銅綠假單胞菌導致四人死亡、18人視力喪失和大量感染後被召回。具體情況令人震驚。有四人細菌傳播得如此之快,以至於醫生不得不切除他們的眼球以阻止細菌蔓延。其他人的角膜變成了混濁的膿腫疤痕。一些人忍受着偏頭痛、眼睛分泌物和光敏感,使他們在黑暗中度過了數天甚至數月。
銅綠假單胞菌細菌(藍色),被白細胞吞噬。來源:科學圖片庫/科學來源 EzriCare LLC和Delsam Pharma LLC的眼藥水在銅綠假單胞菌導致四人死亡、18人視力喪失和大量感染後被召回。具體情況令人震驚。有四人細菌傳播得如此之快,以至於醫生不得不切除他們的眼球以阻止細菌蔓延。其他人的角膜變成了混濁的膿腫疤痕。一些人忍受着偏頭痛、眼睛分泌物和光敏感,使他們在黑暗中度過了數天甚至數月。
導致疫情爆發的原因是FDA對非處方藥監管存在嚴重漏洞。長期以來,這些藥物一直是該機構的最低優先級之一——假設即使它們不起作用,也可能不會致人死亡。這些藥物基本上是在誠信制度下生產和銷售的。公司不必向機構證明其藥物是安全有效的,或者正在符合良好的生產條件。沒有涉及測試;也不需要檢查。公司只需聲明正在使用批准的成分並遵守良好的生產規範。基本上,只是一些文書工作。
事實證明,這些受污染的眼藥水是由兩位經驗不足的企業家銷售的,他們互不相識,但找到了同一家位於印度金奈的小公司來生產這種據稱是無菌的藥物。Ezriel Green是新澤西州的批發藥品經銷商;Kuppusamy Arumugam是紐約布朗克斯的藥劑師。在眼藥水之前,他們都從未銷售過自己的藥物。記錄顯示,他們的製造商,Global Pharma Healthcare Pvt Ltd.,從未向美國出口過任何藥物。眼藥水必須保證無菌,這是一個嚴格且昂貴的過程。Global Pharma被允許運送數十萬瓶眼藥水,而無需FDA檢查其工廠。
眼藥水被宣傳為不含防腐劑。但這意味着它們也缺乏防止細菌生長的化學物質。大多數製造商只在單次使用的小瓶或專門設計的多次使用瓶中銷售這種眼藥水,以保持無菌狀態。這兩種方式成本更高。Global Pharma的無防腐劑眼藥水裝在常規、更便宜的瓶子中,含有多劑。
美國食品藥品監督管理局(FDA)用於列出非處方藥的自動化流程沒有標記出這個關鍵缺陷。它也沒有發現其他警告信號:製造商和分銷商的背景不夠實質。FDA發言人傑里米·卡恩表示,該機構會停用不符合要求的列出,並正在努力改進監測方式。他表示,該機構的“最高優先事項是保護公共健康”,包括推薦和協調自願召回、發送公共通知、檢查和與公司進行討論。至於受污染的眼藥水,他表示該機構正在監控情況。
仿製藥行業已經遍佈全球以生產廉價藥物。監管機構沒有跟上:在一些地方規則沒有得到執行,在其他地方規則不足。結果是短缺、召回和健康風險。美國食品藥品監督管理局在2022年宣佈了900多次召回,是四年前的三倍。印度,佔全球仿製藥供應的五分之一,因質量問題受到越來越多的關注。例如,仿製癌症藥物的生產失誤導致今年出現了可能拯救生命的治療藥物短缺,讓患者等待。世界衞生組織將去年岡比亞60多名兒童的死亡與印度生產的有毒藥水聯繫起來。
 Global Pharma在金奈附近的工廠。攝影師:Priyanka Pulla印度政府激烈捍衞其出口強國地位。他們中斷了對藥水中毒素來源的調查。當地官員也為Global Pharma辯護。這種立場以及全球供應鏈中最常見藥物的監管漏洞正在危害全球人民。
Global Pharma在金奈附近的工廠。攝影師:Priyanka Pulla印度政府激烈捍衞其出口強國地位。他們中斷了對藥水中毒素來源的調查。當地官員也為Global Pharma辯護。這種立場以及全球供應鏈中最常見藥物的監管漏洞正在危害全球人民。
當FDA檢查員最終於二月進入Global Pharma的無菌加工設施時,他們發現灌裝機中有棕色殘留物,未經培訓的工人穿着髒兮兮、重複使用的鞋套。那時,Global Pharma已自願召回其眼藥水。FDA檢測了未打開的EzriCare眼藥水瓶,發現其中被細菌污染,但尚未明確識別細菌或其來源。Global Pharma表示他們沒有責任。
“美國公眾應該知道,沒有人在關注這個問題。FDA沒有資源來做這件事並不是他們的錯。但他們不應該假裝他們能夠做到。”
Kuppusamy Arumugam於1977年從印度移民後獲得了他的藥劑師執照。如今,他在布朗克斯經營Farmacia Central。這是一家狹窄的商店,陳列着各種通用藥品,就像紐約的一家小雜貨店,還有家庭日用品。Ezriel Green在布魯克林長大,在一所猶太教學院獲得了猶太法研究碩士學位,然後從事商業——首先銷售血糖試紙,然後是冷切肉類。2016年,他創立了EzriRx,一家在線批發藥品分銷商,四年後,成立了EzriCare,以自己的品牌名稱分銷藥品。
詢問他們是如何在2020年內相繼銷售由同一製造商製造的成分相同的眼藥水的,而這些解釋引發了許多問題。
Arumugam在2020年7月開始推廣他的眼藥水,正值新冠疫情早期。一些藥物供應短缺,一些被囤積,但他表示他並沒有考慮這些。他提供了幾個關於他進入這個行業的版本,其中一個版本是因為有一個客户拖欠了他訂購的眼藥水,而所有版本的結局都是他通過印度的一名顧問與Global Pharma取得聯繫。在另一名顧問的幫助下,他通過FDA的電子清單系統註冊了Delsam Pharma的人工淚液。標籤描述它們與暢銷品牌Refresh Plus相似,不含防腐劑,以單次使用小瓶銷售。四個月後,Green的公司也使用顧問註冊了成分相同、描述方式相同的EzriCare人工淚液。Green的律師表示,他依賴Global Pharma和一名中間人,後者去年去世,其公司今年宣佈破產,來處理一切,現在他知道相信他們是錯誤的。“EzriCare對最近有報道的毒性、破壞性眼部感染受影響的個人表示哀悼,”律師Rick Lauer在一封電子郵件中寫道。
 2019年的綠色。攝影師:道格·胡德/美國今日網絡這些是全球製藥公司眼藥水在美國的不太可能的分銷商,能夠開始銷售一種敏感產品,而沒有人詢問他們關於其安全性的任何問題。
2019年的綠色。攝影師:道格·胡德/美國今日網絡這些是全球製藥公司眼藥水在美國的不太可能的分銷商,能夠開始銷售一種敏感產品,而沒有人詢問他們關於其安全性的任何問題。
當前的OTC系統可以追溯到1972年,當時FDA意識到需要一種更有效的方式來跟上所有生產的非處方藥,包括止痛藥、藥膏和止咳糖漿。為了制定OTC產品的標準,FDA邀請專家為每個類別推薦安全的成分;他們創建的專論就像食譜書。但是,討論需要數年,有時甚至幾十年。 眼藥水的專論最終於1988年完成,就像是美國商業的另一個時代的時光膠囊,提到了早已關閉或轉移到海外的國內製造商。
FDA的自動化系統對EzriCare和Delsam Pharma列出他們的眼藥水只有幾個基本要求:藥品名稱;劑量;成分;以及標籤的圖像,包括有關使用和警告的信息,這些信息通常隨每種藥物提供。然後,每種產品被分配一個獨特的國家藥物代碼,出現在國家衞生研究院維護的在線醫學圖書館中。全球製藥註冊為他們的製造商。就是這樣。
對於那些願意查看的人,列表上有一個免責聲明,清楚地説明FDA尚未批准或審查該藥物。但公司並不需要在他們的廣告中包含這一信息,而且通常會找到方式暗示完全相反。
聯繫我們
彭博調查正在調查藥品質量。 *如果您在這個行業工作,或者有信息可以幫助我們進行持續報道,請發送電子郵件至:*[email protected]
進入美國市場對全球製藥公司來説是一件大事。該公司成立於1986年,由文卡特什·拉真德蘭(Venkatesh Rajendran)領導,他曾接受過醫生培訓,被同行描述為温和且受歡迎。拉真德蘭也有着廣泛的人脈:直到去年,他還是印度商務部設立的一個頂級委員會Pharmexcil的成員,該委員會是一個有影響力的貿易團體,旨在促進藥品出口。儘管如此,全球製藥並不是印度500億美元藥品行業的核心。幾十年來,該公司向東南亞和非洲約兩打個國家銷售藥品;其產品包括注射用抗生素和眼藥水,這兩者都需要無菌生產。瞭解拉真德蘭的人表示,進入美國市場的一個吸引點是有潛力以更高的利潤銷售大量產品。根據其最近的年度報告,該公司的收入在過去五年中增長了近50%,但仍然只有6.74億盧比(820萬美元)。
該公司的工廠位於欽奈郊外的一個製藥園區,這是泰米爾納德邦唯一的一個製藥園區。根據三位熟悉全球製藥的人士的説法,他們不願透露身份以保護與該公司和印度監管機構的關係,該設施被認為適用於他們所稱的“半規範”或“較低規範”的市場,這些市場的測試和檢查要求低於美國或歐洲。其中一位大約五年前參觀過全球製藥運營的人將其描述為尚可,但僅“足夠滿足第三世界的要求”。拉真德蘭拒絕回應這些描述,也不回答有關工廠當前狀況的問題。
全球製藥公司在2021年1月向Arumugam的公司發送了10萬瓶人工眼淚,根據追蹤全球航運數據的公司ImportGenius。另外在2021年9月和2022年5月,幾乎有50萬瓶被送到了EzriCare的進口商那裏。
Green特別為他公司的包裝感到自豪。“我們的理念是,價格便宜的優質非處方藥也應該看起來不錯,”Green在去年的LinkedIn帖子中寫道。
即使在美國沒有對大多數非處方藥進行審查,也有辦法後續跟蹤問題。印度等許多國家缺乏報告機制和監測網絡來證明某種藥物導致死亡或疾病,印度最大的仿製藥生產商之一Dr. Reddy’s Laboratories Ltd.的全球質量主管Ganadhish Kamat在2021年退休時表示。“當有人死亡時,人們會説,‘天意’—‘這是上帝的意願’—或者‘出了什麼問題。反正他已經老了,’”他説。“而在美國,他們會追蹤歷史和不良事件。他們會嘗試將其與某種藥物聯繫起來。”
 Renee Martray因假單胞菌感染導致右眼視力模糊。攝影師:Kathleen Robbins,彭博商業週刊2022年5月,洛杉磯縣一家醫院出現了第一位眼睛發炎、流出黃膿的患者。醫院確定眼睛感染了一種對抗生素高度耐藥的假單胞菌菌株,並將其報告給當地衞生官員。到8月,另外三個最近去過同一眼科醫生處的人也被感染。洛杉磯縣官員致函CDC的抗菌耐藥團隊負責人Maroya Walters。 機構估計,耐藥細菌每年在美國造成280萬感染和多達3.5萬死亡。“這聽起來像是一項有趣且不尋常的調查,”她回覆道,敦促他們審查患者的病史以及是否曾出國旅行。洛杉磯縣官員調查了眼科醫生辦公室的壓力計或其他設備是否被污染。
Renee Martray因假單胞菌感染導致右眼視力模糊。攝影師:Kathleen Robbins,彭博商業週刊2022年5月,洛杉磯縣一家醫院出現了第一位眼睛發炎、流出黃膿的患者。醫院確定眼睛感染了一種對抗生素高度耐藥的假單胞菌菌株,並將其報告給當地衞生官員。到8月,另外三個最近去過同一眼科醫生處的人也被感染。洛杉磯縣官員致函CDC的抗菌耐藥團隊負責人Maroya Walters。 機構估計,耐藥細菌每年在美國造成280萬感染和多達3.5萬死亡。“這聽起來像是一項有趣且不尋常的調查,”她回覆道,敦促他們審查患者的病史以及是否曾出國旅行。洛杉磯縣官員調查了眼科醫生辦公室的壓力計或其他設備是否被污染。
那個夏天,疾控中心還得知猶他州和康涅狄格州的養老院有30多人感染了銅綠假單胞菌。大多數人沒有顯示任何症狀;這種細菌是在例行篩查中被檢測出來的。其他人的肺部或痰中有這種細菌,而不是眼睛。
沃爾特斯和她的疾控中心工作人員最初猜想這些病例與每個地方都去過的醫護人員或患者有關。對醫療記錄的審查排除了這種可能性。9月,一名70多歲的男子在華盛頓州的醫院住院期間死於血流感染。四個州的感染病例表明,傳播的銅綠假單胞菌來自同一種產品。
疾控中心團隊開始費力地收集患者使用過的每種產品的品牌名稱、批號和製造商。沃爾特斯考慮到問題甚至可能是一個常見的成分。2022年3月,在挪威,至少有七人死於另一種銅綠假單胞菌菌株,這與一家英國製造商生產的受污染的預濕毛巾有關。她和她的工作人員詢問了濕巾、乳霜、洗液、藥膏、沐浴產品、瀉藥和眼藥水。沒有一個產品引人注目。僅就人工淚液而言,他們記錄了使用了十多個品牌。然後,在11月初,他們得知了一起在邁阿密巴斯康·帕爾默眼科研究所困擾醫生數月的罕見的耐藥感染簇。
該研究所每年看到多達一千例嚴重的角膜感染病例,該所的專家之一Guillermo Amescua説。通常,他們可以找到一些藥物組合來治療這些感染。但對於這些感染,他們卻束手無策。
退休的化妝師克拉拉·奧利瓦(Clara Oliva)於八月份來到醫院,右眼淚流滿面且腫脹。那是她的好眼睛;她的左眼從小視力就很差。醫生進行了一種用光和化學物質殺滅細菌的治療。他們嘗試了抗真菌藥物。他們插入針頭從眼睛排出液體。但都沒有奏效。每次奧利瓦回來時,角膜上的膿腫都在增長。到了九月,醫生擔心感染會蔓延到她的全身,於是用塑料植入物替換了她的右眼。現在,奧利瓦合法失明,搬到了一個兒子那裏,兒子幫助照顧她。
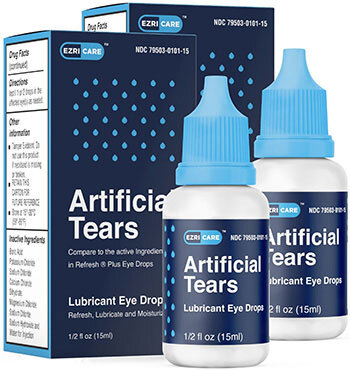 EzriCare人工眼淚。那年夏天,南卡羅來納州萊剋星頓的行政助理雷妮·馬特雷(Renee Martray)和她的未婚夫準備去賓夕法尼亞州露營。他忘記帶手電筒,她忘記帶眼藥水。她在路上買了一些EzriCare人工眼淚。她之前從未聽説過EzriCare,也沒有太在意標籤,只看價格。“我從來沒有考慮過品牌名稱,”馬特雷説。“現在我想到了。”他們回家幾天後,她的右眼變紅腫,未婚夫敦促她去看醫生。抗生素有所幫助。沒有人懷疑EzriCare眼藥水可能有問題,所以她繼續使用。到了十二月,她的眼睛開始灼燒。這一次,疼痛和腫脹很難治療。她説她被診斷為感染了同一種假單胞菌。角膜瘢痕最終使她的右眼變得模糊,導致頭痛和感覺就像透過一扇弄髒的窗户看東西。她不得不辭去工作,她説很難離開家。
EzriCare人工眼淚。那年夏天,南卡羅來納州萊剋星頓的行政助理雷妮·馬特雷(Renee Martray)和她的未婚夫準備去賓夕法尼亞州露營。他忘記帶手電筒,她忘記帶眼藥水。她在路上買了一些EzriCare人工眼淚。她之前從未聽説過EzriCare,也沒有太在意標籤,只看價格。“我從來沒有考慮過品牌名稱,”馬特雷説。“現在我想到了。”他們回家幾天後,她的右眼變紅腫,未婚夫敦促她去看醫生。抗生素有所幫助。沒有人懷疑EzriCare眼藥水可能有問題,所以她繼續使用。到了十二月,她的眼睛開始灼燒。這一次,疼痛和腫脹很難治療。她説她被診斷為感染了同一種假單胞菌。角膜瘢痕最終使她的右眼變得模糊,導致頭痛和感覺就像透過一扇弄髒的窗户看東西。她不得不辭去工作,她説很難離開家。
到年底,康涅狄格州的CDC調查員取得了突破,開始測試養老院剩餘的開瓶眼藥水。一月份的初步結果顯示,在兩個州的七瓶EzriCare開瓶眼藥水中發現了耐藥細菌,CDC尚未公佈這兩個州的名稱。CDC在1月20日向醫生髮布了一份公告,敦促他們立即停止使用EzriCare人工眼淚。
北卡羅來納州的眼科醫生桑德拉·布朗在美國眼科學會的一封電子郵件中看到了這則通知。布朗還是西雅圖外的非營利組織乾眼基金會的董事會成員,該組織發佈了有關眼藥水安全建議。EzriCare多次使用瓶本身就是布朗發現問題的第一個跡象。她説,這個瓶子做得太便宜了,甚至沒有尖端的穿孔。它更像是一瓶超級膠水:瓶蓋內部有一個尖牙,人們可以用來自己打孔。布朗想知道這個尖牙是否可能是污染的源頭。
她對CDC選擇以如此低調的方式發送這個看似如此重要的通知感到驚訝。她和基金會主席麗貝卡·佩特里斯繼續發出了自己的警報。他們在1月23日發佈了一段視頻,描述了包裝上的缺陷可能違反了一項聯邦法律,該法律要求在多劑量瓶中出售的眼藥水必須使用適當的防腐劑或包裝,以最大程度地減少污染風險。
 佩特里斯在她的乾眼商店儲藏室裏。攝影師:Chona Kasinger,彭博商業週刊EzriCare的律師回覆基金會的一封停止和撤回信,基金會隨後撤下了視頻。當時,Arumugam説,有人(他不記得是誰)給他轉發了一封關於“某個眼科基金會某人”擔憂的電子郵件。儘管他認為自己的眼藥水是安全的,而且尚未與任何感染聯繫在一起,但他還是將自己的產品從市場上撤下。“我不想惹上法律問題,”他説。“我決定最好不賣任何東西。”一週後,他説,FDA的一名官員打電話給他。Arumugam被告知Global Pharma已同意自願召回Delsam Pharma的人工淚液和EzriCare的產品。
佩特里斯在她的乾眼商店儲藏室裏。攝影師:Chona Kasinger,彭博商業週刊EzriCare的律師回覆基金會的一封停止和撤回信,基金會隨後撤下了視頻。當時,Arumugam説,有人(他不記得是誰)給他轉發了一封關於“某個眼科基金會某人”擔憂的電子郵件。儘管他認為自己的眼藥水是安全的,而且尚未與任何感染聯繫在一起,但他還是將自己的產品從市場上撤下。“我不想惹上法律問題,”他説。“我決定最好不賣任何東西。”一週後,他説,FDA的一名官員打電話給他。Arumugam被告知Global Pharma已同意自願召回Delsam Pharma的人工淚液和EzriCare的產品。
巧合的是,就在幾周前,該機構已禁止了來自Global Pharma的所有進口產品。該公司還生產止咳糖漿,這種藥物因岡比亞兒童死亡而受到懷疑。該公司與這些案例無關。但FDA正在調查所有來自其所謂的“關注地區”的製造商,而該公司對其記錄的請求未作出充分回應。
關於Global Pharma製造的所有未過期產品的眼藥水召回的公告於2月2日發佈。如果FDA官員對於一個小型非營利組織如何比他們更快地警告公眾有任何想法,那麼沒有人透露。
Petris對可怕的眼部感染特別有同感。她在2005年接受了Lasik手術後,視力減退,眼睛乾澀和慢性疼痛。她於2018年成立了Dry Eye Foundation,專注於患者倡導,並邀請Brown,一直在醫療問題上為她提供建議的人,加入董事會。
最近,Petris一直在收集看起來可能不安全的眼藥水。她發現並向FDA投訴的數十個品牌中,許多仍然可以在Amazon.com、Walmart或兩者都有售。Petris和Brown一直在呼籲該機構不僅要打擊有問題的品牌,還要修復允許它們進入市場的系統缺陷。
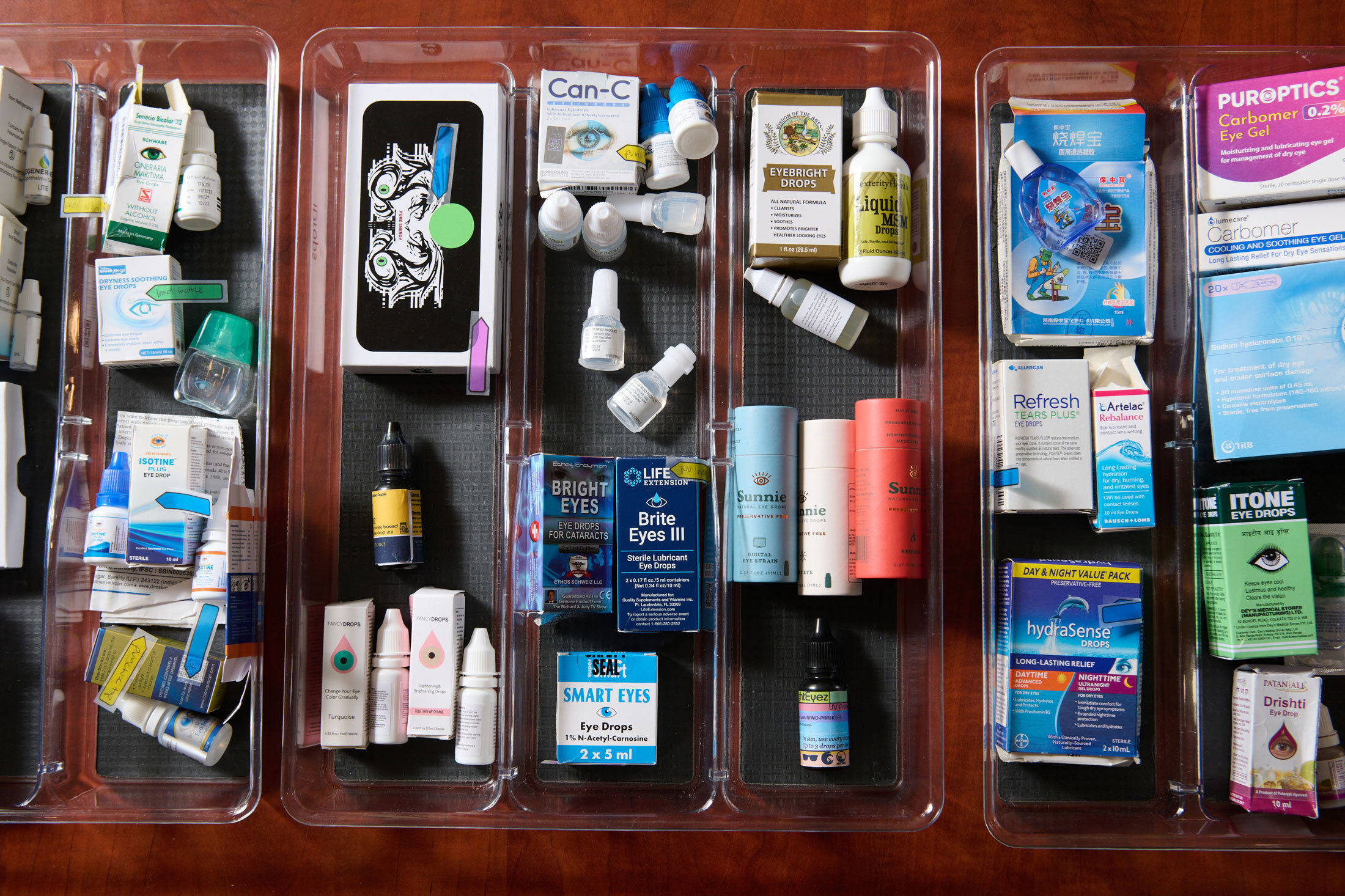 Petris的可疑眼藥水收藏。攝影師:Chona Kasinger,彭博商業週刊甚至在大流行病造成大量積壓之前,FDA就一直在努力檢查製造工廠,特別是海外工廠。有些甚至沒有向該機構註冊。根據健康分析公司Pharm3r LLC的數據,自2015年以來,FDA僅檢查了註冊用於OTC產品的設施的52%,以及製造處方藥的設施的53%。OTC設施之間的檢查平均間隔為兩年半。
Petris的可疑眼藥水收藏。攝影師:Chona Kasinger,彭博商業週刊甚至在大流行病造成大量積壓之前,FDA就一直在努力檢查製造工廠,特別是海外工廠。有些甚至沒有向該機構註冊。根據健康分析公司Pharm3r LLC的數據,自2015年以來,FDA僅檢查了註冊用於OTC產品的設施的52%,以及製造處方藥的設施的53%。OTC設施之間的檢查平均間隔為兩年半。
2月20日,FDA來到了靠近金奈的Global Pharma工廠,兩名檢查員進行了將近兩週的審查。他們的14頁報告揭示瞭如此多的缺陷,以至於英國無菌製造專家Tim Sandle稱之為他見過的最長之一。他説,這是“一個薄弱的質量文化”跡象。
無菌加工需要特殊的房間,其中空氣流動是單向的,並經過過濾,以便微粒不會沉積在任何地方。前往美國的Global Pharma批次來自一個聽起來適合家庭翻新真人秀的房間;牆上露出釘子,密封膠開裂。當檢查員在灌裝機的碗周圍擦拭布時,它擦出了褐色的油膩沉積物。
一些重要職位的員工尚未接受培訓。一名質量保證經理發佈了帶有預先填寫清單的批次。Global Pharma尚未確定用於滅菌溶液的過濾器的有效性。
在支持Brown理論的一個部分中,報告指出Global Pharma從一家未透露的供應商購買了瓶蓋,並未對其進行無菌測試。也沒有對容器的密封系統進行任何測試,而是依靠目視檢查是否有泄漏。Rajendran沒有同意接受本文的採訪,但在WhatsApp交流中,他説“忘記所有瓶子”,重申FDA對封閉眼藥水瓶進行的測試並未發現假單胞菌污染。(這些測試顯示了尚未完全確定的細菌污染。)他説他的公司正在與FDA合作,“他們也對我們的行動做出了回應和反應。”否則,他拒絕置評。
“美國公眾應該知道沒有人在關注,”斯坦福大學醫學院的教授凱文·舒爾曼説。“FDA沒有足夠的資源來做到這一點並不是他們的錯。但他們不應該假裝他們可以。”他説,試圖監控全球使用幾代前設計的國內市場檢查程序是不現實的,國內市場可以輕鬆完成未經通知的審查。
FDA也沒有足夠的資源進行足夠的測試。“他們偏離了他們保證瓶子裏的東西實際上在瓶子裏的基本使命,”前FDA官員大衞·戈特勒説。他認為FDA應該在藥物進入該國之前測試每一批;如果機構無法支付,進口商應該支付。藥品購買者——零售商、批發商、藥店——也可以測試他們購買的藥品,儘管FDA已經反對這樣做,稱這些結果可能不可靠。
對於眼藥水造成的所有傷害,如果超級細菌在其他類型的非處方藥中未被發現,那麼造成的傷害可能會更嚴重,華盛頓州立大學傳染病流行病學家埃裏克·洛夫格倫表示。與眼藥水一樣,可能需要數月時間才能追蹤到來源。“你不會看到一個標題説今天有成千上萬人死亡,”洛夫格倫説。“只是每個人,到處都會變得稍微不那麼安全。”
 美人魚眼淚的包裝,這是布朗和佩特里斯製造的一個虛假眼藥水,用於測試FDA。來源:NIH美國食品藥品監督管理局藥物評價與研究中心主任帕特里齊亞·卡瓦佐尼在四月份向一家遊説團體做報告時承認“我們在確保非處方藥品質量方面存在一些漏洞”。拜登政府最新的預算請求包括一個機構提案,將解決眼藥水召回中確定的主要缺陷之一:要求首次生產非處方產品的製造商在銷售前提前六個月通知FDA,可能允許進行檢查。
美人魚眼淚的包裝,這是布朗和佩特里斯製造的一個虛假眼藥水,用於測試FDA。來源:NIH美國食品藥品監督管理局藥物評價與研究中心主任帕特里齊亞·卡瓦佐尼在四月份向一家遊説團體做報告時承認“我們在確保非處方藥品質量方面存在一些漏洞”。拜登政府最新的預算請求包括一個機構提案,將解決眼藥水召回中確定的主要缺陷之一:要求首次生產非處方產品的製造商在銷售前提前六個月通知FDA,可能允許進行檢查。
據彭博新聞報道,政府還在考慮更廣泛的方式來解決藥品質量問題。可能的措施包括:增加未經通知的檢查和藥品進口檢測,以及為製造商制定新的質量評分。所有這些都需要資金。即使支持者們表示,滿足政府明年對FDA預算增加10%的要求也將是具有挑戰性的。
追究造成感染的責任人也比看起來更困難。現在失明的佛羅里達退休者奧利瓦和只能用一隻眼睛的南卡羅來納人馬特雷,是起訴Global Pharma、EzriCare或Delsam Pharma的幾個人之一。分銷商和製造商可能會在法庭上互相推卸責任,就像他們在法庭之外所做的那樣,而Global Pharma可能完全可以逃避美國法律體系的管轄。一些訴訟還將亞馬遜和沃爾瑪等零售商列為被告,他們通常通過聲稱分銷商有錯來避免在有缺陷產品案件中承擔責任。等等。
泰米爾納德邦的藥品官員似乎已經免除了Global Pharma的責任。他們在三月份表示,在該公司的工廠進行的抽樣檢測中沒有檢測到假單胞菌。按照印度的慣例,他們沒有分享他們檢查的結果。在四月份退休前不久接受採訪時,該邦首席藥品監管官P.V.維賈亞拉克什米拒絕回答與檢查相關的大多數問題,因為她表示這些信息是機密的。然後她稱問題的語氣是不尊重的,並結束了採訪。她的繼任者沒有回應採訪請求。
在美國禁止進口幾周後,Global Pharma通過斯洛伐克衞生當局的檢查,他們表示其工廠符合歐盟製造非無菌藥品的標準。ImportGenius的記錄顯示,葡萄牙和法國的分銷商今年已收到來自Global Pharma的貨物,其中包括治療胃酸逆流的藥丸、抗組胺藥和陰囊瘙癢霜。
當涉及到美國經銷商時,FDA可能會與司法部合作,提起刑事訴訟,可能包括罰款和監禁。曾代表食品細菌爆發受害者的律師比爾·馬勒説:“我可以看到他們會對產品銷售商進行嚴格審查,並就他們所知道的事情提出很多非常困難的問題。他們是否進行了任何調查?他們是否瞭解產品?”
 另一種假眼藥水“Ocean Tears”,布朗和佩特里斯提交給FDA。來源:NIH檢查員於三月份訪問了位於新澤西州萊克伍德工業園區的EzriCare倉庫,並根據提供給Bloomberg Businessweek的文件,報告稱其製造商缺乏質量控制和監督。EzriCare的另一位律師、前FDA官員本傑明·英格蘭回應稱,該公司已經停止分發任何帶有EzriCare標籤的產品,並將銷燬其庫存的乳霜和藥膏。他告訴FDA,“人工眼淚的配方、包裝系統設計和製造”是由Global Pharma而不是EzriCare執行的。
另一種假眼藥水“Ocean Tears”,布朗和佩特里斯提交給FDA。來源:NIH檢查員於三月份訪問了位於新澤西州萊克伍德工業園區的EzriCare倉庫,並根據提供給Bloomberg Businessweek的文件,報告稱其製造商缺乏質量控制和監督。EzriCare的另一位律師、前FDA官員本傑明·英格蘭回應稱,該公司已經停止分發任何帶有EzriCare標籤的產品,並將銷燬其庫存的乳霜和藥膏。他告訴FDA,“人工眼淚的配方、包裝系統設計和製造”是由Global Pharma而不是EzriCare執行的。
檢查員還訪問了布朗克斯的阿魯穆甘藥房,並因對Global Pharma的監督不力而被指控。“我無法從這裏監控,”阿魯穆甘從櫃枱後説道。FDA發現他在2021年夏季的大部分時間裏將一些眼藥水存放在一個沒有温度監控的公共存儲設施中。報告稱,自召回以來,至少有五起與Delsam Pharma產品相關的眼部感染投訴被提交,而該公司沒有按照FDA的要求跟蹤不良事件的程序。“我交給我的律師處理了,”阿魯穆甘説。感染情況嚴重,但尚未被確認為銅綠假單胞菌。
五月份,乾眼基金會無法抵擋對機構防護欄的進一步測試。Petris和Brown成立了一家名為Ocean Tears LLC的公司,據説是眼藥水製造商。他們支付了大約500美元來建立這家公司並獲得Dun & Bradstreet編號,這是FDA軟件要求那些列出新的OTC產品的人必須提供的業務標識符。他們找到了一種方法,在標籤上包含一個虛構的專有物質作為其中的一種非活性成分。這個列表 順利通過了系統。
他們變得更加大膽,又發明了另一種眼藥水,稱之為美人魚之淚。他們寫道,它的作用是“保護眼睛免受鹽水刺激”和“讓您在水下看起來像美人魚一樣”。在標籤上的警告中,他們包括了這一條:“這是一種未保存的眼藥水,包裝在標準眼藥水瓶中。”任何意外吞下它的人都被建議儘快尋求醫療幫助,最好是在水族館。
Petris和Brown也沒有遇到任何問題,然後,兩個月後,在彭博社的詢問之後,FDA阻止了他們的虛假公司列出新產品。不過,如果他們想要生產和銷售他們的美人魚之淚,似乎沒有人會阻止他們。